江苏省宿迁市沭阳县2022-2023学年九年级第六次联考测试化学试题
试卷更新日期:2023-06-01 类型:月考试卷
一、单选题
-
1. 下列工业制法的原理主要属于物理变化的是( )A、工业制氧气 B、工业制二氧化碳 C、工业炼铁 D、工业制玻璃2. 下列有关分子、原子、离子的说法中,正确的是( )A、原子都是由质子、中子、核外电子构成的 B、分子的质量一定比原子的质量大 C、硫酸铵由硫酸根离子和铵根离子构成 D、保持水化学性质的最小粒子是氢原子和氧原子3. 下列归类正确的是( )A、清洁能源:风能、石油、太阳能 B、金属材料:黄铜、生铁、赤铁矿石 C、常见的碱:熟石灰、苛性钠、纯碱 D、混合物:空气、煤、石灰石4. 我国科学家用新型催化剂将二氧化碳高效转化为甲醇,其反应的微观示意图如下。下列说法正确的是( )
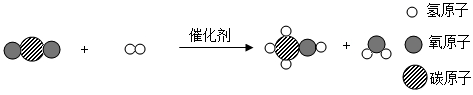 A、甲醇相对分子质量为32g B、该反应前后分子个数不变 C、反应物、生成物中共有三种无机物 D、参加反应的二氧化碳和氢气质量比为22:35. 下列实验操作或方法能达到实验目的的是( )
A、甲醇相对分子质量为32g B、该反应前后分子个数不变 C、反应物、生成物中共有三种无机物 D、参加反应的二氧化碳和氢气质量比为22:35. 下列实验操作或方法能达到实验目的的是( )选项
实验目的
实验操作或方法
A
把稀盐酸变浓
可以用蒸发溶剂的方法
B
证明氢氧化钠溶液变质程度
先加足量的氢氧化钙溶液,再加酚酞试液
C
鉴别K2SO4、FeCl3、Ba(OH)2、NaOH溶液
不另加试剂
D
除去CO2中含有的少量CO
将混合气体点燃
A、A B、B C、C D、D6. 溶液对于自然界中的生命活动和人类生产活动具有重要意义,如图是甲、乙、丙三种固体物质的溶解度曲线(固体均不含结晶水),下列说法不正确的是( )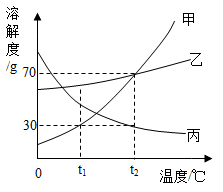 A、甲中混有少量乙,可采用降温结晶的方法提纯甲 B、t1℃时,将20g甲加入50g水中充分溶解后可得到70g溶液 C、t1℃时,等质量的甲、乙、丙固体形成饱和溶液时所需水的质量关系:甲>丙>乙 D、将t2℃时甲、乙、丙三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系:乙>甲=丙7. 将一定量金属M加入Zn(NO3)2和Cu(NO3)2的混合溶液中,充分反应后,过滤,得到固体滤渣,滤液为无色,向滤渣中滴加稀盐酸,有气泡产生。下列有关判断正确的是( )A、金属活动性:M>Zn>Cu B、滤液中可能只含一种溶质 C、滤渣中一定含有金属M D、该过程一定发生了如下反应:8. 下列各组离子在指定的溶液中,能大量共存的一组是( )A、无色溶液中: B、酸性溶液中: C、pH=11的溶液中: D、含有大量的溶液中:9. 在化学反应A2+BC=B+A2C中,反应物BC与生成物B的质量关系如图所示,若1gA2和40gBC恰好完全反应,则生成A2C的质量为( )
A、甲中混有少量乙,可采用降温结晶的方法提纯甲 B、t1℃时,将20g甲加入50g水中充分溶解后可得到70g溶液 C、t1℃时,等质量的甲、乙、丙固体形成饱和溶液时所需水的质量关系:甲>丙>乙 D、将t2℃时甲、乙、丙三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系:乙>甲=丙7. 将一定量金属M加入Zn(NO3)2和Cu(NO3)2的混合溶液中,充分反应后,过滤,得到固体滤渣,滤液为无色,向滤渣中滴加稀盐酸,有气泡产生。下列有关判断正确的是( )A、金属活动性:M>Zn>Cu B、滤液中可能只含一种溶质 C、滤渣中一定含有金属M D、该过程一定发生了如下反应:8. 下列各组离子在指定的溶液中,能大量共存的一组是( )A、无色溶液中: B、酸性溶液中: C、pH=11的溶液中: D、含有大量的溶液中:9. 在化学反应A2+BC=B+A2C中,反应物BC与生成物B的质量关系如图所示,若1gA2和40gBC恰好完全反应,则生成A2C的质量为( )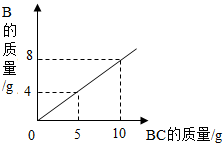 A、64g B、18g C、80g D、9g10. 下列图像与对应叙述相符的是( )A、
A、64g B、18g C、80g D、9g10. 下列图像与对应叙述相符的是( )A、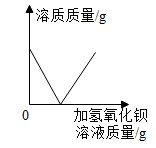 向一定量硫酸钠溶液中不断加入氢氧化钡溶液
B、
向一定量硫酸钠溶液中不断加入氢氧化钡溶液
B、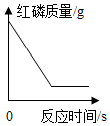 红磷与足量的O2充分反应
C、
红磷与足量的O2充分反应
C、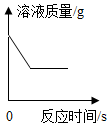 铁与硫酸铜溶液的反应
D、
铁与硫酸铜溶液的反应
D、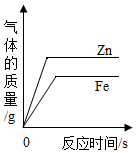 分别向两支装有足量锌和铁的试管中,加入等质量等溶质质量分数的稀盐酸
分别向两支装有足量锌和铁的试管中,加入等质量等溶质质量分数的稀盐酸
二、填空题
-
11. 请用化学用语填空。(1)、2个氦原子。(2)、发酵粉的主要成分。(3)、标出硝酸钾中氮元素的化合价。(4)、n个碳酸根离子。12. 化学就在我们身边,生活中蕴藏着丰富的化学知识。(1)、鉴别棉纤维和羊毛纤维的方法是。(2)、健康的生活离不开化学,下列叙述不正确的是____(填字母)。A、霉变的花生、大米蒸煮后仍不可食用 B、用甲醛水溶液浸泡海鲜以延长保质期 C、含有食品添加剂的食品对人体都有害 D、合理摄入油脂有益身体健康 E、食用含碳酸钙的钙片作补钙剂(3)、钙、钠、锌等元素对人体健康有着重要的作用。上述三种元素中,属于微量元素的是(填元素符号)。(4)、氢化镁(MgH2)是一种相对廉价的储氢材料。当它与水混合时放出氢气,同时生成一种碱,该反应的化学方程式是。13. 某工厂废液中含有氯化钾、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分为Fe2O3),要求全过程不引入其他金属元素。设计实验方案如下图所示:
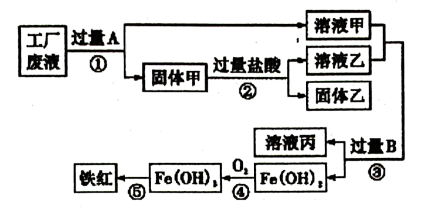
请回答下列问题:
(1)、工厂废液中加入过量A反应的化学方程式为。(2)、用化学式表示固体甲的成分:。(3)、溶液甲中的金属离子是(用离子符号表示)。(4)、完成步骤④的化学方程式: , 判断的依据。三、综合题
-
14. 如图所示进行碳的氧化物的性质实验,请回答下列问题。
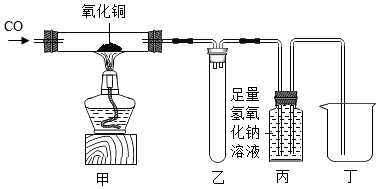 (1)、甲处的实验现象为 , 发生的化学反应方程式为。(2)、乙装置的作用是防止液体倒吸,丙装置的作用是。15.(1)、碱石灰是氧化钙和固体氢氧化钠的混合物,常用作干燥剂。它极易与空气中的水蒸气、二氧化碳反应而变质,因此在实验室里碱石灰应保存。实验室现有一瓶敞口放置的碱石灰,甲同学决定对其成分进行探究:(2)、【猜想】猜想Ⅰ:未变质,样品中只含有氧化钙和氢氧化钠。
(1)、甲处的实验现象为 , 发生的化学反应方程式为。(2)、乙装置的作用是防止液体倒吸,丙装置的作用是。15.(1)、碱石灰是氧化钙和固体氢氧化钠的混合物,常用作干燥剂。它极易与空气中的水蒸气、二氧化碳反应而变质,因此在实验室里碱石灰应保存。实验室现有一瓶敞口放置的碱石灰,甲同学决定对其成分进行探究:(2)、【猜想】猜想Ⅰ:未变质,样品中只含有氧化钙和氢氧化钠。猜想Ⅱ:部分变质,样品中只含有碳酸钙和氢氧化钠。
猜想Ⅲ:完全变质,样品中只含有碳酸钙和碳酸钠。
【资料】氯化钙溶液呈中性,碳酸钠溶液呈碱性。
【实验】设计如下流程进行实验:
步骤1:取少量碱石灰样品于烧杯中,加入足量的水,充分搅拌后过滤,得到滤渣和溶液M。
步骤2:向滤渣中滴加过量稀盐酸,产生气泡,得到溶液N,则N中所含的溶质有(用化学式表示)。
步骤3:取少量溶液M于试管中,先滴加酚酞溶液,观察到溶液变成红色,再滴加过量氯化钙溶液,观察到。
综合以上实验现象,证明猜想Ⅲ正确。
(3)、【拓展】乙同学取一定量的溶液N于烧杯中,向其中逐滴滴入溶液M,测得烧杯内溶液的pH与所加溶液M的质量的关系如图所示,则BC段发生反应的化学方程式为 。图中 (填“A”“B”“C”或“D”)点对应的溶液中所含溶质种类最少。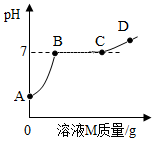 16. 实验室制取某种气体X,X为氢气、氧气或二氧化碳中的一种。根据下图回答下列问题:
16. 实验室制取某种气体X,X为氢气、氧气或二氧化碳中的一种。根据下图回答下列问题: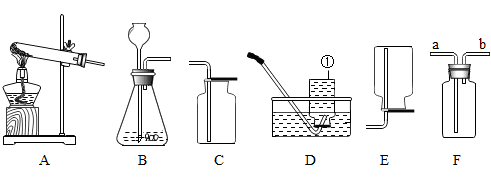 (1)、仪器①的名称。(2)、若将B和E连接制取气体X,则X为。(3)、若将B和C或B和D连接都可制取气体X,则化学方程式为。(4)、若锥形瓶中盛装大理石,来制取气体X,用F装置收集,则气体从(填字母)管通入。(5)、实验室中用氯化铵固体和氢氧化钙固体混合加热制得NH3,用该法制取NH3时,其发生装置应选用。(填字母)17. 已知A、B、C、D、E、F分别为氢氧化钠溶液、硝酸钠溶液、稀盐酸、碳酸钾溶液、氯化钡溶液、硝酸铜溶液中的一种。小明同学为鉴别以上六种溶液,进行如下实验:
(1)、仪器①的名称。(2)、若将B和E连接制取气体X,则X为。(3)、若将B和C或B和D连接都可制取气体X,则化学方程式为。(4)、若锥形瓶中盛装大理石,来制取气体X,用F装置收集,则气体从(填字母)管通入。(5)、实验室中用氯化铵固体和氢氧化钙固体混合加热制得NH3,用该法制取NH3时,其发生装置应选用。(填字母)17. 已知A、B、C、D、E、F分别为氢氧化钠溶液、硝酸钠溶液、稀盐酸、碳酸钾溶液、氯化钡溶液、硝酸铜溶液中的一种。小明同学为鉴别以上六种溶液,进行如下实验:Ⅰ:观察颜色
发现只有E溶液呈蓝色,其余为无色。
Ⅱ:将无色溶液两两混合
F与D,有气体生成;D与B,有白色沉淀生成。
回答下列问题:
(1)、B与D反应的化学方程式为。(2)、小华同学认为小明同学的实验无法鉴别出两种物质,它们是。为一次鉴别二者,除了可以选用已有溶液,还可以可选用以下试剂或用品中的(填字母)继续实验。a.石蕊溶液 b.硫酸铁溶液 c.pH试纸 d.氯化镁溶液
四、计算题
-
18. 某实验小组为测定铜和氧化铜的混合物中铜元素的含量,取20g该固体混合物,向其中逐滴加入稀H2SO4 , 测得剩余固体的质量与加入稀H2SO4的质量关系如图所示。
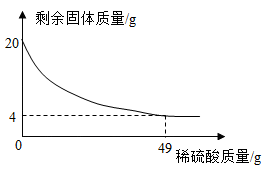
回答下列问题:
(1)、该固体混合物中铜元素的质量为。(2)、计算稀H2SO4中溶质的质量分数(写出计算过程)。