江苏省南京市秦淮区六校2022-2023学年九年级下学期3月复习(零模)化学试题
试卷更新日期:2023-06-01 类型:月考试卷
一、单选题
-
1. 《天工开物》记载的下列造物过程中涉及化学变化的是( )A、棉线织布 B、粮食酿酒 C、楠木制舟 D、沙里淘金2. 下列实验操作图示正确的是( )A、
 检查气密性
B、
检查气密性
B、 点燃酒精灯
C、
点燃酒精灯
C、 加热液体
D、
加热液体
D、 稀释浓硫酸
3. 下列物质由离子构成的是( )A、水 B、硫酸铜 C、石墨 D、二氧化碳4. 下列物质属于复合肥的是( )A、FeSO4 B、CO(NH2)2 C、KNO3 D、Ca(H2PO4)25. 北京冬奥会上采用了碲化镉发电玻璃,碲元素在元素周期表中的信息如下图所示。下列有关碲的说法正确的是( )
稀释浓硫酸
3. 下列物质由离子构成的是( )A、水 B、硫酸铜 C、石墨 D、二氧化碳4. 下列物质属于复合肥的是( )A、FeSO4 B、CO(NH2)2 C、KNO3 D、Ca(H2PO4)25. 北京冬奥会上采用了碲化镉发电玻璃,碲元素在元素周期表中的信息如下图所示。下列有关碲的说法正确的是( )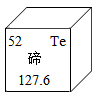 A、碲原子的最外层电子数为52 B、碲的元素符号为Te C、碲的相对原子质量为127.6g D、碲属于金属元素6. 下列物质的化学式不正确的是( )A、干冰—CO2 B、消石灰—Ca(OH)2 C、纯碱一NaOH D、小苏打一NaHCO37. 一些食物的近似pH如下,其中酸性最强的是( )A、柠檬汁2.2-2.4 B、苹果汁2.9-3.3 C、番茄汁4.0~4.4 D、鸡蛋清7.6-8.08. 合理科学的膳食能为人体提供必须的营养素和化学元素以维持人体健康。下列说法正确的是( )A、米饭、面条可为人体提供丰富的蛋白质 B、在人类食物供给的总能量中,有60%-70%来自油脂 C、佝偻病患者可在医嘱下服用含碳酸钙的钙片来补钙 D、葡萄糖锌(C12H22O14Zn)口服液能为人体提供常量元素Zn9. 下列有关物质的性质与用途对应关系正确的是( )A、CO2能与水反应,可用于灭火 B、氧气具有助燃性,常作火箭推进燃料 C、金属铁具有导电性,可用于制铁锅 D、氮气化学性质不活泼,可用作保护气10. 下列对实验现象的描述符合事实的是()A、硫在空气中燃烧,发出蓝紫色火焰 B、NH4NO3固体溶于水,溶液的温度升高 C、黄铜片与铜片相互刻画,铜片上有划痕 D、打开盛有浓盐酸的试剂瓶,有大量白烟产生11. 大蒜素(C6H10S2O)能杀灭多种细菌。下列有关大蒜素的说法正确的是( )A、氢元素的质量分数最大 B、大蒜素的相对分子质量为162g C、一个大蒜素分子由19个原子构成 D、大蒜素中碳、氢元素的质量比为3:512. 在点燃条件下,甲和乙反应前后分子种类变化的微观过程如图所示。下列叙述错误的是( )
A、碲原子的最外层电子数为52 B、碲的元素符号为Te C、碲的相对原子质量为127.6g D、碲属于金属元素6. 下列物质的化学式不正确的是( )A、干冰—CO2 B、消石灰—Ca(OH)2 C、纯碱一NaOH D、小苏打一NaHCO37. 一些食物的近似pH如下,其中酸性最强的是( )A、柠檬汁2.2-2.4 B、苹果汁2.9-3.3 C、番茄汁4.0~4.4 D、鸡蛋清7.6-8.08. 合理科学的膳食能为人体提供必须的营养素和化学元素以维持人体健康。下列说法正确的是( )A、米饭、面条可为人体提供丰富的蛋白质 B、在人类食物供给的总能量中,有60%-70%来自油脂 C、佝偻病患者可在医嘱下服用含碳酸钙的钙片来补钙 D、葡萄糖锌(C12H22O14Zn)口服液能为人体提供常量元素Zn9. 下列有关物质的性质与用途对应关系正确的是( )A、CO2能与水反应,可用于灭火 B、氧气具有助燃性,常作火箭推进燃料 C、金属铁具有导电性,可用于制铁锅 D、氮气化学性质不活泼,可用作保护气10. 下列对实验现象的描述符合事实的是()A、硫在空气中燃烧,发出蓝紫色火焰 B、NH4NO3固体溶于水,溶液的温度升高 C、黄铜片与铜片相互刻画,铜片上有划痕 D、打开盛有浓盐酸的试剂瓶,有大量白烟产生11. 大蒜素(C6H10S2O)能杀灭多种细菌。下列有关大蒜素的说法正确的是( )A、氢元素的质量分数最大 B、大蒜素的相对分子质量为162g C、一个大蒜素分子由19个原子构成 D、大蒜素中碳、氢元素的质量比为3:512. 在点燃条件下,甲和乙反应前后分子种类变化的微观过程如图所示。下列叙述错误的是( )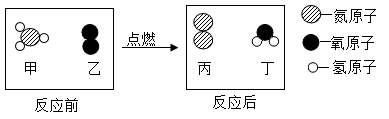 A、甲的化学式为NH3 B、反应前后原子种类不变 C、该反应中乙具有氧化性 D、反应生成的丙与丁的质量比为14∶913. 除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案可行的是( )A、CO2(CO气体)——点燃气体 B、CaO固体(CaCO3)—— 高温充分煅烧 C、KCl固体(MnO2)—— 加水充分溶解,过滤,洗涤,干燥 D、NaCl溶液(Na2CO3)—— 加入过量的氯化钙溶液,过滤14. 下列图示与对应叙述相符的是( )A、
A、甲的化学式为NH3 B、反应前后原子种类不变 C、该反应中乙具有氧化性 D、反应生成的丙与丁的质量比为14∶913. 除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案可行的是( )A、CO2(CO气体)——点燃气体 B、CaO固体(CaCO3)—— 高温充分煅烧 C、KCl固体(MnO2)—— 加水充分溶解,过滤,洗涤,干燥 D、NaCl溶液(Na2CO3)—— 加入过量的氯化钙溶液,过滤14. 下列图示与对应叙述相符的是( )A、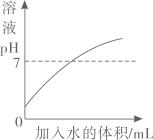 表示向稀盐酸中不断加水后,溶液的pH变化情况
B、
表示向稀盐酸中不断加水后,溶液的pH变化情况
B、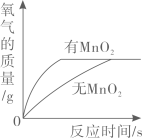 表示二氧化锰在用过氧化氢制取氧气时所起的作用
C、
表示二氧化锰在用过氧化氢制取氧气时所起的作用
C、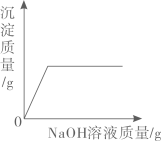 表示向盐酸和硫酸铜混合溶液中滴加氢氧化钠溶液
D、
表示向盐酸和硫酸铜混合溶液中滴加氢氧化钠溶液
D、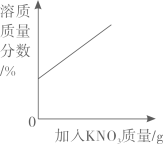 表示20℃时,向饱和硝酸钾溶液中加入硝酸钾固体
15. 用氯离子传感器采集数据,向一定体积、一定浓度的氯化钠溶液中慢慢加入等体积、一定浓度的硝酸银溶液,恰好完全反应。实验数据如图所示。下列说法错误的是( )
表示20℃时,向饱和硝酸钾溶液中加入硝酸钾固体
15. 用氯离子传感器采集数据,向一定体积、一定浓度的氯化钠溶液中慢慢加入等体积、一定浓度的硝酸银溶液,恰好完全反应。实验数据如图所示。下列说法错误的是( )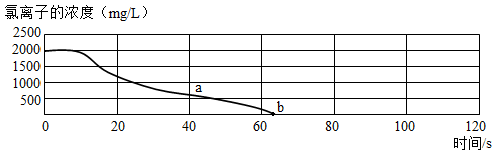 A、b点时溶液不导电 B、a点溶液中的离子为Na+、Cl-、 C、反应时观察到有白色沉淀生成 D、该反应的基本反应类型为复分解反应
A、b点时溶液不导电 B、a点溶液中的离子为Na+、Cl-、 C、反应时观察到有白色沉淀生成 D、该反应的基本反应类型为复分解反应二、实验题
-
16. 根据以下实验装置,回答有关问题。
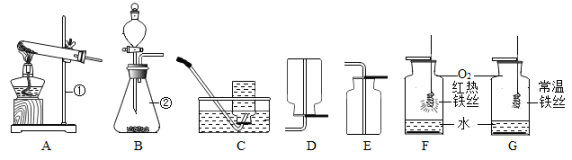 (1)、写出装置图中标号仪器的名称:②。(2)、实验室制取二氧化碳,发生反应的化学方程式为 , 用相同的实验装置制取氧气,发生反应的化学方程式为。(3)、用铁丝进行图F和图G对比实验,实验中发现G中铁丝不燃烧,其原因是 , F中反应的化学方程式为。(4)、中国天宫空间站获取氧气的主要方式是电解水,若得到16 kg的氧气,理论上最少消耗水的质量是多少?(利用化学方程式进行计算,写出计算过程)
(1)、写出装置图中标号仪器的名称:②。(2)、实验室制取二氧化碳,发生反应的化学方程式为 , 用相同的实验装置制取氧气,发生反应的化学方程式为。(3)、用铁丝进行图F和图G对比实验,实验中发现G中铁丝不燃烧,其原因是 , F中反应的化学方程式为。(4)、中国天宫空间站获取氧气的主要方式是电解水,若得到16 kg的氧气,理论上最少消耗水的质量是多少?(利用化学方程式进行计算,写出计算过程)三、综合题
-
17. 2022年北京成功举办冬奥会,化学功不可没。(1)、冬奥会环保人员的服装面料是利用回收废弃的塑料瓶加工制成。塑料属于(填字母)。
a.金属材料 b.复合材料 c.合成材料
(2)、冬奥会速滑场馆“冰丝带”采用的是CO2跨临界直冷制冰。①对CO2气体加压、降温,可得到干冰,从构成物质微粒角度分析,该过程主要改变的是分子的。
②捕集、利用和封存CO2是实现碳中和的一种途径。下图是利用氢氧化钠溶液吸收CO2的部分转化关系图。
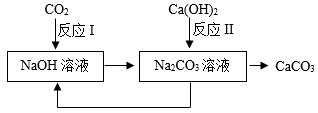
反应Ⅰ的化学方程式为 , 该转化中可以循环利用的物质是。
(3)、冬奥会上提供经过二氧化氯消毒处理的直饮水。①二氧化氯的化学式为。
②请设计实验证明该直饮水是软水,并完成实验报告。
实验步骤
实验现象
实验结论
18. 溶液在生产生活中有重要的用途。(1)、I、20℃时,将等质量的硝酸钾和氯化钠分别加入到盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钠的溶解度曲线如图2所示。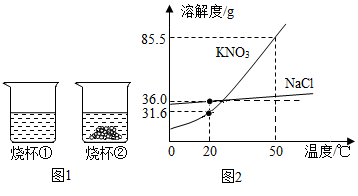
烧杯(填序号)中加入的固体是硝酸钾。
(2)、将温度升高到50℃,烧杯①内溶液中溶质的质量分数烧杯②内溶液中溶质的质量分数(填“>”或“<”或“=”)。(3)、硝酸钾中混有少量的氯化钠,若要提纯硝酸钾,可采用的方法是。(4)、Ⅱ、“配制一定溶质质量分数的氯化钠溶液”是初中化学的基础实验之一,回答下列问题。现欲配制一瓶500g溶质质量分数为0.9%的生理盐水,需要氯化钠固体g。此时需要用到的玻璃仪器有:烧杯、玻璃棒、胶头滴管和。
(5)、下列实验操作与目的分析均正确的是(填序号)。实验操作
目的分析
A
称量时,将取出的过量氯化钠放回原瓶
节约药品
B
溶解氯化钠时用玻璃棒搅拌
增大氯化钠的溶解度
C
称取氯化钠时,在两边托盘上放一张等质量的纸
整洁美观
D
量取水时,视线与液体凹液面的最低处保持水平
准确细致
19. 人类文明进步与金属材料发展关系十分密切。(1)、I、炼铁厂常以赤铁矿、焦炭、石灰石、空气等为主要原料炼铁,反应过程如下:
请写出步骤3反应的化学方程式:。
(2)、Ⅱ、铝和铝合金是一类重要的金属材料,工业上用铝土矿(含有Al2O3和SiO2 , 不考虑其它杂质)制取金属铝的基本流程如下:
已知:①SiO2是一种难溶于水,也不与盐酸、硫酸反应的物质;
②铝盐与氨水反应,生成氢氧化铝沉淀和铵盐。
操作I的名称是。
(3)、检验滤液Ⅰ中是否还含有硫酸,可以选择(填试剂名称),若现象是 , 则表明滤液Ⅰ中仍然含有硫酸。(4)、滤液Ⅱ中溶质的用途之一是。(5)、将熔融状态的氧化铝通电发生分解反应,得到单质铝和另一种单质的的反应方程式为。(6)、工业上电解熔融的Al2O3时,还加入了冰晶石(Na3AlF6)作熔剂,其作用是降低Al2O3的熔点,冰晶石在物质中的分类属于____(填字母)。A、酸 B、碱 C、盐 D、氧化物20. 图中A~F是初中化学常见的物质,其中A、B、C、D、E是不同类别的物质,E和F的物质类别相同,A的溶液为蓝色,C是密度最小的气体,汽车用铅酸蓄电池中含有E,图中“—”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,反应条件、部分反应物和生成物已略去。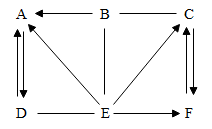 (1)、写出化学式:B , C。(2)、写出化学方程式:
(1)、写出化学式:B , C。(2)、写出化学方程式:A 转化为 D , E 转化为 F。
21. 某兴趣小组围绕中和反应进行了系列探究。(1)、【实验探究一】中和反应中宏观物质的变化小组同学进行图1所示的探究实验,A试管中现象为;B试管中反应的化学方程式为。
 (2)、针对B试管中无明显现象,小组同学又设计了图2的实验。
(2)、针对B试管中无明显现象,小组同学又设计了图2的实验。
溶液Y一定呈中性吗?小组同学产生了质疑。
查阅资料:酚酞在pH<8.2的溶液中呈无色,在8.2<pH<10.0的溶液中呈红色。
设计实验:
实验步骤
实验现象
实验结论
取少量无色溶液Y于试管中,加热蒸发
无明显现象
溶液Y呈中性
溶液Y呈碱性
得出结论:Y溶液呈碱性。
交流反思:Y溶液呈碱性,则Y溶液的溶质为。
(3)、【实验探究二】中和反应中微观粒子的变化中和反应的微观实质是。
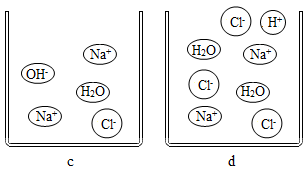
(4)、下列四幅图表示向氢氧化钠溶液中滴加过量稀盐酸的不同时间点的微观粒子示意图,请按时间先后排序(填序号)。
 (5)、【实验探究三】中和反应中能量的变化
(5)、【实验探究三】中和反应中能量的变化下图中产生现象能证明中和反应会放热。
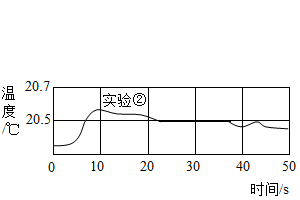
 (6)、有同学发现此结论不够严谨,在室温下设计了以下实验:
(6)、有同学发现此结论不够严谨,在室温下设计了以下实验:①10mL一定浓度的稀硫酸加10mL蒸馏水稀释,测量溶液温度的变化。
②10mL一定浓度的氢氧化钠溶液加10mL蒸馏水稀释,测量溶液温度的变化。
③10mL一定浓度的稀硫酸与10mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化。
用数字化实验技术测得3个实验,溶液温度随时间变化的关系如下图所示。则说明酸碱稀释不影响结论的理由是。

-