广东省深圳市龙岗区43校联考2022-2023学年九年级下学期4月月考化学试题
试卷更新日期:2023-06-01 类型:月考试卷
一、单选题
-
1. 深圳风量优美,吸引了很多游客前来旅游,以下景点活动涉及化学变化的是( )A、梧桐山顶看云海
 B、世界之窗的焰火表演
B、世界之窗的焰火表演 C、大梅沙海滩的沙
C、大梅沙海滩的沙 D、深圳欢乐谷的漂流
D、深圳欢乐谷的漂流 2. 化学与人类的科学技术、生产生活密切相关。下列说法正确的是( )A、煤的加工使煤成为可再生能源 B、钛合金属于合成材料 C、开发新能源可减少化石燃料的使用 D、CO2大量排放有利于植物的光合作用3. 下列实验操作正确的是( )A、溶液的稀释
2. 化学与人类的科学技术、生产生活密切相关。下列说法正确的是( )A、煤的加工使煤成为可再生能源 B、钛合金属于合成材料 C、开发新能源可减少化石燃料的使用 D、CO2大量排放有利于植物的光合作用3. 下列实验操作正确的是( )A、溶液的稀释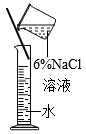 B、镁条的燃烧
B、镁条的燃烧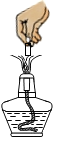 C、氯酸钾加热分解
C、氯酸钾加热分解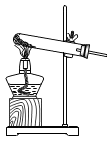 D、验证分子运动
D、验证分子运动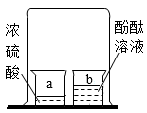 4. 下列化学用语表示正确的是( )A、二氧化氮:N2O B、氯元素:CL C、两个镁离子2Mg2+ D、Al加热的化学方程式:Al+O2Al2O35. 如图为铁在元素周期表中的相关信息,下列有关铁的说法正确的是( )
4. 下列化学用语表示正确的是( )A、二氧化氮:N2O B、氯元素:CL C、两个镁离子2Mg2+ D、Al加热的化学方程式:Al+O2Al2O35. 如图为铁在元素周期表中的相关信息,下列有关铁的说法正确的是( )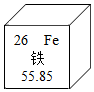 A、铁原子中的中子数为26 B、铁的相对原子质量是55.85 C、铁元素是地壳中含量最多的金属元素 D、Fe在潮湿的空气中生成Fe2O3很致密,对铁有保护作用6. 小力同学利用思维导图对NaOH的相关知识进行了梳理,下列描述错误的是( )A、物理性质:白色固体,易潮解 B、俗称:纯碱、火碱 C、化学性质,可与稀硫酸、CuSO4溶液、CO2反应 D、用途:用于制取肥皂,可除油污7. 2023年2月美国发生了氯乙烯C2H3Cl化学药品爆炸事故,造成了严重的环境污染。氯乙烯燃烧反应的微观示意图如下,下列说法正确的是( )
A、铁原子中的中子数为26 B、铁的相对原子质量是55.85 C、铁元素是地壳中含量最多的金属元素 D、Fe在潮湿的空气中生成Fe2O3很致密,对铁有保护作用6. 小力同学利用思维导图对NaOH的相关知识进行了梳理,下列描述错误的是( )A、物理性质:白色固体,易潮解 B、俗称:纯碱、火碱 C、化学性质,可与稀硫酸、CuSO4溶液、CO2反应 D、用途:用于制取肥皂,可除油污7. 2023年2月美国发生了氯乙烯C2H3Cl化学药品爆炸事故,造成了严重的环境污染。氯乙烯燃烧反应的微观示意图如下,下列说法正确的是( )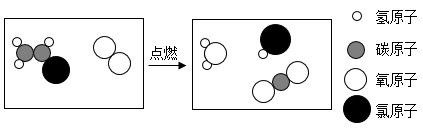 A、该反应前后分子和原子种类不变 B、反应生成的氧化物有三种 C、该反应的化学方程式为: D、生成的HCl气体溶于水形成的盐酸有腐蚀性8. L-脯氨酸(化学式为C5H9NO2)是氨基酸输液的重要原料,也是一种高效的有机小分子催化剂。下列关于L-脯氨酸的说法正确的是( )A、L-脯氨酸中有二氧化氮分子 B、L-脯氨酸中氢元素的质量分数最小 C、一个L-脯氨酸分子中共有18个原子 D、L-脯氨酸中碳、氢、氮、氧四种元素的质量比为5:9:1:29. 图为NH4HCO3和Na2CO3的溶解度曲线,下列有关说法错误的是( )
A、该反应前后分子和原子种类不变 B、反应生成的氧化物有三种 C、该反应的化学方程式为: D、生成的HCl气体溶于水形成的盐酸有腐蚀性8. L-脯氨酸(化学式为C5H9NO2)是氨基酸输液的重要原料,也是一种高效的有机小分子催化剂。下列关于L-脯氨酸的说法正确的是( )A、L-脯氨酸中有二氧化氮分子 B、L-脯氨酸中氢元素的质量分数最小 C、一个L-脯氨酸分子中共有18个原子 D、L-脯氨酸中碳、氢、氮、氧四种元素的质量比为5:9:1:29. 图为NH4HCO3和Na2CO3的溶解度曲线,下列有关说法错误的是( )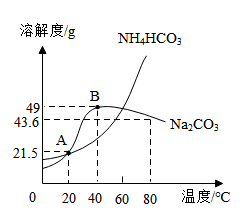 A、NH4HCO3的溶解度随温度的升高而增大 B、交点A表示此温度下NH4HCO3和Na2CO3两物质的饱和溶液中溶质的质量分数相等 C、B点时Na2CO3的饱和溶液温度升高会变成不饱和溶液 D、80℃时,NH4HCO3的溶解度大于Na2CO3的溶解度10. 下列鉴别物质的方法或除杂方法不可行的是( )
A、NH4HCO3的溶解度随温度的升高而增大 B、交点A表示此温度下NH4HCO3和Na2CO3两物质的饱和溶液中溶质的质量分数相等 C、B点时Na2CO3的饱和溶液温度升高会变成不饱和溶液 D、80℃时,NH4HCO3的溶解度大于Na2CO3的溶解度10. 下列鉴别物质的方法或除杂方法不可行的是( )选项
物质(括号内为杂质)
验目的
方法
A
NH4NO3固体与NaOH固体
鉴别
加水,溶解
B
软水与硬水
鉴别
加肥皂水振荡,观察
C
NaCl (Na2CO3)
除杂
加入足量的稀盐酸,蒸发
D
CO2(CO)
除杂
通过盛有NaOH溶液的洗气瓶
A、A B、B C、C D、D11. 如图所示的四个图象,不能正确反映对应变化关系的是( )A、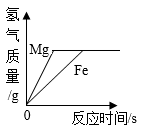 图像①表示向等质量、等质量分数的稀硫酸中分别加入过量的镁粉和铁粉
B、
图像①表示向等质量、等质量分数的稀硫酸中分别加入过量的镁粉和铁粉
B、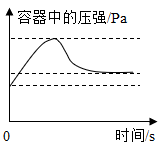 图像②表示在密闭容器中用红磷来测定空气中氧气含量时的压强变化
C、
图像②表示在密闭容器中用红磷来测定空气中氧气含量时的压强变化
C、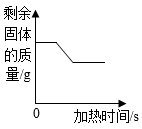 图象③表示加热时CO还原CuO过程中剩余固体的质量变化
D、
图象③表示加热时CO还原CuO过程中剩余固体的质量变化
D、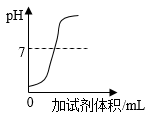 图像④表示向稀盐酸中滴加氢氧化钠溶液时pH值的变化
12. 有A、B、C、D、E五种物质。其中A固体俗称“干冰”,A和D是组成元素相同的气体,B是一种重要的建筑材料,C是碳酸饮料中的一种物质,E是一种常见的盐,但其水溶液显碱性,工业上广泛应用于玻璃、造纸、纺织和洗涤剂的生产等。它们之间的相互转化关系如图所示。下列说法正确的是( )
图像④表示向稀盐酸中滴加氢氧化钠溶液时pH值的变化
12. 有A、B、C、D、E五种物质。其中A固体俗称“干冰”,A和D是组成元素相同的气体,B是一种重要的建筑材料,C是碳酸饮料中的一种物质,E是一种常见的盐,但其水溶液显碱性,工业上广泛应用于玻璃、造纸、纺织和洗涤剂的生产等。它们之间的相互转化关系如图所示。下列说法正确的是( )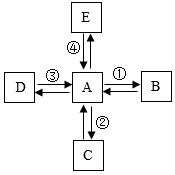 A、物质B是 , 反应①在实验中常用来检验CO2 B、反应②生成的C能使紫色石蕊试液变红 C、反应③生成A只能通过D燃烧实现 D、若反应④是E和稀HCl反应,化学方程式为
A、物质B是 , 反应①在实验中常用来检验CO2 B、反应②生成的C能使紫色石蕊试液变红 C、反应③生成A只能通过D燃烧实现 D、若反应④是E和稀HCl反应,化学方程式为二、综合题
-
13. 下列图示装置常用于实验室制取气体,请回答相关问题。
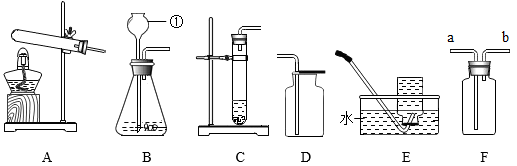 (1)、图中标号为①的仪器名称是。(2)、在实验室里,通过加热两种固体混合物制取较纯净的O2 , 请写出该反应的化学方程式 , 发生装置应选择 , 若用F装置作为收集装置,验满时可将燃着的小木条放在F装置的(填“a”或“b”)导管口处。(3)、B、C装置均可用作制取CO2的发生装置,B装置与C装置相比。其优点是。将CO2通入如图实验装置中,则出现的现象依次是 , 澄清石灰水石灰水变浑浊。
(1)、图中标号为①的仪器名称是。(2)、在实验室里,通过加热两种固体混合物制取较纯净的O2 , 请写出该反应的化学方程式 , 发生装置应选择 , 若用F装置作为收集装置,验满时可将燃着的小木条放在F装置的(填“a”或“b”)导管口处。(3)、B、C装置均可用作制取CO2的发生装置,B装置与C装置相比。其优点是。将CO2通入如图实验装置中,则出现的现象依次是 , 澄清石灰水石灰水变浑浊。
三、综合题
-
14. 实验室常用锌粒与稀H2SO4反应的方法制取H2。(1)、该反应的化学方程式为 , 稀硫酸和稀盐酸的化学性质相似是因为在溶液中都只含有一种阳离子是 , 小力同学把稀H2SO4换成了稀HCl,实验中看到收集到的气体中有白雾并闻到了刺激性气味,其他同学对他收集的气体成分产生了疑问,于是,小力同学进行了下列探究:(2)、【提出问题】锌粒与稀盐酸反应收集到的气体成分是什么?
【查阅资料】①无水硫酸铜是白色粉末,易吸水变蓝,遇HCl无明显现象
【猜想假设】猜想一:该气体为H2、H2O;
猜想二:该气体为H2、HCl;猜想三:该气体为。
(3)、小力同学认为猜想一不成立,理由是。(4)、【实验探究】小力同学查阅资料后,设计了下列实验验证猜想:
实验Ⅰ
实验Ⅱ
操作


现象
A中白色无水硫酸铜变为色,B中固体由黑色变成红色
D中产生色沉淀,且沉淀不溶于稀硝酸
结论
猜想成立
(5)、【反思拓展】小力同学利用锌粒与稀盐酸制得的H2中含有猜想三的杂质气体,他决定利用图示实验装置除去混有的气体,G瓶中发生反应的化学方程式为。

综合考虑利弊后,实验室制取氢气常用稀硫酸而不用稀盐酸。
15. 中国科研工作者发现在一定条件下,可以将温室气体CO2高效转化为高价值、高纯度的液体燃料甲酸(HCOOH),这样不仅能有效处理工业生产废气中的CO2 , 减少温室效应的加剧,还能转为燃料。下面是将含有二氧化碳较多的工业废气转化成甲酸的工业流程如图: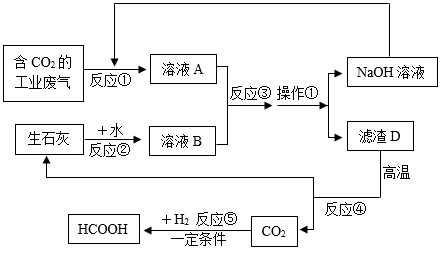
根据以上流程图回答下列问题:
(1)、请写出反应②在生活生产中的一项应用。(2)、操作①的步骤在实验操作中叫 , 该操作中玻璃棒的作用是。(3)、请写出反应③的化学反应方程式: , 该反应属于反应(填基本反应类型)。(4)、反应⑤是将CO2转化为液体燃料甲酸(HCOOH)的过程,该反应的化学方程式为。(5)、整个流程中能循环利用的物质除水外还有(填化学式)。16. 锂(Li)是新能源汽车电池中一种重要的金属元素。(1)、如图是锂的原子结构示意图,由图可知,锂化学性质活泼,易失去最外层电子形成(填粒子符号)。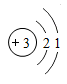 (2)、锂的化合物钴酸锂(LiCoO2)作为电极材料广泛用于新能源汽车的锂电池中,则LiCoO2中Co的化合价为。(3)、锂的化合物氢化锂(LiH)是一种很好的储氢材料,它常温下能稳定存在,但遇水就会立即与水发生反应,释放出大量的氧气,被称为“制造氢气的工厂”,该反应的化学方程式为LiH+H2O=LiOH+H2↑。现将20 g氯化锂(样品)放入装有100 g水的杯中,并记录杯中物质总质量随时间的变化如下表所示:(杂质不参加反应)
(2)、锂的化合物钴酸锂(LiCoO2)作为电极材料广泛用于新能源汽车的锂电池中,则LiCoO2中Co的化合价为。(3)、锂的化合物氢化锂(LiH)是一种很好的储氢材料,它常温下能稳定存在,但遇水就会立即与水发生反应,释放出大量的氧气,被称为“制造氢气的工厂”,该反应的化学方程式为LiH+H2O=LiOH+H2↑。现将20 g氯化锂(样品)放入装有100 g水的杯中,并记录杯中物质总质量随时间的变化如下表所示:(杂质不参加反应)时间/min
t1
t2
t3
t4
t5
杯中物质总质量/g
119
118
117
116
116
①由题所述,LiH在实验室保存时应注意保持;
②在t4时间节点,LiH恰好完全反应,反应产生的氢气总质量为g;
③求样品中氢化锂的质量分数。
-