上海市杨浦区2023年九年级下学期4月月考试题
试卷更新日期:2023-06-01 类型:月考试卷
一、单选题
-
1. 氢元素以游离态存在的物质是( )A、H2O B、H2SO4 C、H2 D、NaOH2. 物质对应的类别正确的是( )A、氧气:氧化物 B、胆矾:盐 C、大理石:纯净物 D、汽水:化合物3. 下列物质在氧气中燃烧,生成黑色固体物质的是( )A、木炭 B、硫粉 C、白磷 D、铁丝4. 属于钾肥的物质是( )A、K2SO4 B、CO(NH2)2 C、NH4Cl D、Ca(H2PO4)25. 加碘盐中的“碘”指的是()A、碘单质 B、碘原子 C、碘分子 D、碘元素6. 属于同素异形体的是( )A、蒸馏水和矿泉水 B、氧气和液氧 C、金刚石和石墨 D、干冰和冰7. 灼烧时,火焰呈黄色的是( )A、KCl B、Ca(NO3)2 C、CuCl2 D、NaNO38. 下列方法可将海水转化为淡水的是()A、蒸馏 B、静置 C、过滤 D、消毒9. 下列物质发生分解反应不可能生成氧气的是( )A、KMnO4 B、NaCl C、KClO3 D、H2O210. 物质的用途错误的是( )A、食盐:调味剂 B、干冰:人工降雨 C、一氧化碳:冶炼金属 D、熟石灰:改良碱性土壤11. 能鉴别稀硫酸和稀盐酸的试剂是( )A、石蕊试液 B、硝酸银溶液 C、硝酸钡溶液 D、碳酸钠溶液12. 下表中除杂方法正确的是( )
物质
所含杂质
除去杂质的方法
A
NaCl
Na2CO3
加入过量稀硫酸
B
CuO
Cu
加入过量稀盐酸
C
CO
CO2
通入过量氢氧化钠溶液
D
NaOH
Ca(OH)2
加入过量碳酸钠溶液
A、A B、B C、C D、D13. 甲烷和水蒸气制氢气的化学方程式:CH4+H2OCO+3H2 , 有关说法正确的是( )A、反应中CO是还原剂 B、参加反应的CH4和H2O的质量比为1:1 C、若生成3mol H2 , 则有1mol CH4参加反应 D、反应物的摩尔质量之和等于生成物的摩尔质量之和14. 在一定量的氯化铜溶液中加入一定量锌和金属R(化合物中,化合价为+2)的混合粉末,溶液质量的变化情况如图所示。下列说法正确的是( )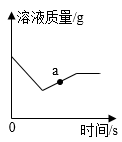 A、金属活动性:R<Zn B、相对原子质量:R<Cu C、a点对应的溶液中溶质有2种 D、溶液中铜元素的质量始终不变15. 酸的组成中一定含有( )A、金属元素 B、氢元素 C、原子团 D、酸根16. 关于燃烧的说法错误的是( )A、一定要有氧气 B、一定要达到可燃物的着火点 C、一定会放出热量 D、一定发生化学反应17. 从以下微观示意图中得到的结论正确的是( )
A、金属活动性:R<Zn B、相对原子质量:R<Cu C、a点对应的溶液中溶质有2种 D、溶液中铜元素的质量始终不变15. 酸的组成中一定含有( )A、金属元素 B、氢元素 C、原子团 D、酸根16. 关于燃烧的说法错误的是( )A、一定要有氧气 B、一定要达到可燃物的着火点 C、一定会放出热量 D、一定发生化学反应17. 从以下微观示意图中得到的结论正确的是( )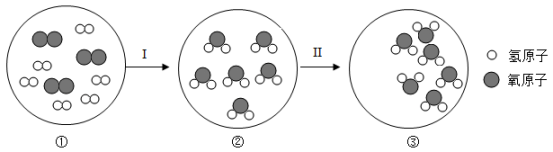 A、变化:I是化学变化 B、质量:① > ② C、结构:②③分子结构相同 D、条件:I、II变化时需要的条件相同
A、变化:I是化学变化 B、质量:① > ② C、结构:②③分子结构相同 D、条件:I、II变化时需要的条件相同二、填空题
-
18. 古代冶金技术彰显了我国劳动人民的智慧。(1)、战国《韩非子·内储说上》提到,早期采金技术均是“沙里淘金”。金在自然界中主要以(填“单质”或“化合物”)形式存在,金具有(填“难溶”或“易溶”)于水的性质。(2)、《淮南万毕术》记载有“曾青(指硫酸铜溶液)得铁化为铜”,该反应的化学方程式是 , 反应的基本类型是(3)、《格致粗谈》记载“赤铜入炉甘石炼为黄铜,其色如金”。把赤铜(Cu2O)和炉甘石、木炭粉混合高温制得黄铜。
I、Cu2O中铜元素的化合价是 , 1mol Cu2O中约含有个Cu原子。
II、反应的化学方程式:X+Cu2O+CZn+2Cu+2CO2↑。则炉甘石主要成分X的化学式是 , 根据产物可知黄铜中含有的金属是
三、综合题
-
19. 二氧化碳具有广泛的应用价值。(1)、实验室可用如图所示的装置制备二氧化碳。石灰石和稀盐酸反应的化学方程式是实验开始前,应从(填“a”或“b”)处装入石灰石;添加稀盐酸时,活塞k一般处于打开状态的原因是。
 (2)、用NaOH溶液“捕捉”CO2过程如下
(2)、用NaOH溶液“捕捉”CO2过程如下
I、“捕捉室”中NaOH溶液常喷成雾状的优点是发生反应的化学方程式是。
II、“反应、分离”环节中,分离物质采用的方法是。
III、若要确认“捕捉”后的气体中CO2含量低,你的实验设计方案是。
20. 氢氧化钠是重要的化工原料,在生产过程中常含少量的氯化钠杂质。(1)、氢氧化钠溶液的pH7(填“>”、“<”或“=”)。(2)、检验NaOH样品中含有NaCl杂质。操作
现象
结论
步骤一:取少量样品溶于水,先滴入酚酞试液,再滴入足量稀硝酸
样品中含有NaCl
步骤二:在上述反应所得的溶液中滴加溶液
产生白色沉淀
(3)、提纯NaOH样品。氯化钠和氢氧化钠的部分溶解度数据如下表。
温度(℃)
0
20
60
80
NaCl
35.7
36.0
37.1
38.4
NaOH
42
109
174
314
I、60℃时,NaCl的溶解度为g/100g水;20℃时,10g水中最多溶解NaOHg。
II、某同学进行如下实验:

i、溶液A中,NaOH(填“达到”或“未达到”)饱和状态。
ii、200g样品中NaOH的质量是。
iii、运用数据分析说明不能省略步骤III的原因。
21. 为测定已锈蚀的生铁粉(主要成分为铁、氧化铁、碳)中铁元素的含量。取7.3g样品进行实验,装置如下图所示。(夹持仪器省略)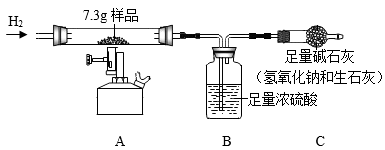 (1)、实验一:实验前先通一会儿氢气,再点燃酒精喷灯;反应一段时间后,A中固体全部变为黑色,停止加热,继续通氢气至固体冷却。反应前后B中质量增加0.54g,C中质量增加0.66g。
(1)、实验一:实验前先通一会儿氢气,再点燃酒精喷灯;反应一段时间后,A中固体全部变为黑色,停止加热,继续通氢气至固体冷却。反应前后B中质量增加0.54g,C中质量增加0.66g。实验前先通一会儿氢气的原因是。
(2)、A中发生反应的化学方程式是(一个即可)。(3)、碱石灰的作用是。(4)、实验二:将反应后A中的固体加入足量的稀硫酸中,固体全部溶解并产生0.22g气体。该生铁粉中铁元素的质量是g。
(5)、若不进行实验二,能否确定样品中铁元素的含量,请说明原因。
-