浙江省2023年1月普通高校招生选考化学试题
试卷更新日期:2023-05-29 类型:高考真卷
一、选择题
-
1. 下列物质中属于耐高温酸性氧化物的是A、 B、 C、 D、2. 硫酸铜应用广泛,下列说法错误的是A、元素位于周期表p区 B、硫酸铜属于强电解质 C、硫酸铜溶液呈酸性 D、硫酸铜能使蛋白质变性3. 下列化学用语表示正确的是A、中子数为18的氯原子: B、碳的基态原子轨道表示式:
 C、的空间结构:
C、的空间结构: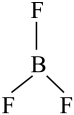 (平面三角形)
D、的形成过程:
(平面三角形)
D、的形成过程: 4. 物质的性质决定用途,下列两者对应关系错误的是A、能使某些色素褪色,可用作漂白剂 B、金属钠导热性好,可用作传热介质 C、溶液呈碱性,可用作消毒剂 D、呈红色,可用作颜料5. 下列关于元素及其化合物的性质说法错误的是A、和乙醇反应可生成 B、工业上煅烧黄铁矿生产 C、工业上用氨的催化氧化制备 D、常温下铁与浓硝酸反应可制备6. 关于反应 , 下列说法正确的是A、生成 , 转移电子 B、是还原产物 C、既是氧化剂又是还原剂 D、若设计成原电池,为负极产物7. 下列反应的离子方程式错误的是A、通入氢氧化钠溶液: B、氧化铝溶于氢氧化钠溶液: C、过量通入饱和碳酸钠溶液: D、溶液中滴入氯化钙溶液:8. 下列说法错误的是A、从分子结构上看糖类都是多羟基醛及其缩合产物 B、蛋白质溶液与浓硝酸作用产生白色沉淀,加热后沉淀变黄色 C、水果中因含有低级酯类物质而具有特殊香味 D、聚乙烯、聚氯乙烯是热塑性塑料9. 七叶亭是一种植物抗菌素,适用于细菌性痢疾,其结构如图,下列说法正确的是
4. 物质的性质决定用途,下列两者对应关系错误的是A、能使某些色素褪色,可用作漂白剂 B、金属钠导热性好,可用作传热介质 C、溶液呈碱性,可用作消毒剂 D、呈红色,可用作颜料5. 下列关于元素及其化合物的性质说法错误的是A、和乙醇反应可生成 B、工业上煅烧黄铁矿生产 C、工业上用氨的催化氧化制备 D、常温下铁与浓硝酸反应可制备6. 关于反应 , 下列说法正确的是A、生成 , 转移电子 B、是还原产物 C、既是氧化剂又是还原剂 D、若设计成原电池,为负极产物7. 下列反应的离子方程式错误的是A、通入氢氧化钠溶液: B、氧化铝溶于氢氧化钠溶液: C、过量通入饱和碳酸钠溶液: D、溶液中滴入氯化钙溶液:8. 下列说法错误的是A、从分子结构上看糖类都是多羟基醛及其缩合产物 B、蛋白质溶液与浓硝酸作用产生白色沉淀,加热后沉淀变黄色 C、水果中因含有低级酯类物质而具有特殊香味 D、聚乙烯、聚氯乙烯是热塑性塑料9. 七叶亭是一种植物抗菌素,适用于细菌性痢疾,其结构如图,下列说法正确的是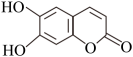 A、分子中存在2种官能团 B、分子中所有碳原子共平面 C、该物质与足量溴水反应,最多可消耗 D、该物质与足量溶液反应,最多可消耗10. X、Y、Z、M、Q五种短周期元素,原子序数依次增大。X的轨道全充满,Y的s能级电子数量是p能级的两倍,M是地壳中含量最多的元素,Q是纯碱中的一种元素。下列说法错误的是A、电负性: B、最高正价: C、Q与M的化合物中可能含有非极性共价键 D、最高价氧化物对应水化物的酸性:11. 在熔融盐体系中,通过电解和获得电池材料 , 电解装置如图,下列说法正确的是
A、分子中存在2种官能团 B、分子中所有碳原子共平面 C、该物质与足量溴水反应,最多可消耗 D、该物质与足量溶液反应,最多可消耗10. X、Y、Z、M、Q五种短周期元素,原子序数依次增大。X的轨道全充满,Y的s能级电子数量是p能级的两倍,M是地壳中含量最多的元素,Q是纯碱中的一种元素。下列说法错误的是A、电负性: B、最高正价: C、Q与M的化合物中可能含有非极性共价键 D、最高价氧化物对应水化物的酸性:11. 在熔融盐体系中,通过电解和获得电池材料 , 电解装置如图,下列说法正确的是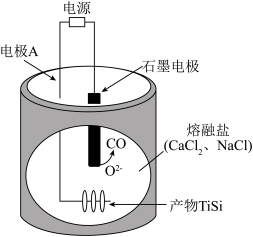 A、石墨电极为阴极,发生氧化反应 B、电极A的电极反应: C、该体系中,石墨优先于参与反应 D、电解时,阳离子向石墨电极移动12. 共价化合物中所有原子均满足8电子稳定结构,一定条件下可发生反应: , 下列说法错误的是A、的结构式为
A、石墨电极为阴极,发生氧化反应 B、电极A的电极反应: C、该体系中,石墨优先于参与反应 D、电解时,阳离子向石墨电极移动12. 共价化合物中所有原子均满足8电子稳定结构,一定条件下可发生反应: , 下列说法错误的是A、的结构式为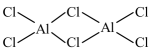 B、为非极性分子
C、该反应中的配位能力大于氯
D、比更难与发生反应
13. 甲酸是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分 , R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始关系如图(已知甲酸),下列说法错误的是
B、为非极性分子
C、该反应中的配位能力大于氯
D、比更难与发生反应
13. 甲酸是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分 , R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始关系如图(已知甲酸),下列说法错误的是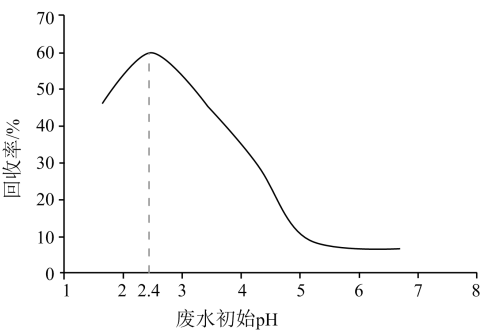 A、活性成分在水中存在平衡: B、的废水中 C、废水初始 , 随下降,甲酸的电离被抑制,与作用的数目减少 D、废水初始 , 离子交换树脂活性成分主要以形态存在14. 标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知和的相对能量为0],下列说法错误的是
A、活性成分在水中存在平衡: B、的废水中 C、废水初始 , 随下降,甲酸的电离被抑制,与作用的数目减少 D、废水初始 , 离子交换树脂活性成分主要以形态存在14. 标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知和的相对能量为0],下列说法错误的是 A、 B、可计算键能为 C、相同条件下,的平衡转化率:历程Ⅱ>历程Ⅰ D、历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:15. 碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中达到溶解平衡:
A、 B、可计算键能为 C、相同条件下,的平衡转化率:历程Ⅱ>历程Ⅰ D、历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:15. 碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中达到溶解平衡:[已知 , , 的电离常数],下列有关说法正确的是
A、上层清液中存在 B、上层清液中含碳微粒最主要以形式存在 C、向体系中通入气体,溶液中保持不变 D、通过加溶液可实现向的有效转化16. 探究铁及其化合物的性质,下列方案设计、现象和结论都正确的是实验方案
现象
结论
A
往溶液中加入片
短时间内无明显现象
的氧化能力比弱
B
往溶液中滴加溶液,再加入少量固体
溶液先变成血红色后无明显变化
与的反应不可逆
C
将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加溶液
溶液呈浅绿色
食品脱氧剂样品中没有价铁
D
向沸水中逐滴加5~6滴饱和溶液,持续煮沸
溶液先变成红褐色再析出沉淀
先水解得再聚集成沉淀
A、A B、B C、C D、D二、非选择题
-
17. 硅材料在生活中占有重要地位。请回答:(1)、分子的空间结构(以为中心)名称为 , 分子中氮原子的杂化轨道类型是。受热分解生成和 , 其受热不稳定的原因是。(2)、由硅原子核形成的三种微粒,电子排布式分别为:①、②、③ , 有关这些微粒的叙述,正确的是____。A、微粒半径:③>①>② B、电子排布属于基态原子(或离子)的是:①② C、电离一个电子所需最低能量:①>②>③ D、得电子能力:①>②(3)、Si与P形成的某化合物晶体的晶胞如图。该晶体类型是 , 该化合物的化学式为。
 18. 化合物X由三种元素组成,某学习小组按如下流程进行实验:
18. 化合物X由三种元素组成,某学习小组按如下流程进行实验: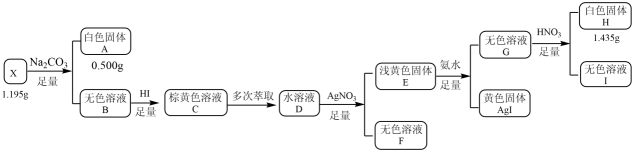
已知:白色固体A用溶解后,多余的酸用恰好中和,请回答:
(1)、X的组成元素是 , X的化学式是。(2)、写出溶液呈棕黄色所发生的化学反应方程式。(3)、写出生成白色固体H的离子方程式。(4)、设计实验检验溶液Ⅰ中的阳离子。19. “碳达峰·碳中和”是我国社会发展重大战略之一,还原是实现“双碳”经济的有效途径之一,相关的主要反应有:Ⅰ:
Ⅱ:
请回答:
(1)、有利于提高平衡转化率的条件是。A.低温低压B.低温高压C.高温低压D.高温高压
(2)、反应的 , (用表示)。(3)、恒压、时,和按物质的量之比投料,反应经如下流程(主要产物已标出)可实现高效转化。
①下列说法正确的是。
A.可循环利用,不可循环利用
B.过程ⅱ,吸收可促使氧化的平衡正移
C.过程ⅱ产生的最终未被吸收,在过程ⅲ被排出
D.相比于反应Ⅰ,该流程的总反应还原需吸收的能量更多
②过程ⅱ平衡后通入 , 测得一段时间内物质的量上升,根据过程ⅲ,结合平衡移动原理,解释物质的量上升的原因。
(4)、还原能力可衡量转化效率,(同一时段内与的物质的量变化量之比)。①常压下和按物质的量之比投料,某一时段内和的转化率随温度变化如图1,请在图2中画出间R的变化趋势,并标明时R值。

②催化剂X可提高R值,另一时段内转化率、R值随温度变化如下表:
温度/℃
480
500
520
550
转化率/%
7.9
11.5
20.2
34.8
R
2.6
2.4
2.1
1.8
下列说法错误的是
A.R值提高是由于催化剂X选择性地提高反应Ⅱ的速率
B.温度越低,含氢产物中占比越高
C.温度升高,转化率增加,转化率降低,R值减小
D.改变催化剂提高转化率,R值不一定增大
20. 某研究小组制备纳米 , 再与金属有机框架)材料复合制备荧光材料 , 流程如下:已知:①含锌组分间的转化关系:
②是的一种晶型,以下稳定。
请回答:
(1)、步骤Ⅰ,初始滴入溶液时,体系中主要含锌组分的化学式是。(2)、下列有关说法错误的是____。A、步骤Ⅰ,搅拌的作用是避免反应物浓度局部过高,使反应充分 B、步骤Ⅰ,若将过量溶液滴入溶液制备 , 可提高的利用率 C、步骤Ⅱ,为了更好地除去杂质,可用的热水洗涤 D、步骤Ⅲ,控温煅烧的目的是为了控制的颗粒大小(3)、步骤Ⅲ,盛放样品的容器名称是。(4)、用和过量反应,得到的沉淀可直接控温煅烧得纳米 , 沉淀无需洗涤的原因是。(5)、为测定纳米产品的纯度,可用已知浓度的标准溶液滴定。从下列选项中选择合理的仪器和操作,补全如下步骤[“ ”上填写一件最关键仪器 , “( )”内填写一种操作 , 均用字母表示]。用(称量样品)→用烧杯()→用( )→用移液管()→用滴定管(盛装标准溶液,滴定)
仪器:a、烧杯;b、托盘天平;c、容量瓶;d、分析天平;e、试剂瓶
操作:f、配制一定体积的Zn2+溶液;g、酸溶样品;h、量取一定体积的溶液;i、装瓶贴标签
(6)、制备的荧光材料可测浓度。已知的荧光强度比值与在一定浓度范围内的关系如图。某研究小组取人血浆铜蓝蛋白(相对分子质量),经预处理,将其中元素全部转化为并定容至。取样测得荧光强度比值为10.2,则1个血浆铜蓝蛋白分子中含个铜原子。
 21. 某研究小组按下列路线合成抗癌药物盐酸苯达莫司汀。
21. 某研究小组按下列路线合成抗癌药物盐酸苯达莫司汀。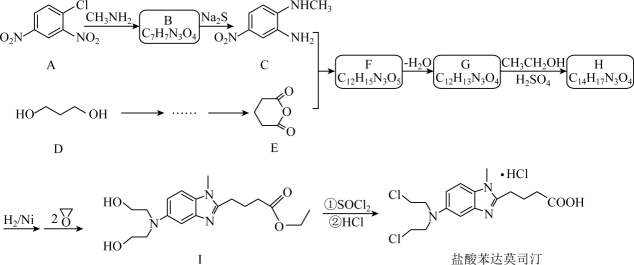
已知:①
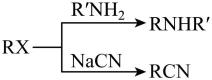
②

请回答:
(1)、化合物A的官能团名称是。(2)、化合物B的结构简式是。(3)、下列说法正确的是____。A、的反应类型为取代反应 B、化合物D与乙醇互为同系物 C、化合物I的分子式是 D、将苯达莫司汀制成盐酸盐有助于增加其水溶性(4)、写出的化学方程式。(5)、设计以D为原料合成E的路线(用流程图表示,无机试剂任选)。(6)、写出3种同时符合下列条件的化合物C的同分异构体的结构简式。①分子中只含一个环,且为六元环;②谱和谱检测表明:分子中共有2种不同化学环境的氢原子,无氮氮键,有乙酰基。