浙江省绍兴市2023届高三二模考试化学试题
试卷更新日期:2023-05-25 类型:高考模拟
一、选择题
-
1. 下列物质属于盐且水溶液呈酸性是A、 B、 C、 D、2. 化学与生活密切相关。下列叙述正确的是A、新冠病毒疫情期间,常用无水乙醇杀菌消毒 B、腈纶织物是通过丙烯腈缩聚而来 C、亚硝酸钠是一种防腐剂和护色剂 D、温室气体是形成酸雨的主要物质3. 下列化学用语表示正确的是A、中子数为17的硫离子: B、的形成过程:
 C、为位于周期表区
D、的球棍模型为:
C、为位于周期表区
D、的球棍模型为: 4. 物质的性质决定用途,下列两者对应关系不正确的是A、碳酸钠和碳酸氢钠的溶液均呈碱性,可用作食用碱或工业用碱 B、不锈钢中的合金元素主要是铬和镍,具有很强抗腐蚀能力,可用于医疗器材 C、硅的导电性介于导体与绝缘体之间,可用来生产光导纤维 D、次氯酸的强氧化性能使某些有机色素褪色,可用作棉麻的漂白剂5. 下列关于元素及其化合物的性质说法不正确的是A、浓硫酸与蔗糖反应,观察到蔗糖变黑,体现了浓硫酸的脱水性 B、硝酸见光受热易分解,一般保存在棕色试剂瓶中,放置在阴凉处 C、燃油发动机产生的、与反应能生成和 , 因此可以直接排放 D、铝制餐具不宜用来蒸煮或长时间存放酸性或者碱性食物6. 关于反应 , 下列说法正确的是A、消耗 , 转移电子 B、在此条件下,氧化性: C、既是氧化剂又是还原剂 D、氧化产物和还原产物的物质的量比为21∶87. 下列反应的离子方程式不正确的是A、通入溶液: B、硅酸钠溶液通入过量: C、硫酸氢铵溶液中滴入少量溶液: D、通入溶液中:8. 下列说法不正确的是A、少量的某些可溶性盐(如硫酸钠等)能促进蛋白质溶解· B、在酸和酶的作用下,蔗糖可水解成葡萄糖和果糖,属于还原性糖 C、DNA分子具有双螺旋结构,其中碱基通过氢键作用结合成碱基对 D、橡胶的硫化是以二硫键()将线型结构连接成网状,硫化程度过大弹性会变差9. 盐酸洛派丁胺是一种新型止泻药,适用于各种病因引起的腹泻。下列说法正确的是
4. 物质的性质决定用途,下列两者对应关系不正确的是A、碳酸钠和碳酸氢钠的溶液均呈碱性,可用作食用碱或工业用碱 B、不锈钢中的合金元素主要是铬和镍,具有很强抗腐蚀能力,可用于医疗器材 C、硅的导电性介于导体与绝缘体之间,可用来生产光导纤维 D、次氯酸的强氧化性能使某些有机色素褪色,可用作棉麻的漂白剂5. 下列关于元素及其化合物的性质说法不正确的是A、浓硫酸与蔗糖反应,观察到蔗糖变黑,体现了浓硫酸的脱水性 B、硝酸见光受热易分解,一般保存在棕色试剂瓶中,放置在阴凉处 C、燃油发动机产生的、与反应能生成和 , 因此可以直接排放 D、铝制餐具不宜用来蒸煮或长时间存放酸性或者碱性食物6. 关于反应 , 下列说法正确的是A、消耗 , 转移电子 B、在此条件下,氧化性: C、既是氧化剂又是还原剂 D、氧化产物和还原产物的物质的量比为21∶87. 下列反应的离子方程式不正确的是A、通入溶液: B、硅酸钠溶液通入过量: C、硫酸氢铵溶液中滴入少量溶液: D、通入溶液中:8. 下列说法不正确的是A、少量的某些可溶性盐(如硫酸钠等)能促进蛋白质溶解· B、在酸和酶的作用下,蔗糖可水解成葡萄糖和果糖,属于还原性糖 C、DNA分子具有双螺旋结构,其中碱基通过氢键作用结合成碱基对 D、橡胶的硫化是以二硫键()将线型结构连接成网状,硫化程度过大弹性会变差9. 盐酸洛派丁胺是一种新型止泻药,适用于各种病因引起的腹泻。下列说法正确的是 A、分子的结构中左边两苯环不可能同时共平面 B、该物质分子中有4种官能团和2个手性碳 C、该物质与溶液反应,最多消耗 D、该物质与溴水反应,能与发生取代反应10. X、Y、Z、Q、T五种元素,原子序数依次增大。X原子轨道上有1个空轨道,Y原子的轨道只有一对成对电子,Z原子M层上有两个未成对电子,Q最高价氧化物对应水化物是常见的三元酸,微粒的价电子构型是。下列说法不正确的是A、第一电离能: B、X和Q各有一种单质的结构单元是正四面体 C、Y和Z形成的化合物为分子晶体 D、T与Y可形成阴离子11. 已知电极材料均为石墨材质,氧化性:。设计如图装置将转化为 , 并在甲处回收金属钴;工作时保持厌氧环境,并定时将乙室溶液转移至甲室;保持细菌所在环境稳定,借助其降解乙酸盐生成。下列说法正确的是
A、分子的结构中左边两苯环不可能同时共平面 B、该物质分子中有4种官能团和2个手性碳 C、该物质与溶液反应,最多消耗 D、该物质与溴水反应,能与发生取代反应10. X、Y、Z、Q、T五种元素,原子序数依次增大。X原子轨道上有1个空轨道,Y原子的轨道只有一对成对电子,Z原子M层上有两个未成对电子,Q最高价氧化物对应水化物是常见的三元酸,微粒的价电子构型是。下列说法不正确的是A、第一电离能: B、X和Q各有一种单质的结构单元是正四面体 C、Y和Z形成的化合物为分子晶体 D、T与Y可形成阴离子11. 已知电极材料均为石墨材质,氧化性:。设计如图装置将转化为 , 并在甲处回收金属钴;工作时保持厌氧环境,并定时将乙室溶液转移至甲室;保持细菌所在环境稳定,借助其降解乙酸盐生成。下列说法正确的是 A、装置1为原电池 B、乙池电极附近不断减小 C、细菌所在电极均发生反应: D、乙室得到的全部转移至甲室,恰好能补充甲室消耗的的物质的量12. 照相底片定影并回收定影液硫代硫酸钠和银,经历如下过程,下列说法不正确的是:A、晶体中所含的作用力只有离子键、配位键 B、与是等电子体,结构相似,相当于中O被一个S原子替换 C、该过程中与结合能力:- D、副产物的键角小于的原因:分子中S的孤电子对对成键电子对的排斥作用使键角变小13. 甘氨酸是人体必需氨基酸之一、在时,仅考虑、和三种微粒,其分布分数()与溶液关系如图。[如中的分布系数:]。下列说法不正确的是
A、装置1为原电池 B、乙池电极附近不断减小 C、细菌所在电极均发生反应: D、乙室得到的全部转移至甲室,恰好能补充甲室消耗的的物质的量12. 照相底片定影并回收定影液硫代硫酸钠和银,经历如下过程,下列说法不正确的是:A、晶体中所含的作用力只有离子键、配位键 B、与是等电子体,结构相似,相当于中O被一个S原子替换 C、该过程中与结合能力:- D、副产物的键角小于的原因:分子中S的孤电子对对成键电子对的排斥作用使键角变小13. 甘氨酸是人体必需氨基酸之一、在时,仅考虑、和三种微粒,其分布分数()与溶液关系如图。[如中的分布系数:]。下列说法不正确的是 A、曲线a代表 B、两性离子的浓度在附近最大,说明两性离子的电离能力比水解强 C、的平衡常数 D、14. 为了研究温度对苯催化加氢的影响,以检验新型镍催化剂的性能,该反应。采用相同的微型反应装置,压强为 , 氢气与苯的物质的量之比为6.5∶1。反应相同时间后取样分离出氢气后,分析成分得到的结果如下表:
A、曲线a代表 B、两性离子的浓度在附近最大,说明两性离子的电离能力比水解强 C、的平衡常数 D、14. 为了研究温度对苯催化加氢的影响,以检验新型镍催化剂的性能,该反应。采用相同的微型反应装置,压强为 , 氢气与苯的物质的量之比为6.5∶1。反应相同时间后取样分离出氢气后,分析成分得到的结果如下表:温度/
85
95
100
110~240
280
300
340
质量分数/%
苯
96.05
91.55
80.85
1
23.35
36.90
72.37
环己烷
3.95
8.45
19.15
99
76.65
63.10
27.63
下列说法不正确的是
A、该催化剂反应最佳反应温度范围是 , 因为催化剂的选择性和活性都比较高 B、以上苯的转化率下降,可能因为温度上升,平衡逆向移动 C、在范围内,适当延长反应时间可以提高苯的转化率 D、在范围内,温度上升反应速率加快,因此苯的转化率上升15. 室温下,用过量溶液浸泡粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。(当溶液中剩余的离子浓度小于时,化学上通常认为生成沉淀的反应已经完全进行了。已知: , ),下列说法正确的是A、浸泡后未完全转化为 B、溶液中存在: C、反应正向进行,需满足 D、过滤后所得清液中一定存在:且16. 下列方案设计、现象和结论都正确的是选项
实验方案
现象
结论
A
往稀硫酸溶液中滴加
出现白色沉淀
酸性:
B
将铁锈溶于浓盐酸,滴入溶液
溶液中紫色褪去
铁锈中含有二价铁
C
室温碱性条件下,在淀粉与碘水的混合溶液中滴加溶液
混合液的蓝色迅速褪去,并产生棕褐色沉淀
氧化性(碱性条件下):
D
石蜡油加强热,将产生的气体通入的溶液
溶液红棕色变无色
气体中含有不饱和烃
A、A B、B C、C D、D二、非选择题
-
17. 物质结构理论是材料科学、医学科学和生命科学的重要基础。请回答:(1)、常常作为有机反应的催化剂,画出基态原子的价层电子轨道表示式;要制备高纯可先制得 , 其中C原子的杂化方式为。(2)、乙二酸具有优良的还原性,易被氧化成。测得乙二酸中的的键长比普通的键长要长,说明理由。(3)、下列说法正确的是____。
 A、现代化学,常利用原子光谱上特征谱线鉴定元素 B、电负性大于1.8一定是非金属 C、配合物的稳定性不仅与配体有关,还与中心原子的所带电荷等因素有关。 D、晶体的密度为 , 图示晶胞与的距离(4)、锌黄锡矿外观漂亮,晶胞结构如图所示,请写出锌黄锡矿的化学式;并在晶胞中找出平移能完全重合的两个。(请选择合适的编号填写一种组合)
A、现代化学,常利用原子光谱上特征谱线鉴定元素 B、电负性大于1.8一定是非金属 C、配合物的稳定性不仅与配体有关,还与中心原子的所带电荷等因素有关。 D、晶体的密度为 , 图示晶胞与的距离(4)、锌黄锡矿外观漂亮,晶胞结构如图所示,请写出锌黄锡矿的化学式;并在晶胞中找出平移能完全重合的两个。(请选择合适的编号填写一种组合) 18. 某钾盐X由四种元素组成,某小组按如下流程进行实验。请回答:
18. 某钾盐X由四种元素组成,某小组按如下流程进行实验。请回答: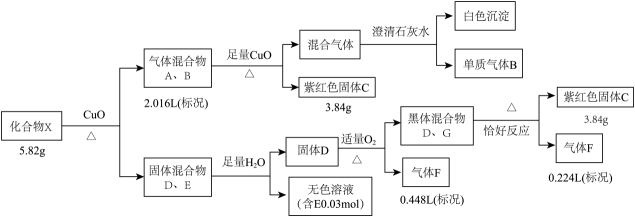
已知:相同条件下,A、B为中学常见气体且密度相同。D、E均为二元化合物,气体F能使品红溶液褪色且通入无色溶液E中,有淡黄色沉淀生成。
(1)、气体B的电子式是 , C的化学式是。(2)、写出固体混合物D、G共热所发生的化学反应方程式。(3)、无色溶液E中滴加盐酸观察到气泡。收集少量气体通入溶液,观察到黑色沉淀生成。写出生成沉淀的离子反应方程式(发生非氧化还原反应)。(4)、将G溶于氨水得到一无色溶液,设计实验检验无色溶液中主要离子。19. 二甲醚()是一种重要的化工原料,可以通过制备得到。制备方法和涉及反应如下:方法a:“二步法”制二甲醚
I:
Ⅱ:
方法b:“一步法”制二甲醚
Ⅲ:
两种方法都伴随副反应:
Ⅳ:
请回答:
(1)、反应I自发进行的条件是;。(2)、在一定温度下,向的恒容密闭容器中通入和和利用方法a制备二甲醚。测得的平衡转化率为30%,为 , 为 , 反应I的平衡常数为(用含a、b的式子表示,只需列出计算式)。(3)、恒压条件下,在密闭容器中利用方法b制备二甲醚。按照投料,的平衡转化率和、的选择性随温度变化如图1所示。
(的选择性 , 的选择性)
①下列说法正确的是
A.当反应达到平衡时,
B.曲线①表示二甲醚的选择性
C.温度越低越有利于工业生产二甲醚
D.工业上引入双功能催化剂是为了降低反应Ⅲ的
②在的范围内,的平衡转化率先降低后升高的原因:。
(4)、有学者研究反应Ⅱ机理,利用磷酸硅铝分子筛催化甲醇制二甲醚,其中简化的分子筛模型与反应过渡态结构模型如图所示,下列说法正确的是____。(已知:磷酸硅铝分子筛中有酸性位点可以将甲醇质子化,题中的分子筛用“”符号表示) A、制得的磷酸硅铝分子筛的孔径越大催化效率越高 B、该反应机理:[] C、改变分子筛组分比例适当提高其酸性,有利加快反应速率 D、温度越高,有利于水蒸气脱离分子筛,反应速率越快20. 高纯氟化镁具备优异的光学性质和抗腐蚀性被广泛应用于高端领域。某研究小组利用镁片(含及少量惰性杂质)制备高纯氟化镁流程如下,请回答:
A、制得的磷酸硅铝分子筛的孔径越大催化效率越高 B、该反应机理:[] C、改变分子筛组分比例适当提高其酸性,有利加快反应速率 D、温度越高,有利于水蒸气脱离分子筛,反应速率越快20. 高纯氟化镁具备优异的光学性质和抗腐蚀性被广泛应用于高端领域。某研究小组利用镁片(含及少量惰性杂质)制备高纯氟化镁流程如下,请回答:
已知:
①甲醇沸点:
②该实验条件得到的氟化镁并不是晶型沉淀,其颗粒细小,常常吸附水分成黏稠胶状。
(1)、利用图1装置可检测镁与甲醇反应速率。仪器A的名称。 (2)、写出氟化反应涉及的化学方程式。(3)、下列有关说法不正确的是____。A、步骤Ⅰ:反应温度不选择 , 主要由于在反应过于剧烈难以控制。 B、步骤Ⅱ:待镁片上不再有微小气泡生成时,可进行步骤Ⅱ。 C、步骤Ⅲ:制备悬浊液B,应先将通入高纯水达到饱和,再加到固体A中。 D、步骤Ⅳ:在进行氟化反应时,应做好防护措施和配备应急药品。(4)、步骤Ⅱ的一系列操作目的是为获得固体A.从下列选项中选择合理的仪器和操作,补全如下步骤[“ ”上填写一件最关键仪器 , “( )”内填写一种操作 , 均用字母表示]。
(2)、写出氟化反应涉及的化学方程式。(3)、下列有关说法不正确的是____。A、步骤Ⅰ:反应温度不选择 , 主要由于在反应过于剧烈难以控制。 B、步骤Ⅱ:待镁片上不再有微小气泡生成时,可进行步骤Ⅱ。 C、步骤Ⅲ:制备悬浊液B,应先将通入高纯水达到饱和,再加到固体A中。 D、步骤Ⅳ:在进行氟化反应时,应做好防护措施和配备应急药品。(4)、步骤Ⅱ的一系列操作目的是为获得固体A.从下列选项中选择合理的仪器和操作,补全如下步骤[“ ”上填写一件最关键仪器 , “( )”内填写一种操作 , 均用字母表示]。取仪器A中的溶液,用()→用(蒸馏减少溶剂)→用()→用漏斗(过滤得到固体A)
【仪器】a.烧杯;b.铜质保温漏斗;c.漏斗;d.空气冷凝管;e.直形冷凝管;f.球形冷凝管
【操作】g.过滤;h.趁热过滤;i.冷却结晶;j.蒸发结晶
(5)、步骤Ⅴ:产品在不同温度下干燥 , 对其进行红外光谱分析如下图,已知羟基引起的吸收峰在波数处请选择最合适的温度。(填“、、或”) 21. 某研究小组按下列路线合成抗癌药物盐酸苯达莫司汀。
21. 某研究小组按下列路线合成抗癌药物盐酸苯达莫司汀。
已知:

请回答:
(1)、化合物A的官能团名称是。(2)、化合物C的结构简式是。(3)、下列说法不正确的是____。A、D→E的反应类型为取代反应 B、化合物B与草酸互为同系物 C、化合物E的分子式是 D、化合物H中的3个N原子结合的能力各不相同(4)、写出F→G的化学方程式。(5)、设计以 为原料合成B的路线(用流程图表示,无机试剂任选)。 (6)、写出3种同时符合下列条件的化合物D的同分异构体的结构简式。
为原料合成B的路线(用流程图表示,无机试剂任选)。 (6)、写出3种同时符合下列条件的化合物D的同分异构体的结构简式。①分子中只含一个苯环和一个五元环;
②谱和谱检测表明:分子中共有3种不同化学环境的氢原子,无硝基,有羟基。