浙江省宁波市2023届高三下学期高考模拟化学试题
试卷更新日期:2023-05-25 类型:高考模拟
一、选择题
-
1. 下列物质中,能够导电的化合物是A、石墨烯 B、液态氧化钠 C、二氧化硅 D、盐酸2. 高铁酸钾()是一种环保、高效、多功能饮用水处理剂,在水处理过程中,高铁酸钾转化为胶体,下列说法不正确的是A、高铁酸钾中铁元素的化合价为+6价 B、Fe元素位于周期表ds区 C、高铁酸钾属于强电解质 D、用对饮用水处理时,能起到消毒杀菌和吸附杂质的双重作用3. 下列化学用语表示正确的是A、离子结构示意图:
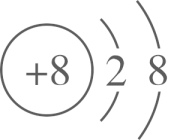 B、基态铜原子价电子的轨道表示式:
B、基态铜原子价电子的轨道表示式: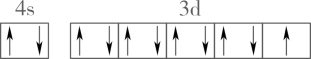 C、的空间结构:
C、的空间结构: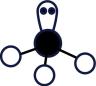 (正四面体形)
D、的电子式:
(正四面体形)
D、的电子式: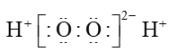 4. 物质的性质决定用途,下列两者对应关系正确的是A、的熔点高;可用氧化铝坩埚熔化NaOH固体 B、铁比铜金属性强,可用腐蚀Cu刻制印刷电路板 C、碳酸氢铵可中和酸并受热分解,可用于制作食品膨松剂 D、新制氢氧化铜有弱碱性,可用于检验尿液中的葡萄糖5. 下列关于元素及其化合物的性质说法不正确的是A、金属单质Na、Mg、Fe在一定条件下与水反应都生成和相应的碱 B、氯气通入冷的石灰乳中制得漂白粉 C、铜与浓硝酸反应可产生红棕色的 D、工业上用焦炭还原石英砂可制得粗硅和CO6. 电极材料制备的反应为 , 下列说法正确的是A、生成0.1 mol , 转移的电子数为0.1 B、还原产物为和CO C、标准状况下,生成20.16L CO时,被还原的为0.1 mol D、还原剂与氧化剂的物质的量之比为1∶67. 下列离子方程式正确的是A、碘化亚铁溶液中滴加少量稀硝酸: B、氯化铝溶液与浓氨水混合: C、银氨溶液中加入足量盐酸: D、用惰性电极电解氯化镁溶液:8. 下列说法不正确的是A、麦芽糖、蔗糖互为同分异构体,分子式均为 B、硬化油可作为制造肥皂和人造奶油的原料 C、合成硝酸纤维、醋酸纤维、聚酯纤维均要用到纤维素 D、蛋白质在乙醇、重金属的盐类、紫外线等的作用下会发生变性,失去生理活性9. 一种具有消炎止痛功效的有机物的结构简式如图所示(虚楔形线、实楔形线分别表示共价键由纸平面向内、向外伸展)。下列说法正确的是
4. 物质的性质决定用途,下列两者对应关系正确的是A、的熔点高;可用氧化铝坩埚熔化NaOH固体 B、铁比铜金属性强,可用腐蚀Cu刻制印刷电路板 C、碳酸氢铵可中和酸并受热分解,可用于制作食品膨松剂 D、新制氢氧化铜有弱碱性,可用于检验尿液中的葡萄糖5. 下列关于元素及其化合物的性质说法不正确的是A、金属单质Na、Mg、Fe在一定条件下与水反应都生成和相应的碱 B、氯气通入冷的石灰乳中制得漂白粉 C、铜与浓硝酸反应可产生红棕色的 D、工业上用焦炭还原石英砂可制得粗硅和CO6. 电极材料制备的反应为 , 下列说法正确的是A、生成0.1 mol , 转移的电子数为0.1 B、还原产物为和CO C、标准状况下,生成20.16L CO时,被还原的为0.1 mol D、还原剂与氧化剂的物质的量之比为1∶67. 下列离子方程式正确的是A、碘化亚铁溶液中滴加少量稀硝酸: B、氯化铝溶液与浓氨水混合: C、银氨溶液中加入足量盐酸: D、用惰性电极电解氯化镁溶液:8. 下列说法不正确的是A、麦芽糖、蔗糖互为同分异构体,分子式均为 B、硬化油可作为制造肥皂和人造奶油的原料 C、合成硝酸纤维、醋酸纤维、聚酯纤维均要用到纤维素 D、蛋白质在乙醇、重金属的盐类、紫外线等的作用下会发生变性,失去生理活性9. 一种具有消炎止痛功效的有机物的结构简式如图所示(虚楔形线、实楔形线分别表示共价键由纸平面向内、向外伸展)。下列说法正确的是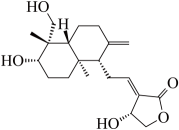 A、该物质可以发生消去反应、取代反应和还原反应 B、1 mol该物质与足量溴的四氯化碳溶液反应,最多可消耗3 mol C、利用质谱仪可测得该分子中官能团的种类有3种 D、该物质的同分异构体中不存在含有酯基、醛基的芳香族化合物10. R、X、Y、Z、M五种短周期主族元素,原子序数依次增大。基态R原子每个能级上电子数相等,基态X原子的价层电子排布为 , Y与M同主族,Z是同周期元素中原子半径最大的元素,Z核电荷数等于X、M原子的最外层电子数之和。下列说法不正确的是A、电负性:Y>X>R B、原子半径:Z>M>Y C、氢化物的沸点:R<Y D、Z与Y可形成两种常见的离子化合物,且晶体中的阴阳离子个数比均为1∶211. 一种用于发动机SCR系统的电解尿素()混合装置(X、Y为石墨电极,隔膜仅阻止气体通过)如图,下列说法不正确的是
A、该物质可以发生消去反应、取代反应和还原反应 B、1 mol该物质与足量溴的四氯化碳溶液反应,最多可消耗3 mol C、利用质谱仪可测得该分子中官能团的种类有3种 D、该物质的同分异构体中不存在含有酯基、醛基的芳香族化合物10. R、X、Y、Z、M五种短周期主族元素,原子序数依次增大。基态R原子每个能级上电子数相等,基态X原子的价层电子排布为 , Y与M同主族,Z是同周期元素中原子半径最大的元素,Z核电荷数等于X、M原子的最外层电子数之和。下列说法不正确的是A、电负性:Y>X>R B、原子半径:Z>M>Y C、氢化物的沸点:R<Y D、Z与Y可形成两种常见的离子化合物,且晶体中的阴阳离子个数比均为1∶211. 一种用于发动机SCR系统的电解尿素()混合装置(X、Y为石墨电极,隔膜仅阻止气体通过)如图,下列说法不正确的是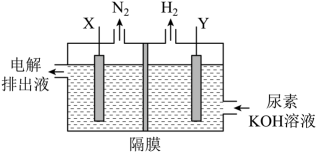 A、装置工作时,电子由Y极流入,X极流出 B、Y极发生还原反应 C、X极的电极反应式为 D、若用铅酸蓄电池为电源,理论上消耗49 g 时,此装置中有0.5mol 生成12. 是一种重要的化工产品,实验室可利用制取该配合物:。已知的空间结构如图,其中1~6处的小圆圈表示分子,各相邻的分子间的距离相等,中心离子位于八面体的中心,分子到中心离子的距离相等(图中虚线长度相等),下列说法正确的是
A、装置工作时,电子由Y极流入,X极流出 B、Y极发生还原反应 C、X极的电极反应式为 D、若用铅酸蓄电池为电源,理论上消耗49 g 时,此装置中有0.5mol 生成12. 是一种重要的化工产品,实验室可利用制取该配合物:。已知的空间结构如图,其中1~6处的小圆圈表示分子,各相邻的分子间的距离相等,中心离子位于八面体的中心,分子到中心离子的距离相等(图中虚线长度相等),下列说法正确的是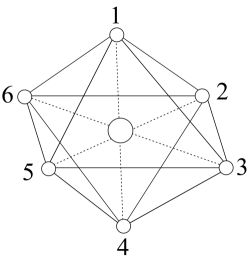 A、为非极性分子 B、、与形成配离子的稳定性: C、1 mol 含有键的数目为18 D、若中两个被替代,得到的有2种结构13. 常温下, , , , 下列说法不正确的是A、浓度均为0.1 mol/L的HCOONa和溶液中阳离子的物质的量浓度之和:前者>后者 B、用相同浓度的NaOH溶液分别滴定等体积、pH均为3的HCOOH和溶液至终点,消耗NaOH溶液的体积:前者<后者 C、0.2mol/L 与0.1 mol/L盐酸等体积混合后,溶液中微粒浓度: D、0.2mol/L HCOONa溶液与0.1mol/L NaOH溶液等体积混合后的溶液中:14. 一定条件下,与HCl发生加成反应有①、②两种可能,反应进程中能量变化如图所示。下列说法中不正确的是
A、为非极性分子 B、、与形成配离子的稳定性: C、1 mol 含有键的数目为18 D、若中两个被替代,得到的有2种结构13. 常温下, , , , 下列说法不正确的是A、浓度均为0.1 mol/L的HCOONa和溶液中阳离子的物质的量浓度之和:前者>后者 B、用相同浓度的NaOH溶液分别滴定等体积、pH均为3的HCOOH和溶液至终点,消耗NaOH溶液的体积:前者<后者 C、0.2mol/L 与0.1 mol/L盐酸等体积混合后,溶液中微粒浓度: D、0.2mol/L HCOONa溶液与0.1mol/L NaOH溶液等体积混合后的溶液中:14. 一定条件下,与HCl发生加成反应有①、②两种可能,反应进程中能量变化如图所示。下列说法中不正确的是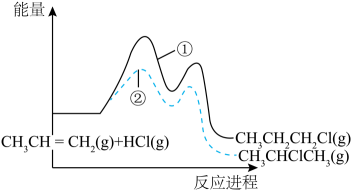 A、反应①、②焓变不同,与产物稳定性有关,与反应的中间状态无关 B、反应①、②均经过两步反应完成,对应的分步反应过程中均放出能量 C、其他条件不变,适当提高反应温度,可以提高产物中的比例 D、相同条件下,的生成速率大于15. 向工业废水中加入硫化物可以获得CuS、FeS纳米粒子[已知 , ],下列说法正确的是A、FeS固体不能用于去除工业废水中的 B、向和混合溶液中加入溶液,当两种沉淀共存时, C、向CuS饱和溶液中加入固体,CuS的溶解平衡逆向移动,滤液中一定存在 D、已知溶液中 , 可判断CuS易溶于稀盐酸16. 下列实验方案设计、现象和结论都正确的是
A、反应①、②焓变不同,与产物稳定性有关,与反应的中间状态无关 B、反应①、②均经过两步反应完成,对应的分步反应过程中均放出能量 C、其他条件不变,适当提高反应温度,可以提高产物中的比例 D、相同条件下,的生成速率大于15. 向工业废水中加入硫化物可以获得CuS、FeS纳米粒子[已知 , ],下列说法正确的是A、FeS固体不能用于去除工业废水中的 B、向和混合溶液中加入溶液,当两种沉淀共存时, C、向CuS饱和溶液中加入固体,CuS的溶解平衡逆向移动,滤液中一定存在 D、已知溶液中 , 可判断CuS易溶于稀盐酸16. 下列实验方案设计、现象和结论都正确的是选项
实验方案
现象
结论
A
室温下,向苯酚浊液中加入碳酸钠溶液
溶液变澄清
酸性:
B
向做过银镜反应的试管中加入足量氨水
银镜逐渐消失
银能与氨形成溶于水的配离子
C
与NaOH乙醇溶液混合共热,将产生的气体通入酸性溶液中
酸性溶液褪色
发生消去反应
D
向某溶液中加入稀硫酸
产生淡黄色沉淀,同时生成能使品红溶液褪色的无色气体
该溶液中含有
A、A B、B C、C D、D二、非选择题
-
17. 卤素单质及其化合物在科研和工农业生产中有着广泛的应用。请回答:(1)、和中心原子的杂化方式分别为和。第一电离能介于B、N之间的第二周期元素有种。(2)、卤化物受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为(写化学式)。解释X的熔点比Y高的原因。(3)、一种铜的溴化物立方晶胞如图所示。

该化合物的化学式为 , 在晶体中与Cu距离最近且相等的Cu有个,若该晶体密度为 , 化合物式量为M,则该晶体中Cu原子与Br原子的最小核间距为pm(写出表达式,阿伏加德罗常数为)。
18. 无机盐X由五种元素组成,某学习小组按如下流程进行实验: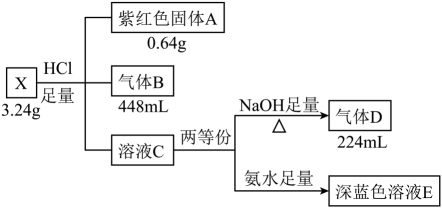
已知:上述气体体积均在标准状况下测得。气体B为纯净物,有刺激性气味,标准状况下密度为2.86 g/L。请回答:
(1)、X的组成元素是 , X的化学式是。(2)、写出C→D转化过程的离子方程式。(3)、深蓝色溶液E与气体B反应可生成X沉淀,写出该反应的离子方程式。(4)、若盐X与足量盐酸的反应改在密闭容器中进行,得到固体A、气体B和溶液M(M中不合固体A的组成元素)。设计实验检验溶液M中的。19. 锰及其化合物在催化剂及金属材料方面有重要的应用。我国主要以菱锰矿(主要成分为 , M为Mn、Mg或Ca)为原料,通过热解法生产二氧化锰等锰基催化剂。(1)、提取的转化关系如下:
已知 , 关系如下图。

①“焙烧”过程最大的是。
A. B. C.
②“焙烧”温度应控制在。
(2)、T℃时,碳酸锰热解制二氧化锰的热化学方程式:①若该反应的速率方程表示为:和[和分别为正、逆反应速率常数,在一定温度下为常数],该反应的平衡常数(用、表示)。
②焙烧时在入口持续通入空气,并不断用真空抽气泵在装置尾端抽气的目的是。
(3)、由原料气(、)与煤粉在锰基催化剂条件下制乙炔,该生产过程是目前清洁高效的煤化工过程。已知:发生的部分反应如下(在25℃、101 kPa时),、在高温条件还会分解生成碳与氢气:Ⅰ.
Ⅱ.
Ⅲ.
上述反应在体积为1L的密闭容器中进行,达到平衡时各气体体积分数和反应温度的关系曲线如图甲所示。

①下列说法正确的是。
A.1530 K之前乙炔产率随温度升高而增大的原因:升温使反应Ⅱ、Ⅲ平衡正向移动
B.1530 K之后会有更多的甲烷与乙烯裂解生成碳导致乙炔产率增加不大
C.1530 K时测得气体的总物质的量为1.000 mol,则反应III的平衡常数为0.8652
D.相同条件下,改用更高效的催化剂,可使单位时间内的乙炔产率增大
②请在图乙中绘制平衡时乙烯的体积分数和反应温度的变化趋势,并标明1530 K时的气体体积分数。
 20. 乳酸亚铁{ , }是一种常见的食品铁强化剂,溶于水,难溶于乙醇。某研究小组以矿渣X(主要成分是 , 含少量、杂质)制备乳酸亚铁并进行产品含量测定,制备流程如下(部分环节已略去):
20. 乳酸亚铁{ , }是一种常见的食品铁强化剂,溶于水,难溶于乙醇。某研究小组以矿渣X(主要成分是 , 含少量、杂质)制备乳酸亚铁并进行产品含量测定,制备流程如下(部分环节已略去):
已知:①一定浓度的金属离子生成相应的氢氧化物沉淀的pH如下表所示,
金属氢氧化物
开始沉淀时的pH
完全沉淀时的pH
7.6
9.6
2.2
3.4
4.1
5.4
②
(无色配离子)
请回答:
(1)、步骤Ⅳ,转化时使用如图装置,仪器A的名称是。 (2)、下列有关说法不正确的是____。A、步骤Ⅱ,加入氨水调节pH后,组分A中主要含铁成分为、 B、步骤Ⅲ,固体B为铁 C、固体C为和Fe D、重结晶后可选择乙醇洗涤晶体 E、为得到干燥的乳酸亚铁晶体,采用高温烘干的方式(3)、实验室常用已知浓度的重铬酸钾标准溶液滴定。
(2)、下列有关说法不正确的是____。A、步骤Ⅱ,加入氨水调节pH后,组分A中主要含铁成分为、 B、步骤Ⅲ,固体B为铁 C、固体C为和Fe D、重结晶后可选择乙醇洗涤晶体 E、为得到干燥的乳酸亚铁晶体,采用高温烘干的方式(3)、实验室常用已知浓度的重铬酸钾标准溶液滴定。①从下列选项中选择合理的仪器和操作,补全如下步骤[“ ”上填写一件最关键仪器,“( )”内填写一种操作,均用字母表示]
蒸馏水洗涤→润洗→( )→装液→( )→( )→用(量取一定体积的)→加指示剂,准备开始滴定。
仪器:a.烧杯;b.酸式滴定管;c.碱式滴定管;d.锥形瓶
操作:e.调整液面至“0”或“0”刻度以下,记录读数
f.橡皮管向上弯曲,挤压玻璃球,放液
g.打开活塞快速放液
h.控制活塞,将洗涤液从滴定管下部放出
i.将洗涤液从滴定管上口倒出
②滴定曲线如下图所示(曲线a未加磷酸,曲线b加磷酸)。滴定操作中向溶液中加入磷酸溶液的原因是:溶液酸化抑制水解、(写出两个理由)。
 (4)、研究小组为了测定乳酸亚铁产品中的含量,称取5.600 g乳酸亚铁产品溶于蒸馏水,定容至250 mL,进行如下实验。
(4)、研究小组为了测定乳酸亚铁产品中的含量,称取5.600 g乳酸亚铁产品溶于蒸馏水,定容至250 mL,进行如下实验。【实验一】铈量法测定含量。
取25.00 mL试液,用0.1000 mol/L的标准溶液滴定至终点。滴定反应为: , 4次滴定消耗溶液的体积如下,
实验次数
1
2
3
4
消耗溶液的体积/mL
18.75
20.05
18.70
18.65
①则该产品中含量为%(保留四位有效数字)。
【实验二】高锰酸钾法测定含量。
取25.00 mL试液,加入适量硫酸,用0.0200 mol/L的高锰酸钾标准溶液滴定至终点。4次滴定测得的含量如下,
实验次数
1
2
3
4
含量(%)
19.61
20.17
21.26
19.46
②比较实验一、二测得的产品中含量,认为铈量法适合于乳酸亚铁中含量的测定,原因是。
21. Olicendin是一种新型镇痛药物,合成路线如下: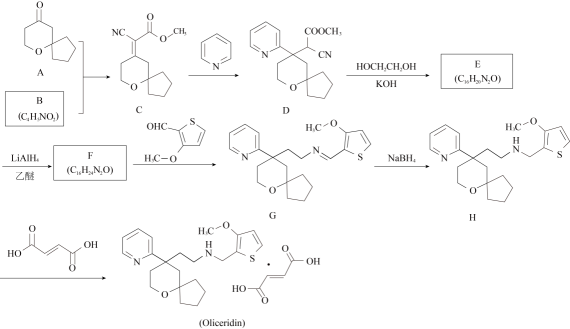
已知:①( , , )
②

③R−CHO+R′−NH2→R−CH=N−R′R−CH2NH−R′
请回答:
(1)、化合物A的官能团名称是。(2)、化合物B的结构简式。(3)、下列说法正确的是____。A、C→D的反应类型为加成反应 B、化合物E中存在1个手性碳原子 C、化合物G的分子式为 D、化合物H有碱性,易溶于水(4)、写出F→G的化学方程式。(5)、设计以乙炔为原料,合成HOOCCH=CHCOOH的路线(用流程图表示,无机试剂任选)。(6)、写出3种同时符合下列条件的化合物A的同分异构体的结构简式。①分子中含有两个环;②谱和IR谱检测表明:分子中共有3种不同化学环境的氢原子,无−O−O−键。