云南省2023届高三下学期第二次统一检测理科综合化学试题
试卷更新日期:2023-05-25 类型:高考模拟
一、单选题
-
1. 我国历史悠久,文化灿烂,拥有众多的非遗技艺传承。下列说法正确的是A、斑铜制作技艺在铜中掺杂金、银等金属,斑铜的熔点比纯铜低 B、蒸馏酒传统酿造技艺利用酒和水的密度不同,蒸馏提高酒精度 C、传统棉纺织、蚕丝制造技艺中的棉、丝主要成分相同 D、木版年画制作技艺使用的靛蓝、赭石等颜料均属于有机化合物2. 有机化合物丙具有镇痉、抗肿瘤等生物活性,其部分合成路线如下。下列说法正确的是
 A、甲的核磁共振氢谱共有10组吸收峰 B、乙和丙相比,乙的沸点更高,水溶性更好 C、1mol 丙最多可以和1mol NaOH反应 D、可用酸性高锰酸钾溶液验证甲中含有碳碳双键3. 下列反应的离子方程式表达错误的是A、向AgI沉淀中加入0.1mol·L-1Na2S溶液2AgI(s)+ S2- (aq) = Ag2S(s)+2I-(aq) B、向NaAlO2溶液中通入过量CO2 + CO2 + 2H2O= Al(OH)3↓+ C、乙酰胺与氢氧化钠溶液共热CH3CONH2 +OH- CH3COO- + NH3↑ D、向CuSO4溶液中加入浓盐酸,溶液变为绿色Cu2++2Cl-=Cu+Cl2↑4. X、Y、Z、W是原子序数依次增大的前四周期元素,X元素的简单氢化物能与其最高价氧化物对应水化物反应生成盐; Y元素原子的核外电子只有8种运动状态;Z为短周期金属元素,其简单离子的半径在同周期中最小;基态W原子的未成对电子数为6。下列说法错误的是A、第一电离能: X>Y> Z B、键角> C、W为第四周期d区元素 D、X和Y的最简单气态氢化物中,前者更易液化5. 下列实验设计能达到实验目的的是
A、甲的核磁共振氢谱共有10组吸收峰 B、乙和丙相比,乙的沸点更高,水溶性更好 C、1mol 丙最多可以和1mol NaOH反应 D、可用酸性高锰酸钾溶液验证甲中含有碳碳双键3. 下列反应的离子方程式表达错误的是A、向AgI沉淀中加入0.1mol·L-1Na2S溶液2AgI(s)+ S2- (aq) = Ag2S(s)+2I-(aq) B、向NaAlO2溶液中通入过量CO2 + CO2 + 2H2O= Al(OH)3↓+ C、乙酰胺与氢氧化钠溶液共热CH3CONH2 +OH- CH3COO- + NH3↑ D、向CuSO4溶液中加入浓盐酸,溶液变为绿色Cu2++2Cl-=Cu+Cl2↑4. X、Y、Z、W是原子序数依次增大的前四周期元素,X元素的简单氢化物能与其最高价氧化物对应水化物反应生成盐; Y元素原子的核外电子只有8种运动状态;Z为短周期金属元素,其简单离子的半径在同周期中最小;基态W原子的未成对电子数为6。下列说法错误的是A、第一电离能: X>Y> Z B、键角> C、W为第四周期d区元素 D、X和Y的最简单气态氢化物中,前者更易液化5. 下列实验设计能达到实验目的的是选项
实验目的
实验设计
A
提高KMnO4溶液的氧化性
用草酸酸化KMnO4溶液
B
除去乙醇中混有的乙酸
向混合物中滴加适量的Na2CO3溶液,静置分液
C
检验碳酸钠中是否混有亚硫酸钠
向样品中加入过量稀盐酸,将产生的气体通入Ba(NO3)2溶液中,观察是否出现白色沉淀
D
验证浓硝酸在加热条件下可以氧化碳单质
将木炭和浓硝酸混合后加热,观察是否出现红棕色气体
A、A B、B C、C D、D6. NA为阿伏加德罗常数的值。下列说法正确的是A、22.4L 光气(COCl2) 所含分子数为NA B、0.1 mol Cu(H2O)4SO4·H2O晶体中σ键数目为1.8 NA C、电解1L饱和食盐水,pH=13时, 转移的电子数为0.05 NA D、2mL5mol·L-1的硅酸钠溶液和盐酸反应后制得硅酸胶体,胶粒数为0.01NA7. 一种成本低、稳定性好的全碱性多硫化物---空气液流二次电池工作时,原理如图所示。下列说法正确的是 A、连接负载时,电极A为正极 B、连接负载时,阳极区的电极反应式为2 - 2e- = C、连接电源时,电路中每通过2 NA个电子,生成NaOH的质量为80 g D、膜a为阴离子交换膜,膜b为阳离子交换膜
A、连接负载时,电极A为正极 B、连接负载时,阳极区的电极反应式为2 - 2e- = C、连接电源时,电路中每通过2 NA个电子,生成NaOH的质量为80 g D、膜a为阴离子交换膜,膜b为阳离子交换膜二、非选择题
-
8. GaAs是一种重要的半导体材料。一种以粉煤灰(主要成分为SiO2 , 含少量Fe2O3、Al2O3、Ga2O3等)为原料制备GaAs的工艺流程如下:

已知: Ksp[Ga(OH)3] ≈1.0×10-35 , Ksp [Al(OH)3] ≈1.0×10-33 , Ksp [Fe(OH)3] ≈2.8× 10-39
回答下列问题:
(1)、基态Ga原子的价层电子排布式为。(2)、焙烧工序中Ga2O3与(NH4)2SO4反应的化学方程式为 。(3)、母液中主要成分经分离、提纯后,可返回 工序循环利用。(4)、若浸取液中金属阳离子的浓度几乎相同,则分步沉淀中最先沉淀的离子为。(5)、碱浸时发生反应Ga(OH)3+ OH- [Ga(OH)4]- K=0.1, 已知Kb(NH3·H2O)=1.75×10-5 , 计算说明分步沉淀时Ga(OH)3难溶于氨水的原因。(6)、电解生成Ga的电极反应式为。(7)、GaAs的晶胞结构如图,晶体中每个As原子周围等距且最近的Ga原子数目为 , 已知: GaAs的摩尔质量为Mg·mol-1 , 密度为ρg·cm-3 , 阿伏加德罗常数值为NA , 则GaAs晶胞的边长为pm。 9. 硫酸羟胺[(NH3OH)2SO4]为无色晶体,易溶于水,是一种重要的化工原料,在农药、医药行业中有广泛用途。合成硫酸羟胺的流程如下:
9. 硫酸羟胺[(NH3OH)2SO4]为无色晶体,易溶于水,是一种重要的化工原料,在农药、医药行业中有广泛用途。合成硫酸羟胺的流程如下:
模拟上述流程的实验装置如下(夹持装置与加热装置省略):
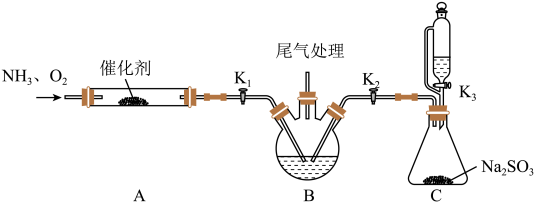
已知:羟胺(NH2OH)为白色片状晶体,易溶于水、甲醇等,受热易分解。
回答下列问题:
(1)、三颈烧瓶中的试剂是 , 装置C中反应的化学方程式为。(2)、开始实验时,应最先打开(填“K1”“K2”或“K3”)。(3)、流程中步骤I的化学方程式是。(4)、为分离(NH3OH)2SO4和(NH4)2SO4 , 向二者混合溶液中加入氨水,生成NH2OH·H2O,说明碱性较强的是(填“NH2OH·H2O”或“NH3·H2O”);再加入甲醇,析出(填化学式)晶体,过滤,滤液经(填“常压”或“减压”)蒸馏后,加入硫酸,得到硫酸羟胺产品。(5)、测定硫酸羟胺的含量:称取一定量样品,溶于水中,移入250mL的三颈烧瓶中,加入足量硫酸铁溶液,充分反应后,煮沸10min,N2O气体全部逸出。将所得溶液冷却后,用cmol·L-1酸性高锰酸钾溶液滴定。则硫酸羟胺物质的量(n)与消耗高锰酸钾溶液的体积(VmL)的关系是n=mol。10. CO2与氢气在固载金属催化剂上可发生以下反应:反应i. CO2(g)+H2(g) HCOOH(g) ΔH1
反应ii. CO2(g)+H2(g) H2O(g)+CO(g) ΔH2>0
反应iii.……
可能的反应机理如下(M为催化剂);
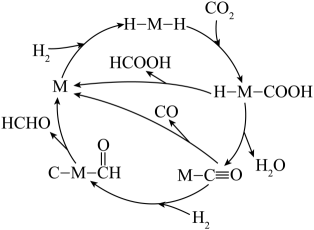
回答下列问题:
(1)、反应iii的化学方程式为。(2)、已知下列几种物质的标准摩尔生成焓(在101kPa时,由最稳定单质合成1mol指定产物时所放出的热量):物质
CO2(g)
H2(g)
HCOOH(g)
标准摩尔生成焓/kJ·mol-1
-393.51
0
-362.3
依据以上信息,ΔH1=。
(3)、在一定压强下,按n(H2):n(CO2)=1:1 投料,发生反应i和反应ii (忽略反应iii), 反应相同时间,CO2的转化率及HCOOH选择性(甲酸选择性=随温度变化曲线如下图所示。
①下列措施能提高CO2平衡转化率的是 ( 填标号)。
A.降低温度 B.再充入Ar C.分离出HCOOH
②673.15K,反应后体系中H2的分压为a MPa,则反应i的压力商计算式Qp= MPa-1。
③当温度高于673.15K,随温度升高,反应i与反应ii的反应速率相比,增加更显著的是反应 (填“ i”或“ii”),判断的理由是。
(4)、若在Bi或Bi/CeO2催化剂表面还原CO2生成HCOOH, 模拟经历两种中间体的能量变化如图所示。HCOOH的合成更倾向于通过生成中间体,且 (填 “Bi”或“Bi/CeO2”)的催化活性更优异。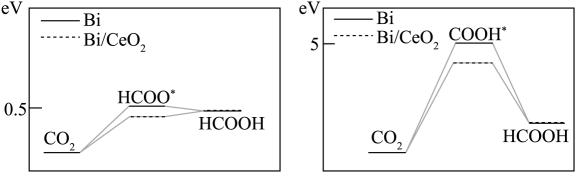 11. 多环化合物是合成很多药物的中间体,下面是一 种多环化合物G的合成路线:
11. 多环化合物是合成很多药物的中间体,下面是一 种多环化合物G的合成路线: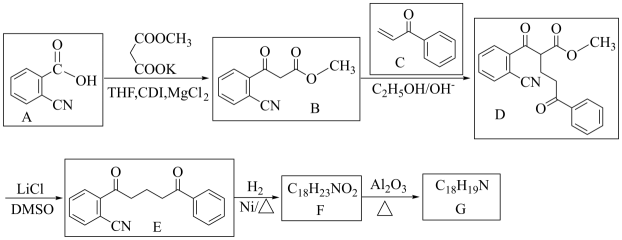
已知:
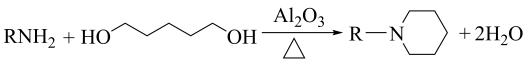
回答下列问题:
(1)、A的化学名称为 , 由B生成D的反应类型为。(2)、下列说法正确的是 ( 填标号)。a. A侧链上的碳原子的杂化类型有sp和sp2
b.B所含元素电负性最大的为O
c.C分子中所有原子一定共面
d.D分子中手性碳原子数目为2
(3)、E中含氧官能团的名称为 , E →F反应的方程式为。(4)、C的同分异构体中,同时满足以下两个条件的有种 ( 考虑立体异构)。i.除苯环外不含其他的环状结构;
ii. 能发生银镜反应;
(5)、写出G的结构简式 。(6)、结合题中相关信息,设计以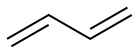 和为原料制备
和为原料制备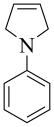 的合成路线(其他无机试剂任选)。
的合成路线(其他无机试剂任选)。