上海市松江区2023届高三二模测试化学试题
试卷更新日期:2023-05-25 类型:高考模拟
一、单选题
-
1. 2023年2月,我国海关在对进境邮件进行查验时,查获违法红珊瑚制品。珊瑚显红色,源于在海底长期积淀某种元素的氧化物,该元素是( )A、C B、Si C、Fe D、Na2. “碳中和”是指CO2的排放总量和减少总量相当。下列措施中能促进“碳中和”最直接有效的是 ( )A、研发催化剂将CO2还原为甲醇 B、大规模开采可燃冰作为新能源 C、安装脱硫设备减少煤燃烧污染 D、将重质油裂解为轻质油作为燃料3. 春季是流感、诺如病毒等疾病的高发期,需要对重点场所做好定期清洁消毒。下列物质中,不是消毒剂的是 ( )A、漂粉精 B、洁厕灵 C、碘酒 D、臭氧4. 下列物质中,分子的空间结构为直线型的是 ( )A、乙烯 B、甲烷 C、氨 D、二氧化碳5. 科学家们创造出了最轻的镁同位素18Mg,18Mg与24Mg具有 ( )A、不同电子数 B、不同物理性质 C、不同核电荷数 D、不同化学性质6. 在FeSO4、CuSO4、Al2(SO4)3的混合溶液中通入适量H2S,产生的沉淀物是 ( )A、Al(OH)3 B、Al2S3 C、CuS D、FeS7. 在合成氨和接触法制硫酸的工业生产中,下列说法错误的是 ( )A、均采用高压条件 B、均选择较高温度 C、均进行循环操作 D、均使用合适催化剂8. 一定条件下,存在“一种物质过量,另一种物质仍不能完全反应”情况的是 ( )A、一氧化氮与过量氧气 B、氯化铝溶液与过量稀氨水 C、铁片与过量浓硝酸 D、澄清石灰水与过量二氧化碳9. 海水提溴与海带提碘,共同点是 ( )A、浓缩方法 B、采用热空气吹出 C、四氯化碳萃取 D、氧化剂可选择氯水10. 下列各组物质的转化关系不能全部通过一步反应完成的是 ( )A、Na→NaOH→Na2CO3→NaCl B、Fe→FeCl3→Fe(OH)3→Fe2O3 C、Al→Al2O3→Al(OH)3→AlCl3 D、Mg→MgCl2→Mg(OH)2→MgSO411. 下列各组溶液中的反应,无论反应物量的多少,都只能用同一个离子方程式来表示的是 ( )A、FeBr2与Cl2 B、Ca(HCO3)2与Ca(OH)2 C、HCl与Na2CO3 D、Ba(OH)2与NaHSO412. 侯氏制碱法制造纯碱同时副产氯化铵。在母液处理上,有关说法错误的是( )
A、水浴加热,有利于NH4Cl更多地析出 B、加入食盐,增大Cl-的浓度,使NH4Cl更多地析出 C、通入氨气,增大NH4+的浓度,使NH4Cl更多地析出 D、通入氨气,使NaHCO3转化为Na2CO3 , 提高析出的NH4Cl纯度13. 下列装置用于实验室中制取干燥氨气的实验,其中能达到实验目的的是( )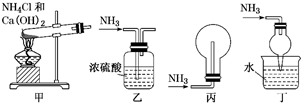 A、用装置甲制备氨气 B、用装置乙除去氨气中的少量水 C、用装置丙收集氨气 D、用装置丁吸收多余的氨气14. 断肠草中分离出来的2种毒素的结构简式如下,有关推断正确的是 ( )
A、用装置甲制备氨气 B、用装置乙除去氨气中的少量水 C、用装置丙收集氨气 D、用装置丁吸收多余的氨气14. 断肠草中分离出来的2种毒素的结构简式如下,有关推断正确的是 ( )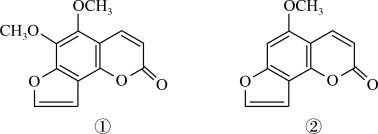 A、互为同系物 B、均能与氢氧化钠溶液反应 C、互为同分异构体 D、1mol均能与6molH2加成15. 可降解塑料PCL的合成路线如下:
A、互为同系物 B、均能与氢氧化钠溶液反应 C、互为同分异构体 D、1mol均能与6molH2加成15. 可降解塑料PCL的合成路线如下: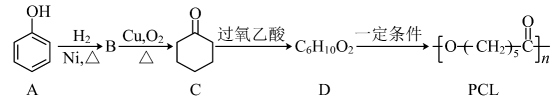
下列说法错误的是 ( )
A、B的分子式为C6H12O B、C→D发生的是氧化反应 C、D→PCL发生的是缩聚反应 D、D与PCL的水解产物相同16. 有一澄清透明的溶液,可能含有大量的、、、、、 、中的几种,向该溶液中滴入 溶液一定体积后才产生沉淀。下列判断正确的是 ( )A、溶液中可能含有 B、溶液中一定不含 C、溶液中可能含有 D、溶液中一定不含17. 将表面发黑(黑色物质为Ag2S)的银器浸入盛有食盐水的铝制容器中(如图),一段时间后黑色褪去。有关说法正确的是 ( )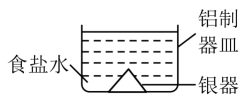 A、该处理过程中电能转化为化学能 B、铝质容器为阳极,其质量变轻 C、Ag2S溶解于食盐水生成了AgCl D、银器为正极,Ag2S被还原为单质银18. 下列化学反应,相应的离子方程式一定正确的是 ( )A、向溶液中加入少量溶液: B、溶液与一定量氯气反应,转移电子数为6.02×1023时: C、将2.24L(标准状况)CO2通入500mL 0.3 mol·L-1溶液中: D、向溶液通入少量SO2:19. 工业上以铜阳极泥(主要成分是)为原料提取碲(第五周期VIA族),涉及反应:
A、该处理过程中电能转化为化学能 B、铝质容器为阳极,其质量变轻 C、Ag2S溶解于食盐水生成了AgCl D、银器为正极,Ag2S被还原为单质银18. 下列化学反应,相应的离子方程式一定正确的是 ( )A、向溶液中加入少量溶液: B、溶液与一定量氯气反应,转移电子数为6.02×1023时: C、将2.24L(标准状况)CO2通入500mL 0.3 mol·L-1溶液中: D、向溶液通入少量SO2:19. 工业上以铜阳极泥(主要成分是)为原料提取碲(第五周期VIA族),涉及反应:① ②
以下说法正确的是 ( )
A、中元素的化合价是价 B、氧化性强弱顺序为: C、反应②中氧化剂是SO2 , 氧化产物是H2SO4 D、每制备理论上共转移12mol电子20. 常温下,向1LpH=10的NaOH溶液中持续通入CO2 , 通入的CO2体积(V)与溶液中水电离出的OH-离子浓度的关系如图所示。下列叙述不正确的是( )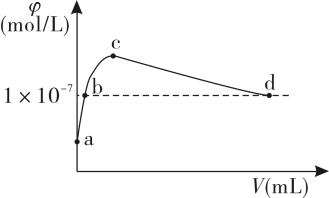 A、a点溶液中:水电离出的c(H+)=1×10-10mol·L-1 B、b点溶液中:c(H+)=1×10-7mol·L-1 C、c点溶液中:c(Na+)>c(CO32-)>c(HCO3-) D、d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-)
A、a点溶液中:水电离出的c(H+)=1×10-10mol·L-1 B、b点溶液中:c(H+)=1×10-7mol·L-1 C、c点溶液中:c(Na+)>c(CO32-)>c(HCO3-) D、d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-)二、非选择题
-
21. H2O2 (过氧化氢) 应用领域非常广泛。
已知:2H2O2(l) 2H2O(l)+O2(g)+Q(Q>0)
H2O2(aq) H+(aq)+HO(aq) ,K(25oC)=2.24×10-12
完成下列填空:
(1)、氧原子最外层成对电子和未成对电子数目之比为。(2)、H2O2的电子式为。对H2O2分子结构,有以下两种推测:
要确定H2O2分子结构,需要测定H2O2分子中的。(选填序号)
a. H—O键长 b. O—O键长 c. H—O—O键角 d. H—O、O—O键能
(3)、H2O2分解反应的平衡常数表达式K=。不同温度下H2O2分解反应的平衡常数K(25oC)K(40oC) (选填“>”“<”或“=”)。标准状况下,某5mL H2O2溶液60s内产生氧气22.4mL(溶液体积变化忽略不计)。则0~60s v(H2O2)= 。(4)、25oC,pH(H2O2) pH(H2O) (选填“>”“<”或“=”)。研究表明,H2O2溶液中HO浓度越大,H2O2的分解速率越快。某温度下,经过相同时间,不同浓度H2O2分解率与pH的关系如图所示。一定浓度的H2O2 , pH增大H2O2分解率增大的原因是。相同pH下,H2O2浓度越大H2O2分解率越低的原因是。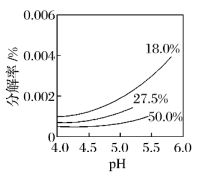 (5)、蒽醌法是过氧化氢主要的生产方法。其生产过程可简单表示如下:
(5)、蒽醌法是过氧化氢主要的生产方法。其生产过程可简单表示如下:
试从绿色化学角度评价该生产方法。
22. 砷与氮为同主族元素,砷及其化合物可应用于农药、除草剂、杀虫剂等。完成下列填空:(1)、法庭医学常用马氏试砷法来证明是否砒霜(As2O3)中毒:把试样与锌和盐酸混合,若试样中含有砒霜,则会反应生成砷化氢、氯化锌与水,写出该反应的化学方程式。(2)、As2S3和SnCl2在盐酸中反应转化为As4S4(其中As为+2价)和SnCl4并放出H2S气体,该反应中氧化产物与还原产物的物质的量之比为。(3)、一定条件下,雄黄(As4S4)与O2生成As2O3与物质a。若该反应中1molAs4S4参加反应时,转移28 mol电子。写出物质a的化学式。(4)、三元弱酸亚砷酸()溶液中各种微粒的物质的量分数与pH的关系如图所示。
向亚砷酸溶液中缓缓加入NaOH溶液至pH=11时,反应的离子方程式为。Na2HAsO3溶液中c(H2AsO)c(AsO) (填“>” “<”或“=”)。理由是。
(5)、已知I2 + AsO+2OH-2I-+AsO+H2O。为验证该反应具有可逆性,将等物质的量浓度的碘水与Na3AsO3溶液按体积比为V1:V2的比例混合(另加入适量的碱)。当V1V2 (填“>”或“<”) 时,只需加入 (填试剂名称)就可以确定该反应具有可逆性。上述反应显示:AsO能在碱性溶液中被I2氧化成AsO , 而H3AsO4又能在酸性溶液中被I-还原成H3AsO3 , 这表明。23. 苹果酸(MLA)的键线式结构为 , 苹果酸经聚合生成聚苹果酸(PMLA)。
, 苹果酸经聚合生成聚苹果酸(PMLA)。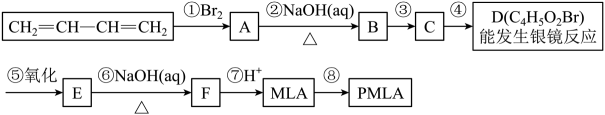 (1)、写出物质的结构简式:A , D。(2)、指出合成路线中③的反应类型:③。检验D中溴元素的实验方法是。(3)、写出所有与MLA具有相同官能团的同分异构体的结构简式。(4)、写出E→F转化的化学方程式。(5)、上述转化关系中步骤③和④的顺序能否颠倒?(填“能”或“不能”)。说明理由:。(6)、已知
(1)、写出物质的结构简式:A , D。(2)、指出合成路线中③的反应类型:③。检验D中溴元素的实验方法是。(3)、写出所有与MLA具有相同官能团的同分异构体的结构简式。(4)、写出E→F转化的化学方程式。(5)、上述转化关系中步骤③和④的顺序能否颠倒?(填“能”或“不能”)。说明理由:。(6)、已知 , 设计一条从CH2=CH-CH=CH2合成阻燃剂
, 设计一条从CH2=CH-CH=CH2合成阻燃剂 的合成路线 (其他无机试剂任选)。 (合成路线常用的表示方式为:AB……目标产物) 24. PCl3是重要的化工原料。如图为实验室中制取粗PCl3产品的装置,夹持装置略去。
的合成路线 (其他无机试剂任选)。 (合成路线常用的表示方式为:AB……目标产物) 24. PCl3是重要的化工原料。如图为实验室中制取粗PCl3产品的装置,夹持装置略去。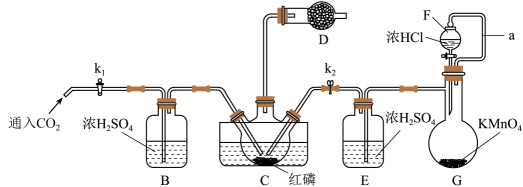
经查阅资料知:红磷与少量Cl2反应生成PCl3 , 与过量Cl2反应生成PCl5 , PCl3遇水会强烈水解生成H3PO3 , PCl3遇O2会生成POCl3 , PCl3、POCl3的熔沸点见如表。
物质
熔点/ oC
沸点/ oC
PCl3
-112
75.5
POCl3
2
105.3
完成下列填空:
(1)、仪器D的名称是。装置F与G由橡胶管a相连通,a的作用是。(2)、实验时,检查装置气密性后,先打开K1通入CO2 , 再迅速加入红磷。通入CO2的作用是。(3)、装置D中盛有碱石灰,其作用一与B、E相似,作用二为。(4)、装置C中的反应需要65~70 oC,最适合的加热方式为加热,该方法的优点是。制得的PCl3粗产品中常含有POCl3、PCl5等。加入红磷加热除去PCl5后,通过(填实验操作名称),即可得到较纯净的PCl3。(5)、通过实验测定粗产品中PCl3的质量分数,实验步骤如下(不考虑杂质的反应):第一步:迅速移取20.000 g PCl3粗产品,加水完全水解;
第二步:配成500mL溶液,移取25.00mL溶液置于锥形瓶中;
第三步:加入0. 500mol·L-1碘溶液20.00 mL,碘过量,H3PO3完全反应生成H3PO4 , 反应方程式为H3PO3+H2O+I2=H3PO4+2HI;
第四步:加入几滴淀粉溶液,用1.000 mol·L-1Na2S2O3标准溶液滴定过量的碘,反应方程式为I2+2Na2S2O3=Na2S4O6+2NaI,滴至终点时消耗Na2S2O3标准溶液12.00mL。
第二步需要的定量仪器名称为。根据上述数据,计算该产品中PCl3的质量分数为。