上海市金山区2022-2023学年高三下学期二模测试化学试题
试卷更新日期:2023-05-25 类型:高考模拟
一、单选题
-
1. 某合金与铁的物理性质的比较如下表所示,还知该合金耐腐蚀、强度大,从以上性能看,该合金不适合做( )
熔点/℃
密度(g/cm3)
硬度(金刚石为10)
导电性(银为100)
某合金
2500
3.00
7.4
2.3
铁
1535
7.86
4.5
17
A、导线 B、门窗框 C、炉具 D、飞机外壳2. 反应2NH3+NaClO=N2H4+NaCl+H2O可用于制备火箭推进剂的燃料N2H4。下列有关说法正确的是 ( )A、N2H4的结构式: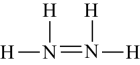 B、中子数为8的氮原子:15N
C、O原子的最外层电子排布式:2s22p6
D、NaClO的电子式:
B、中子数为8的氮原子:15N
C、O原子的最外层电子排布式:2s22p6
D、NaClO的电子式: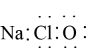 3. 下列物质在空气中久置会变质,变质过程不涉及氧化还原反应的物质是 ( )A、Na B、Na2O C、Na2O2 D、Na2SO34. 在稀硫酸中加入铜粉,铜粉不溶解,再加入物质X后铜粉逐渐溶解,X可能是 ( )A、HCl B、Fe2(SO4)3 C、K2S D、FeSO45. 下列不能用键能解释的事实是 ( )A、晶体密度:SiO2>CO2 B、热稳定性:CH4>SiH4 C、活泼性:乙烯>苯 D、硬度:金刚石>晶体硅6. 下列物质中,属于含非极性键的共价化合物是 ( )A、CH3OH B、NH4Cl C、C2H4 D、Na2O27. 布洛芬是一种解热镇痛药,结构简式如图所示。下列关于布洛芬的叙述正确的是 ( )
3. 下列物质在空气中久置会变质,变质过程不涉及氧化还原反应的物质是 ( )A、Na B、Na2O C、Na2O2 D、Na2SO34. 在稀硫酸中加入铜粉,铜粉不溶解,再加入物质X后铜粉逐渐溶解,X可能是 ( )A、HCl B、Fe2(SO4)3 C、K2S D、FeSO45. 下列不能用键能解释的事实是 ( )A、晶体密度:SiO2>CO2 B、热稳定性:CH4>SiH4 C、活泼性:乙烯>苯 D、硬度:金刚石>晶体硅6. 下列物质中,属于含非极性键的共价化合物是 ( )A、CH3OH B、NH4Cl C、C2H4 D、Na2O27. 布洛芬是一种解热镇痛药,结构简式如图所示。下列关于布洛芬的叙述正确的是 ( )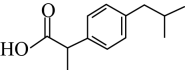 A、分子式为C13H16O2 B、有6种一氯代物 C、分子中至少有9个碳原子共面 D、能发生取代、加成反应8. 某单烯烃加氢产物只有2种一氯代物,则该单烯烃的结构简式为 ( )A、CH3CH2CH=CHCH2CH3 B、CH2=CHC(CH3)3 C、(CH3)2C=C(CH3)2 D、CH3CH=CHCH(CH3)29. 利用如图所示装置(夹持装置略)进行实验,a中生成物的检验方法正确的是 ( )
A、分子式为C13H16O2 B、有6种一氯代物 C、分子中至少有9个碳原子共面 D、能发生取代、加成反应8. 某单烯烃加氢产物只有2种一氯代物,则该单烯烃的结构简式为 ( )A、CH3CH2CH=CHCH2CH3 B、CH2=CHC(CH3)3 C、(CH3)2C=C(CH3)2 D、CH3CH=CHCH(CH3)29. 利用如图所示装置(夹持装置略)进行实验,a中生成物的检验方法正确的是 ( )a中反应
b中检测试剂及现象

A
MnO2(s)和浓HCl(aq)生成Cl2
AgNO3(aq)中有白色沉淀
B
C(s)与浓H2SO4生成CO2
澄清石灰水变浑浊
C
浓NaOH(aq)与NH4Cl(aq)生成NH3
酚酞溶液变红
D
CH3CH2Br与NaOH乙醇溶液生成CH2=CH2
KMnO4(H+)褪色
A、A B、B C、C D、D10. 将铜片与石墨连接浸入到稀硫酸溶液中(如图) ,过了较长时间后,发现溶液出现蓝色,下列说法正确的是 ( )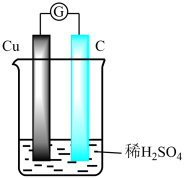 A、铜发生了析氢腐蚀 B、石墨电极发生 O2+4e—+2H2O = 4OH- C、电池总反应是:2Cu+2H2SO4+O2 =2CuSO4+2H2O D、石墨电极附近 Cu2+浓度增加,H+浓度增加11. 实验室制备乙酸丁酯,反应温度要控制在115℃~125℃之间,有关数据如下表:
A、铜发生了析氢腐蚀 B、石墨电极发生 O2+4e—+2H2O = 4OH- C、电池总反应是:2Cu+2H2SO4+O2 =2CuSO4+2H2O D、石墨电极附近 Cu2+浓度增加,H+浓度增加11. 实验室制备乙酸丁酯,反应温度要控制在115℃~125℃之间,有关数据如下表:物质
乙酸
1−丁醇
乙酸丁酯
98%浓硫酸
沸点
117.9℃
117.2℃
126.3℃
338.0℃
溶解性
溶于水和有机溶剂
溶于水和有机溶剂
微溶于水,溶于有机溶剂
与水混溶
下列叙述正确的是 ( )
A、采用加热回流装置 B、不用水浴加热的原因:乙酸丁酯的沸点高于100℃ C、分离粗品:用NaOH(aq)洗涤反应后混合物,再分液 D、粗品精制:加吸水剂分液12. 如图所示是铁及其化合物的价类二维图,下列有关叙述正确的是 ( )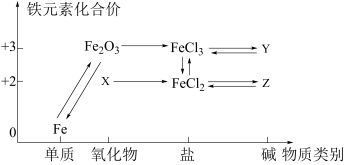 A、物质X是Fe3O4 B、Fe2O3→Fe的转化,Fe2O3发生氧化反应 C、在空气中Z→Y的现象是白色沉淀迅速变成灰绿色,最终变成红褐色 D、可通过复分解反应实现FeCl2和FeCl3的相互转化13. 明代《徐光启手迹》中记载了硝酸的制备方法,其主要物质转化流程如图所示。下列说法正确的是 ( )
A、物质X是Fe3O4 B、Fe2O3→Fe的转化,Fe2O3发生氧化反应 C、在空气中Z→Y的现象是白色沉淀迅速变成灰绿色,最终变成红褐色 D、可通过复分解反应实现FeCl2和FeCl3的相互转化13. 明代《徐光启手迹》中记载了硝酸的制备方法,其主要物质转化流程如图所示。下列说法正确的是 ( )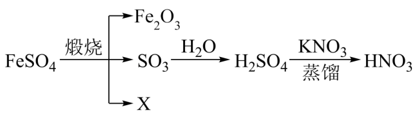 A、X为SO2 B、现代工业用稀硫酸吸收SO3 C、上述转化流程涉及分解、化合和置换反应 D、制取HNO3是利用了强酸制弱酸的反应原理14. 氮化硅(Si3N4)熔点高、硬度大,以硅烷(SiH4 , Si为+4价)为原料制备氮化硅(Si3N4)的原理为3SiH4+4NH3=Si3N4+12H2 , 下列事实能说明N和Si非金属性强弱的是 ( )A、键角:SiH4>NH3 B、SiH4在反应中作还原剂 C、Si3N4为原子晶体 D、SiH4与NH3分子的极性不同15. 下列由废催化剂(主要含FeBr3及少量溴、苯)制取无水FeCl3的实验,能达到实验目的的是 ( )
A、X为SO2 B、现代工业用稀硫酸吸收SO3 C、上述转化流程涉及分解、化合和置换反应 D、制取HNO3是利用了强酸制弱酸的反应原理14. 氮化硅(Si3N4)熔点高、硬度大,以硅烷(SiH4 , Si为+4价)为原料制备氮化硅(Si3N4)的原理为3SiH4+4NH3=Si3N4+12H2 , 下列事实能说明N和Si非金属性强弱的是 ( )A、键角:SiH4>NH3 B、SiH4在反应中作还原剂 C、Si3N4为原子晶体 D、SiH4与NH3分子的极性不同15. 下列由废催化剂(主要含FeBr3及少量溴、苯)制取无水FeCl3的实验,能达到实验目的的是 ( )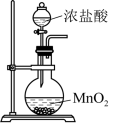
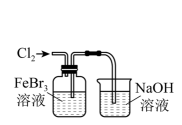
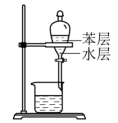
A.制取氯气
B.氧化Br-
C.分离FeCl3(aq)
D.蒸干溶液得FeCl3·6H2O
A、A B、B C、C D、D16. 常温下酸性:HSO>HClO。SO2与足量Ca(ClO)2(aq)反应的离子方程式为 ( )A、SO2+H2O+ClO-=HSO+HClO B、SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO C、SO2+H2O+Ca2++ClO-=CaSO4↓+Cl-+2H+ D、SO2+H2O+Ca2++3ClO-=CaSO4↓+Cl-+2HClO17. 向100 mL 0.01 mol·L-1 Ba(OH)2(aq)中滴加0.1 mol·L-1 NaHCO3(aq),测得溶液电导率的变化如图。下列说法错误的是 ( )
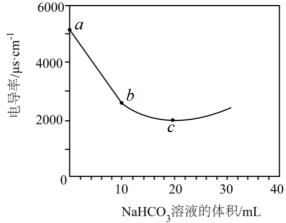 A、a→b发生的主要反应:Ba2++2OH-+2HCO=BaCO3↓+2H2O+CO B、b→c,溶液中的c(OH-)减小 C、c点溶液存在:c(OH-)-c(H+)=c(HCO)+2c(H2CO3) D、溶液中水的电离程度:c>b>a18. 溶液A中含有如下离子中的若干种:Na+、NH、Mg2+、SO、SO、Cl-、OH-。为确定溶液中所含离子,现取该溶液进行有关实验,实验结果如下:
A、a→b发生的主要反应:Ba2++2OH-+2HCO=BaCO3↓+2H2O+CO B、b→c,溶液中的c(OH-)减小 C、c点溶液存在:c(OH-)-c(H+)=c(HCO)+2c(H2CO3) D、溶液中水的电离程度:c>b>a18. 溶液A中含有如下离子中的若干种:Na+、NH、Mg2+、SO、SO、Cl-、OH-。为确定溶液中所含离子,现取该溶液进行有关实验,实验结果如下:下列说法正确的是 ( )
 A、气体E能使湿润的蓝色石蕊试纸先变红后褪色 B、若向沉淀B中加入足量稀硝酸,最终得到4.66 g沉淀 C、滤液C中大量存在的离子有NH、Ba2+、Cl-、OH- D、溶液A中可能有Na+ , 无Cl-19. 将一定量锌与100 mL 18 mol∙L−1的浓硫酸充分反应,锌完全溶解时产生0.8 mol气体(不考虑气体在溶液中的溶解),将反应后的溶液稀释至400 mL,测得溶液中c(H+)=x mol∙L−1 , 则下列叙述错误的是 ( )A、共消耗锌48.0 g B、共转移电子1.6 mol C、气体中 D、生成气体体积约为17.92 L(STP)20. 以Fe3O4为原料炼铁,主要发生如下反应:
A、气体E能使湿润的蓝色石蕊试纸先变红后褪色 B、若向沉淀B中加入足量稀硝酸,最终得到4.66 g沉淀 C、滤液C中大量存在的离子有NH、Ba2+、Cl-、OH- D、溶液A中可能有Na+ , 无Cl-19. 将一定量锌与100 mL 18 mol∙L−1的浓硫酸充分反应,锌完全溶解时产生0.8 mol气体(不考虑气体在溶液中的溶解),将反应后的溶液稀释至400 mL,测得溶液中c(H+)=x mol∙L−1 , 则下列叙述错误的是 ( )A、共消耗锌48.0 g B、共转移电子1.6 mol C、气体中 D、生成气体体积约为17.92 L(STP)20. 以Fe3O4为原料炼铁,主要发生如下反应:反应Ⅰ:Fe3O4(s)+CO(g) 3FeO(s)+CO2(g)+Q1(Q1<0)
反应Ⅱ:Fe3O4(s)+4CO(g) 3Fe(s)+4CO2(g)+Q2
将一定体积CO通入装有Fe3O4粉末的反应器,其它条件不变,反应达平衡,测得CO的体积分数随温度的变化关系如图所示。下列说法正确的是 ( )
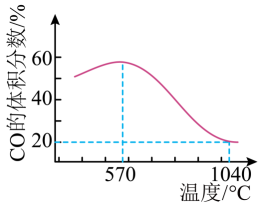 A、Q2<0 B、反应温度越高,Fe3O4主要还原产物中铁元素的价态越低 C、在恒温、恒容的反应器中,当压强保持不变时,反应Ⅰ、Ⅱ均达到平衡状态 D、温度高于1040℃时,反应I的化学平衡常数K>4
A、Q2<0 B、反应温度越高,Fe3O4主要还原产物中铁元素的价态越低 C、在恒温、恒容的反应器中,当压强保持不变时,反应Ⅰ、Ⅱ均达到平衡状态 D、温度高于1040℃时,反应I的化学平衡常数K>4二、非选择题
-
21. 白云石的化学组成是CaCO3·MgCO3 , 500℃以下分解成二氧化碳、金属氧化物和碳酸盐,800℃以上则彻底分解成氧化物。(1)、镁和钙在元素周期表中位于族,它们的价电子轨道式表示式为(用n表示电子层数)。(2)、白云石500℃以下分解的化学方程式为。(3)、从物质结构角度分析、比较白云石分解生成的MgO和CaO的热稳定性。 。(4)、白云石分解得到的CO2是氨碱法制备纯碱的基本原料之一,写出氨碱法制纯碱主要反应的化学方程式。、;向氨碱法的母液中加入生石灰可实现(填化学式)的循环利用。处理后的母液经蒸发、浓缩、冷却、固化可得CaCl2。以质量比为1.44∶1的CaCl2·6H2O与冰水混合,可获得-55℃的低温,配制该制冷剂时不使用无水CaCl2的原因是。22.(1)、Ⅰ.H2S与CH4重整,不但可以消除污染,还可以制氢。主要反应如下:①CH4(g)+2H2S(g) CS2(g)+4H2(g)+Q(Q<0)
在恒温恒容条件下,可作为反应①达到平衡状态的判断依据是____(选填编号)。
A、混合气体密度不变 B、容器内压强不变 C、2v正(H2S)=v逆(CS2) D、CH4与H2的物质的量分数之比保持不变(2)、Ⅱ.在恒压条件下,以n(CH4)∶n(H2S)=1∶2的组成的混合气体发生反应①,达到平衡状态时,四种组分物质的量分数随温度的变化如图所示。
如图中表示CH4、CS2变化的曲线分别是、(选填编号)。
(3)、M点对应温度下,H2S的转化率是。(4)、Ⅲ.在研究反应发生的适宜条件时发现:过多的CH4会导致Al2O3催化剂失活;Co助剂有稳定催化剂的作用。如图表示800℃,Al2O3催化剂条件下投入等量H2S,投料比[n(CH4)∶n(H2S)]分别为1∶1、1∶3、12∶1,达平衡时H2S转化率、平均反应速率。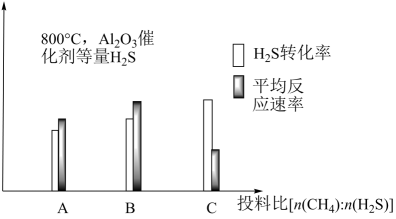
投料比n(CH4)∶n(H2S)=1∶1为对应图中组图像(选填“A”“B”或“C”);在三组图像中,C组图像中平均反应速率最低的可能原因是。
(5)、未添加Co助剂时,无积碳,随着Co添加量的变化,积碳量变化如图所示,Co助剂可能催化原料气发生反应的化学方程式为。 23. 环氧乙烷(
23. 环氧乙烷( )是一种基础有机化工原料,以环氧乙烷为原料合成M(
)是一种基础有机化工原料,以环氧乙烷为原料合成M(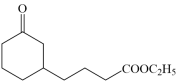 )的一条合成路线如下:
)的一条合成路线如下: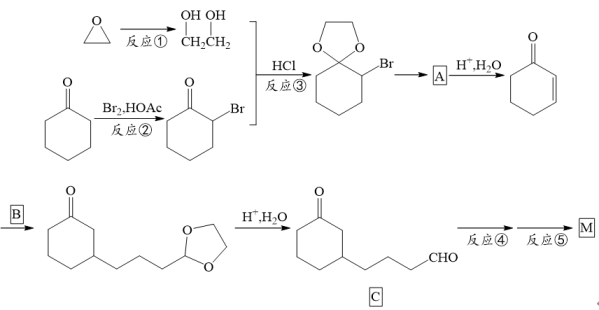 (1)、在一定条件下,环氧乙烷可与H2、H2O、HBr等小分子发生类似加成的开环反应,如反应①。写出反应①的化学方程式。(2)、反应②的反应类型是。设计反应③的目的是。(3)、A的结构简式为 , C中含有的官能团有羰基和 , 写出一种满足下列条件的C的结构简式。
(1)、在一定条件下,环氧乙烷可与H2、H2O、HBr等小分子发生类似加成的开环反应,如反应①。写出反应①的化学方程式。(2)、反应②的反应类型是。设计反应③的目的是。(3)、A的结构简式为 , C中含有的官能团有羰基和 , 写出一种满足下列条件的C的结构简式。①含六元碳环;②含三种不同化学环境的H原子;③能发生银镜反应
(4)、反应⑤的反应条件是。(5)、以 和HOCH2CH2OH为主要原料合成B(
和HOCH2CH2OH为主要原料合成B( )(无机试剂任选),将以下合成路线补充完整。已知:RBrRMgBr
)(无机试剂任选),将以下合成路线补充完整。已知:RBrRMgBr 24.(1)、Ⅰ.氯及其化合物是卤素中最早被认识和制备的。KClO3热分解是实验室制取O2的方法之一,KClO3在不同条件下热分解结果如下:
24.(1)、Ⅰ.氯及其化合物是卤素中最早被认识和制备的。KClO3热分解是实验室制取O2的方法之一,KClO3在不同条件下热分解结果如下:实验
反应体系
第一放热温度/℃
第二放热温度/℃
A
KClO3
400
480
B
KClO3+Fe2O3
360
390
C
KClO3+MnO2
350
已知:①K(s)+Cl2(g)=KCl(s)+437kJ
②K(s)+Cl2(g)+O2=KClO3(s)+398kJ
③K(s)+Cl2(g)+2O2=KClO4(s)+433kJ
实验A、B在第一放热温度时分解的热化学方程式为4KClO3(s) 3KClO4(s)+KCl(s)+Q,Q=kJ。
(2)、实验C制得的O2因混有杂质而有轻微的刺激性气味,杂质气体可能是 , 检验方法是。(3)、Ⅱ.甲苯(C6H5CH3)与干燥的Cl2在光照下反应生成氯化苄(C6H5CH2Cl)。用下列方法分析粗产品的纯度:称取0.255 g样品,与足量 4 mol∙L−1 NaOH(aq)混合加热回流1 h,冷却至室温,加入足量硝酸酸化后,用25.00 mL 0.1000 mol∙L−1AgNO3(aq)处理,再以NH4Fe(SO4)2为指示剂,用0.1000 mol∙L−1 NH4SCN(aq)滴定剩余的AgNO3(aq),发生反应:Ag++SCN-=AgSCN↓,消耗NH4SCN(aq) 6.75 mL。滴定终点溶液为色,样品中氯化苄的质量分数为(保留两位有效数字)。
(4)、通常上述测定结果高于样品中氯化苄的实际含量,任写两个可能的原因。(5)、上述方法不适用于氯苯(C6H5Cl)的纯度分析,原因是。