陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题
试卷更新日期:2023-05-25 类型:高考模拟
一、单选题
-
1. 2022年北京冬奥会成功举办、“天宫课堂”精彩呈现均展示了我国科技发展的巨大成就,下列相关叙述正确的是A、冬奥会场馆使用CO2跨临界直冷制冰属于化学变化 B、冬奥会领奖礼服中的石墨烯发热材料属于有机高分子材料 C、“天宫课堂”中乙酸钠过饱和溶液结晶形成温热“冰球”,该过程属于放热过程 D、“天宫课堂”水油分离实验中液体食用油与水不分层是因为油和水在太空中发生了化学反应2. 《本草纲目》果部第三十卷中提到“山楂化饮食,消肉积、症瘕、痰饮、痞满吞酸、滞血痛胀。”山楂中的有效成分枸橼酸又称柠檬酸,结构如下,下列说法中正确的是
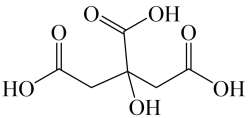 A、柠檬酸的酸性比碳酸弱 B、柠檬酸易溶于水,可与水分子形成氢键 C、1mol 柠檬酸可与4molNaOH反应 D、柠檬酸可发生取代反应、加成反应和氧化反应3. X、Y、Z、R、W是五种短周期元素,原子序数依次增大,其中X是形成化合物最多的元素,Y、R同主族,X、Y、Z、W四种元素能形成化合物Z2Y和XW4。下列说法正确的是A、简单离子半径的大小顺序:R>Z>Y B、气态氢化物的稳定性:HmW<HnR C、化合物Z2R2Y3水溶液与W的氢化物反应能够生成沉淀 D、R2W2 和Z2Y2具有相同的化学键类型4. 下列实验操作、现象和所得结论均正确的是
A、柠檬酸的酸性比碳酸弱 B、柠檬酸易溶于水,可与水分子形成氢键 C、1mol 柠檬酸可与4molNaOH反应 D、柠檬酸可发生取代反应、加成反应和氧化反应3. X、Y、Z、R、W是五种短周期元素,原子序数依次增大,其中X是形成化合物最多的元素,Y、R同主族,X、Y、Z、W四种元素能形成化合物Z2Y和XW4。下列说法正确的是A、简单离子半径的大小顺序:R>Z>Y B、气态氢化物的稳定性:HmW<HnR C、化合物Z2R2Y3水溶液与W的氢化物反应能够生成沉淀 D、R2W2 和Z2Y2具有相同的化学键类型4. 下列实验操作、现象和所得结论均正确的是选项
实验操作
现象
结论
A
铝箔插入稀硝酸中
无明显现象
铝箔表面形成了致密的氧化膜
B
将足量的H2O2溶液滴入少量的酸性高锰酸钾溶液
溶液的紫色褪去
H2O2具有还原性
C
分别测定等浓度的Na2CO3和Na2SO3溶液的pH
前者pH比后者大
非金属性:S>C
D
将密闭烧瓶中的NO2降温
气体颜色变浅
2NO2(g)N2O4(g) ΔH>0
A、A B、B C、C D、D5. 我国在国际上首次实现了二氧化碳到淀粉的从头合成,其中部分核心反应如图所示。设NA为阿伏加德罗常数的值,下列说法错误的是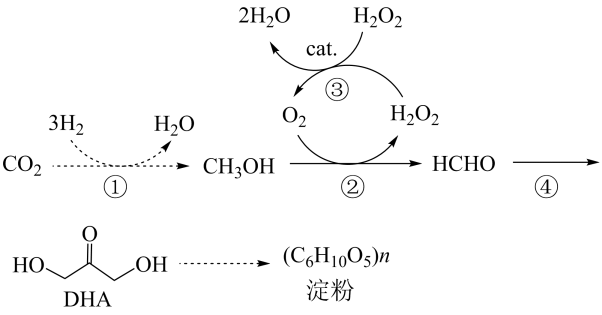 A、反应①消耗44gCO2 , 转移电子数为6NA B、反应②和③的总反应方程式为CH3OH+H2O2=HCHO+2H2O C、30gHCHO与DHA的混合物中含氧原子数目为2NA D、淀粉与纤维素的分子式相同,但二者不互为同分异构体6. 钠碱循环法脱除烟气中的SO2 , 生成的吸收液中含有Na2SO3和NaHSO3。电解吸收液回收SO2 , 并实现碱液的循环。双极膜内层为水层,工作时水层中的H2O解离成H+和OH- , 并分别通过离子交换膜向两侧发生迁移。如图为吸收液的电渗析装置示意图。下列说法正确的是
A、反应①消耗44gCO2 , 转移电子数为6NA B、反应②和③的总反应方程式为CH3OH+H2O2=HCHO+2H2O C、30gHCHO与DHA的混合物中含氧原子数目为2NA D、淀粉与纤维素的分子式相同,但二者不互为同分异构体6. 钠碱循环法脱除烟气中的SO2 , 生成的吸收液中含有Na2SO3和NaHSO3。电解吸收液回收SO2 , 并实现碱液的循环。双极膜内层为水层,工作时水层中的H2O解离成H+和OH- , 并分别通过离子交换膜向两侧发生迁移。如图为吸收液的电渗析装置示意图。下列说法正确的是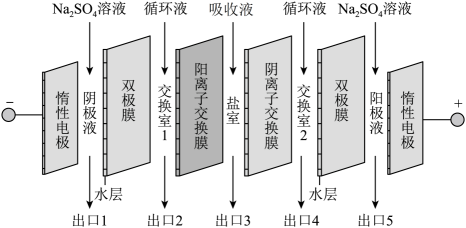 A、出口4的产物为NaOH溶液 B、出口5中Na2SO4溶液的浓度增大 C、、可从盐室最终进入阳极液中 D、阴极电极反应式为2H++2e- =H2↑7. 常温下,用如图1所示装置,向10mL 0.1 mol·L-1 Na2CO3和c mol·L-1NaHCO3混合溶液中逐滴滴加0.1 mol·L-1的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图2所示(忽略温度的变化)。下列说法错误的是
A、出口4的产物为NaOH溶液 B、出口5中Na2SO4溶液的浓度增大 C、、可从盐室最终进入阳极液中 D、阴极电极反应式为2H++2e- =H2↑7. 常温下,用如图1所示装置,向10mL 0.1 mol·L-1 Na2CO3和c mol·L-1NaHCO3混合溶液中逐滴滴加0.1 mol·L-1的稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图2所示(忽略温度的变化)。下列说法错误的是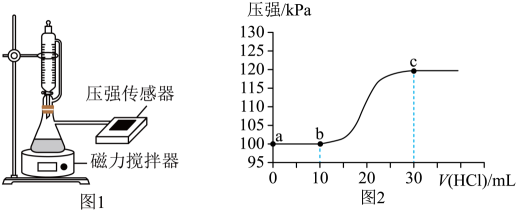 A、c=0.1 B、a点的溶液中: 2c(Na+)=3[c()+c()+c(H2CO3)] C、b点的溶液中:c( )>c()>c(H2CO3) D、a、b两点水的电离程度: a>b
A、c=0.1 B、a点的溶液中: 2c(Na+)=3[c()+c()+c(H2CO3)] C、b点的溶液中:c( )>c()>c(H2CO3) D、a、b两点水的电离程度: a>b二、非选择题
-
8. 氧化锆(ZrO2) 可用于压电陶瓷及耐火材料的制备。以锆英石(主要为ZrSiO4 , 还含有少量的Fe3O4和Al2O3等杂质)为原料制备ZrO2的工艺流程如下:
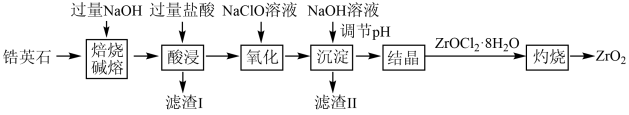
已知:①锆英石焙烧碱熔生成可溶于水的Na2ZrO3 , Na2ZrO3与酸反应生成ZrO2+。
②部分离子在此实验条件下开始沉淀和完全沉淀时的pH如下表:
金属离子
Al3+
Fe2+
Fe3+
ZrO2+
开始沉淀时
3.3
6.3
2.7
6.2
完全沉淀时
5.2
8.4
3.7
8.0
(1)、“焙烧碱熔”前将锆英石粉碎的目的是 , “焙烧碱熔”时制备Na2ZrO3的化学方程式为。(2)、滤渣Ⅰ的成分为 , 滤渣 Ⅱ的成分为。(3)、“酸浸”时,加入过量盐酸的目的是。(4)、“氧化”时发生反应的离子方程式为。(5)、“沉淀”调节溶液的pH范围为。9. 碳酸锰(MnCO3)是制造高性能磁性材料的主要原料。实验室以KMnO4为原料制备少量MnCO3并研究其性质,制备MnCO3的装置如图1所示。已知: MnCO3难溶于水、乙醇,100℃开始分解。 请回答下列问题:
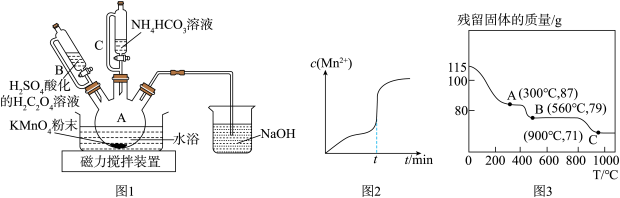 (1)、仪器B的名称为。(2)、在烧瓶中加入一定量的KMnO4固体,滴加硫酸酸化的H2C2O4溶液,其反应的化学方程式为 , 反应过程中c(Mn2+)随时间的变化曲线如图2所示,则tmin时, c(Mn2+)迅速增大的原因是。(3)、反应一段时间后, 当装置A中的溶液由紫色变为无色,再滴加NH4HCO3溶液充分反应生成MnCO3。生成MnCO3的离子方程式为。(4)、实验结束后,将装置A中的混合物过滤,用乙醇洗涤滤渣,再 , 即 得到干燥的MnCO3固体。用乙醇洗涤的优点是 。(5)、在空气中加热MnCO3固体,随着温度的升高,残留固体的质量变化如图3所示。则A点的成分为(填化学式),B→C反应的化学方程式为。10. 丁二烯是生产丁苯橡胶SBR、ABS 树脂、聚丁二烯橡胶BR等的基本原料,也是生产氯丁二烯、乙烯基环己烯等化学品的关键中间体,工业上常在钼系催化剂作用下,用丁烯氧化脱氢制丁二烯。丁烯氧化脱氢制丁二烯的反应如下:
(1)、仪器B的名称为。(2)、在烧瓶中加入一定量的KMnO4固体,滴加硫酸酸化的H2C2O4溶液,其反应的化学方程式为 , 反应过程中c(Mn2+)随时间的变化曲线如图2所示,则tmin时, c(Mn2+)迅速增大的原因是。(3)、反应一段时间后, 当装置A中的溶液由紫色变为无色,再滴加NH4HCO3溶液充分反应生成MnCO3。生成MnCO3的离子方程式为。(4)、实验结束后,将装置A中的混合物过滤,用乙醇洗涤滤渣,再 , 即 得到干燥的MnCO3固体。用乙醇洗涤的优点是 。(5)、在空气中加热MnCO3固体,随着温度的升高,残留固体的质量变化如图3所示。则A点的成分为(填化学式),B→C反应的化学方程式为。10. 丁二烯是生产丁苯橡胶SBR、ABS 树脂、聚丁二烯橡胶BR等的基本原料,也是生产氯丁二烯、乙烯基环己烯等化学品的关键中间体,工业上常在钼系催化剂作用下,用丁烯氧化脱氢制丁二烯。丁烯氧化脱氢制丁二烯的反应如下:反应: 2C4H8 (g) +O2 (g) =2C4H6 (g) +2H2O (g) ΔH
副反应①: C4H8(g) +6O2 (g) =4CO2 (g) +4H2O (g) ΔH =-2542.6kJ·mol-1
副反应②: 2C4H6 (g) +11O2 (g) =8CO2 (g) +6H2O (g) ΔH2= -4886.6kJ·mol-1
(1)、丁烯氧化脱氢制丁二烯反应的 ΔH =。(2)、在钼系催化剂作用下,某恒压密闭容器中通入一定量的丁烯和氧气发生反应: 2C4H8 (g) +O2 (g) 2C4H6(g) +2H2O (g),分别测得温度和氧烯比(氧气和丁烯的物质的量之比)对丁烯的转化率和丁二烯选择性的影响如下图所示:

氧烯比固定,温度升高,丁烯单位时间内转化率先增大后无明显变化的原因是; 丁
丁二烯最佳的温度和氧烯比分别为;
(3)、400℃时,在体积为1L的恒容密闭容器中充入1mol C4H8和1mol O2发生丁烯氧化脱氢制丁二烯反应和副反应①和②,测得此时容器的压强为P0 , 平衡时容器内的压强为1.2P0 , C4H8的转化率为70%,丁二烯的选择性为90%,则平衡后C4H6 (g)的体积分数为 , 丁烯氧化脱氢制丁二烯反应的平衡常数K=。(4)、钼系催化剂上C4H8燃烧反应的速率方程为v (C4H8) =k·px (C4H8) ·Py (O2)。为确定x和y,通过实验获得如图3数据,则: x和y分别为、。(5)、一种以C4H8为主要原料的电池工作原理如图4所示。B上的电极反应式为。11. 铁在史前就为人们所用。在人类文明发展过程中,铁所起的作用是其他任何元素都不能比拟的。请回答下列问题:(1)、基态铁原子中,价电子电子云的伸展方向有 种。(2)、五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有 ( 填序号);A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是。
(3)、绿矾(FeSO4·7H2O)结构如图。
①H2O分别与Fe2+、 的相互作用分别为、。
②比较中的键角∠O−S−OH2O中的键角∠H−O−H。 (填“<” “>”或“=”)
(4)、铁的化合物种类众多,其中FeF3的熔点高于1000℃,而FeBr3的熔点只有200℃,原因是。(5)、铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为。 (6)、一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm= cm3·mol−1 (已知阿伏加德罗常数为NA , 晶体的摩尔体积是指单位物质的量晶体所占的体积)。12. 北京冬奥会滑雪比赛冠军谷爱凌戴的滑雪镜不仅颜值高且不易碎兼具良好的透明度,制作材料是一种高分子材料一一聚碳酸酯(简称PC),其合成路线如下:
(6)、一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm= cm3·mol−1 (已知阿伏加德罗常数为NA , 晶体的摩尔体积是指单位物质的量晶体所占的体积)。12. 北京冬奥会滑雪比赛冠军谷爱凌戴的滑雪镜不仅颜值高且不易碎兼具良好的透明度,制作材料是一种高分子材料一一聚碳酸酯(简称PC),其合成路线如下: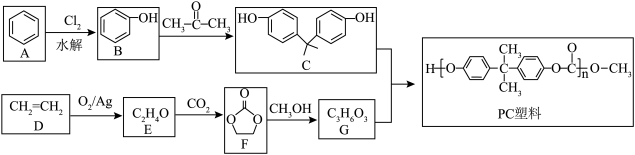
已知: CH3COOCH3+CH3CH2OH→CH3COOCH2CH3+CH3OH。
请回答下列问题:
(1)、 的名称是。 (2)、若E中只含一种类型的氢原子,则E的结构简式为 , 已知G中也只含有一种类型的氢原子则F→G反应类型为。(3)、PC塑料所含官能团的名称是 , 生成PC塑料的化学方程式为。(4)、PC塑料与足量NaOH溶液反应的化学方程式为。(5)、化合物X是C的同分异构体,苯环上的一氯代物有两种,则符合条件的X有 种:且吸收面积比为3:2:2:1的同分异构体的结构简式为。
的名称是。 (2)、若E中只含一种类型的氢原子,则E的结构简式为 , 已知G中也只含有一种类型的氢原子则F→G反应类型为。(3)、PC塑料所含官能团的名称是 , 生成PC塑料的化学方程式为。(4)、PC塑料与足量NaOH溶液反应的化学方程式为。(5)、化合物X是C的同分异构体,苯环上的一氯代物有两种,则符合条件的X有 种:且吸收面积比为3:2:2:1的同分异构体的结构简式为。