辽宁省大连市2023届高三下学期一模化学试题
试卷更新日期:2023-05-25 类型:高考模拟
一、选择题
-
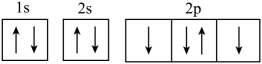
1. 化学与生活、生产密切相关。下列说法错误的是A、“北斗系统”组网成功,北斗芯片中的半导体材料为硅 B、根据纤维在火焰上燃烧产生的气味,可以鉴别蚕丝与棉花 C、植物从土壤中吸收、转化为氨基酸的过程属于氮的固定 D、陶瓷在我国具有悠久的制造历史,其以黏土(主要成分为含水的铝硅酸盐)为主要原料2. 下列化学用语表达正确的是A、氧的基态原子的轨道表示式:
 B、甲烷分子和四氯化碳分子的空间填充模型均为:
B、甲烷分子和四氯化碳分子的空间填充模型均为: C、的名称:2-甲基丁酸
D、分子中,碳原子与氧原子之间的共价键:键
3. 为阿伏加德罗常数的值。下列叙述正确的是A、0.1 mol/L 溶液中,含有的数目为0.2 B、标准状况下,22.4 L 和22.4 L 在光照下充分反应后的分子数为2 C、1 mol 晶体和1 mol 晶体含有的离子数目均为2 D、一定条件下,5.6 g Fe与0.1 mol 充分反应,转移的电子数为0.34. 下列实验设计和操作合理的是A、用浓磷酸与碘化钠固体共热制备HI气体 B、用饱和碳酸钠溶液除去中混有的少量HCl气体 C、用乙醛作萃取剂萃取溴水中的溴 D、用NaOH标准液滴定未知浓度的醋酸溶液,可以选择甲基橙做指示剂5. 下列离子方程式书写正确的是A、向溶液中加入稀硫酸: B、用亚硫酸钠溶液吸收少量氯气: C、Fe与稀硝酸反应,当时: D、用过量苯酚溶液与碳酸钠溶液反应:2
C、的名称:2-甲基丁酸
D、分子中,碳原子与氧原子之间的共价键:键
3. 为阿伏加德罗常数的值。下列叙述正确的是A、0.1 mol/L 溶液中,含有的数目为0.2 B、标准状况下,22.4 L 和22.4 L 在光照下充分反应后的分子数为2 C、1 mol 晶体和1 mol 晶体含有的离子数目均为2 D、一定条件下,5.6 g Fe与0.1 mol 充分反应,转移的电子数为0.34. 下列实验设计和操作合理的是A、用浓磷酸与碘化钠固体共热制备HI气体 B、用饱和碳酸钠溶液除去中混有的少量HCl气体 C、用乙醛作萃取剂萃取溴水中的溴 D、用NaOH标准液滴定未知浓度的醋酸溶液,可以选择甲基橙做指示剂5. 下列离子方程式书写正确的是A、向溶液中加入稀硫酸: B、用亚硫酸钠溶液吸收少量氯气: C、Fe与稀硝酸反应,当时: D、用过量苯酚溶液与碳酸钠溶液反应:2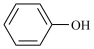 +2
+2 +H2O+CO2
6. 类比法是一种学习化学的重要方法。下列“类比”不合理的是A、酸性: , 则碱性: B、溶液显碱性,则溶液显碱性 C、与HCl反应生成 , 则也可与HCl反应生成 D、的沸点比的高,则的沸点比的高7. 一种用溶液浸取黄铁矿(主要含 , 还含有少量难溶性杂质)的流程如图所示。下列叙述错误的是
+H2O+CO2
6. 类比法是一种学习化学的重要方法。下列“类比”不合理的是A、酸性: , 则碱性: B、溶液显碱性,则溶液显碱性 C、与HCl反应生成 , 则也可与HCl反应生成 D、的沸点比的高,则的沸点比的高7. 一种用溶液浸取黄铁矿(主要含 , 还含有少量难溶性杂质)的流程如图所示。下列叙述错误的是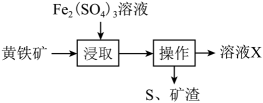 A、浸取时主要反应的离子方程式为: B、可以向操作后的溶液X中加入KSCN溶液,检验是否反应完全 C、溶液X经过一系列操作,可制得“绿矾晶体() D、实验室中可以利用溶液和NaOH溶液混合制备胶体8. 乙烯与溴单质发生加成反应的反应机理如图所示。下列有关叙述错误的是
A、浸取时主要反应的离子方程式为: B、可以向操作后的溶液X中加入KSCN溶液,检验是否反应完全 C、溶液X经过一系列操作,可制得“绿矾晶体() D、实验室中可以利用溶液和NaOH溶液混合制备胶体8. 乙烯与溴单质发生加成反应的反应机理如图所示。下列有关叙述错误的是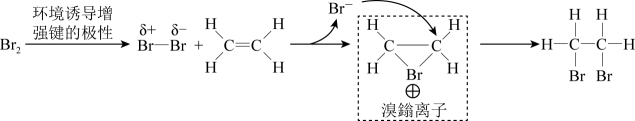 A、溴鎓离子中溴原子的杂化方式为 B、将乙烯分别通入等物质的量浓度的溴的溶液和溴水中,则反应速率:前者>后者 C、加成反应过程中,有非极性键的断裂以及极性键的形成 D、将乙烯通入溴水中,理论上会有一定量的生成9. 由下列实验操作及现象能得出相应结论的是
A、溴鎓离子中溴原子的杂化方式为 B、将乙烯分别通入等物质的量浓度的溴的溶液和溴水中,则反应速率:前者>后者 C、加成反应过程中,有非极性键的断裂以及极性键的形成 D、将乙烯通入溴水中,理论上会有一定量的生成9. 由下列实验操作及现象能得出相应结论的是实验操作
现象
结论
A
将1-溴丁烷与氢氧化钠的乙醇溶液共热,将产生的气体通入酸性高锰酸钾溶液中
酸性高锰酸钾溶液褪色
可证明产生的气体中有烯烃
B
在物质X柱面上滴一滴熔化的石蜡,用一根红热的铁针刺中凝固的石蜡
石蜡熔化呈椭圆形
说明物质X为非晶体
C
将2 mL 0.5 mol/L的溶液加热
溶液变为黄色
(黄色)。正反应方向为放热反应
D
分别向盛有溶液和溶液的试管中加入NaOH溶液至过量
前者出现白色沉淀:后者先出现白色沉淀,后沉淀溶解
金属性:Mg>Al
A、A B、B C、C D、D10. 某种含钒超导材料的晶胞结构及晶体结构俯视图如下图,晶胞参数为x nm、x nm、y nm。下列叙述错误的是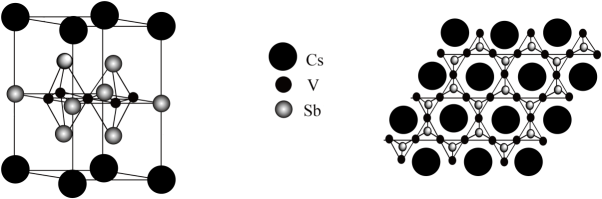 A、该晶体的化学式为 B、基态占据的最高能层的符号是M C、位于元素周期表的第五周期第ⅥA族 D、若该含钒超导材料的摩尔质量为M g/mol,则该晶体密度为 g⋅cm11. 吲哚生物碱具有抗菌、抗炎、抗肿瘤等多种活性,其一种中间体结构简式如图所示。
A、该晶体的化学式为 B、基态占据的最高能层的符号是M C、位于元素周期表的第五周期第ⅥA族 D、若该含钒超导材料的摩尔质量为M g/mol,则该晶体密度为 g⋅cm11. 吲哚生物碱具有抗菌、抗炎、抗肿瘤等多种活性,其一种中间体结构简式如图所示。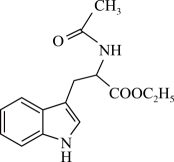
下列关于吲哚生物碱中间体的叙述错误的是
A、该化合物苯环上的二氯代物有6种同分异构体 B、该化合物既能与强酸溶液反应,又能与强碱溶液反应 C、1 mol该化合物与足量加成后。产物分子中含5个手性碳原子 D、该化合物属于芳香族化合物,其中采取杂化方式的碳原子有10个12. 我国科研人员将单独脱除的反应与制备的反应相结合,实现协同转化。已知:反应①单独制备: , 不能自发进行;
反应②单独脱除: , 能自发进行。
协同转化装置如图(在电场作用下,双极膜中间层的解离为和 , 并向两极迁移)。下列分析错误的是
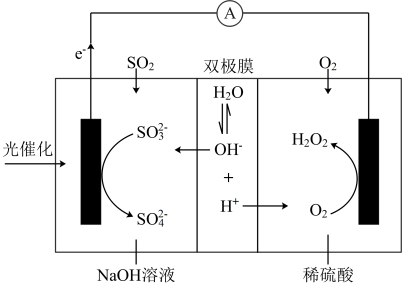 A、反应②释放的能量可以用于反应① B、产生的电极反应: C、当生成0.1 mol 时,负极区溶液质量增重9.8 g D、协同转化总反应:13. 已知总反应: kJ⋅mol()的速率方程为{ , k为速率常数],该反应机理可分为两步:
A、反应②释放的能量可以用于反应① B、产生的电极反应: C、当生成0.1 mol 时,负极区溶液质量增重9.8 g D、协同转化总反应:13. 已知总反应: kJ⋅mol()的速率方程为{ , k为速率常数],该反应机理可分为两步:
Ⅰ. 快
Ⅱ. 慢[速率方程 , 为速率常数,该反应速率近似认为是总反应的速率]。下列叙述正确的是A、 B、当时,总反应达到平衡 C、总反应中生成物的总键能比反应物的总键能小a kJ•mol D、恒容时,增大的浓度能增加单位体积内活化分子的百分数,加快反应速率14. 化合物甲()是制药工业和电池制造业等的原料,其组成元素W、X、Y、Z是原子序数依次增大的前四周期元素:其中W、X、Y为短周期主族元素,W是元素周期表中原子半径最小的元素,X、Y同周期,且X原子和Y原子的最外层电子数之比为2∶3,的电子数比Z原子的电子数多20。化合物甲在加热分解过程中剩余固体的质量随温度变化的曲线如图所示。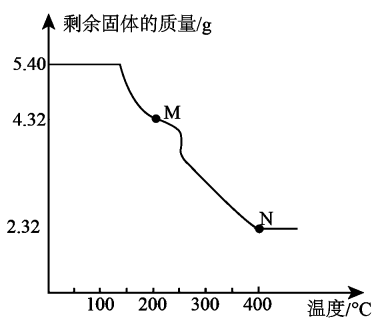
下列叙述正确的是
A、电负性:X>Y>W B、若M点时所得产物化学式为 , 则n为2 C、M到N的过程中只有一种气体生成 D、可由与足量酸性溶液反应得到15. 25℃时,向弱酸的溶液中加入NaOH溶液,所有含R微粒的关系如图所示。下列叙述错误的是
已知:①
②a、b、c三点的坐标:、、
A、属于正盐 B、曲线②表示lgc(H2RO)随pOH的变化 C、a点溶液中, D、反应的平衡常数二、非选择题
-
16. 重铬酸钾()在实验室和工业上都有广泛应用,如用于制铬矾、制火柴、电镀、有机合成等。工业上。以铬铁矿[主要成分为 , 杂质主要为硅、铁、铝的氧化物]制备重铬酸钾的工艺流程如下图所示:
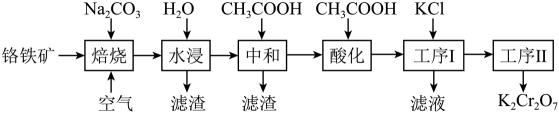
已知:①焙烧时中的Fe元素转化为 , Cr元素转化为;
②矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示。当溶液中可溶性组分浓度 mol⋅L时,可认为已除尽。
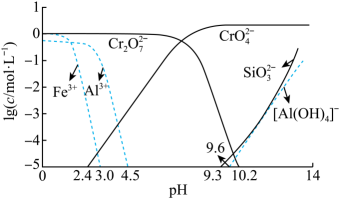
请回答下列问题:
(1)、写出焙烧过程中发生的主要反应的化学方程式。(2)、水浸滤渣的主要成分是 , 写出生成此滤渣的离子方程式。(3)、中和步骤中理论pH的范围是 , 中和后滤渣的主要成分是(填化学式)。(4)、酸化时加冰醋酸,简述不能用盐酸的可能原因是。(5)、工序1加入KCl的作用是。(6)、可以采用氧化还原滴定法测定产品的纯度,还可以采用分光光度法测定(溶液的吸光度与其浓度成正比),但测得的质量分数明显偏低,分析原因,发现配制待测液时少加了一种试剂,该试剂可以是____(填字母)。A、硫酸 B、氢碘酸 C、硝酸钾 D、氢氧化钾17. 甲醇水蒸气催化重整是当前制取清洁能源氢气的主要方法,其反应机理如下:反应1:
反应Ⅱ:
请回答下列问题:
(1)、在精选催化剂R作用下,反应Ⅰ可通过如图1所示的反应历程实现催化重整,则kJ/mol(用含字母a、b、c的代数式表示)。 (2)、将一定量的甲醇气体和水蒸气混合反应,使用催化剂R,测得相同条件下,甲醇的转化率与CO的物质的量分数变化如图2所示。反应Ⅱ为反应(填“吸热”或“放热”),选择催化剂R的作用为。
(2)、将一定量的甲醇气体和水蒸气混合反应,使用催化剂R,测得相同条件下,甲醇的转化率与CO的物质的量分数变化如图2所示。反应Ⅱ为反应(填“吸热”或“放热”),选择催化剂R的作用为。 (3)、将1 mol甲醇气体和1.2 mol水蒸气混合充入2 L恒容密闭容器中,控制反应温度为300℃、起始压强为2.5 MPa下进行反应。平衡时容器中 mol。此时的浓度为 , 甲醇的转化率为 , 则反应Ⅱ的逆反应的压强平衡常数。(4)、相同反应条件下,得到甲醇水蒸气重整反应各组分的实际组成与反应温度关系曲线图。
(3)、将1 mol甲醇气体和1.2 mol水蒸气混合充入2 L恒容密闭容器中,控制反应温度为300℃、起始压强为2.5 MPa下进行反应。平衡时容器中 mol。此时的浓度为 , 甲醇的转化率为 , 则反应Ⅱ的逆反应的压强平衡常数。(4)、相同反应条件下,得到甲醇水蒸气重整反应各组分的实际组成与反应温度关系曲线图。
下列说法正确的是
A、升温对反应Ⅰ的化学反应速率影响更大 B、催化剂的选择应考虑提高生成的选择性 C、催化剂的活性与温度有关,且反应前后化学性质保持不变 D、若容器内气体的平均摩尔质量保持不变,则反应Ⅱ一定处于平衡状态18. 氢化铝锂()以其优良的还原性广泛应用于医药、农药、香料、染料等行业。实验室按如图流程、装置开展了制备的实验(火持、尾气处理装置已省略)。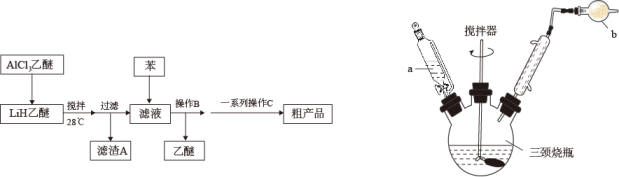
已知:①难溶于烃,可溶于乙醚、四氢呋喃;
②LiH、在潮湿的空气中均会发生剧烈水解;
③乙醚:沸点34.5℃,易燃,一般不与金属单质反应。
请回答下列问题:
(1)、中阴离子的空间结构是。(2)、仪器a的名称是;装置b的作用是。(3)、乙醚中的少量水分也会对的制备产生严重的影响,以下试剂或操作可有效降低市售乙醚(含水体积分数为0.2%)含水量的是____。A、钠 B、分液 C、五氧化二磷 D、通入乙烯(4)、下列说法正确的是a.能溶于乙醚可能与配位键有关
b.滤渣A的主要成分是LiCl
c.为提高过滤出滤渣A的速度,可先加水让滤纸紧贴漏斗内壁
d.为提高合成的速率,可将反应温度提高到50℃
e.操作B可以在分液漏斗中进行
(5)、(不含LiH)纯度可采用如下方法测定(装置如图所示):25℃,常压下,准确称取产品 m g,记录量气管B起始体积读数 mL,在分液漏斗中准确加入过量的四氢呋喃、水混合液15.0 mL,打开旋塞至滴加完所有液体,立即关闭旋塞,调整量气管B.读数 mL。过量四氢呋喃的作用;的质量分数为(用含m、、的代数式表示)。 19. 药物帕罗韦德(Paxlovid)可抑制病毒在细胞内的早期复制,为人体免疫系统最终战胜病毒赢得宝贵的时间。其最重要的片段的H(
19. 药物帕罗韦德(Paxlovid)可抑制病毒在细胞内的早期复制,为人体免疫系统最终战胜病毒赢得宝贵的时间。其最重要的片段的H(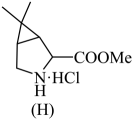 )的合成路线如下:
)的合成路线如下: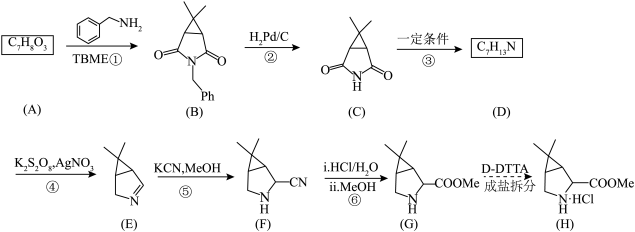
已知:-Ph代表
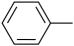 , Me代表
, Me代表请问答下列问题:
(1)、化合物F的官能团名称是。(2)、 的化学名称是。 (3)、④的反应类型是。(4)、写出D的结构简式。(5)、写出⑥中步骤Ⅱ的反应方程式。(6)、已知F的芳香族同分异构体中,苯环上有3个取代基,且不含结构的有机物共有种,写出其中一种核磁共振氢谱的峰面积比为4∶3∶2∶2∶1的化合物的结构简式。
的化学名称是。 (3)、④的反应类型是。(4)、写出D的结构简式。(5)、写出⑥中步骤Ⅱ的反应方程式。(6)、已知F的芳香族同分异构体中,苯环上有3个取代基,且不含结构的有机物共有种,写出其中一种核磁共振氢谱的峰面积比为4∶3∶2∶2∶1的化合物的结构简式。