贵州省2023届高三下学期适应性测试(三模)理科综合化学试题
试卷更新日期:2023-05-25 类型:高考模拟
一、选择题
-
1. 氮是自然界中各种生命体生命活动不可缺少的重要元素,广泛存在于大气、土壤和动植物体内。读自然界中氮循环示意图。
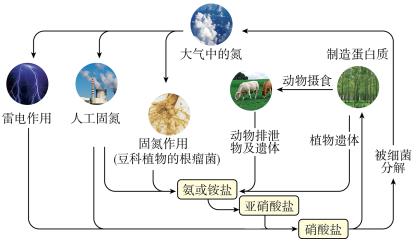
根据氮循环示意图,下列说法错误的是( )
A、图中共表示了两条固氮的途径 B、人类活动对氮循环产生影响 C、硝酸盐参与到多条氮循环线路中 D、动植物体内氮主要存在于蛋白质中2. NA为阿伏加德罗常数的值。下列说法正确的是( )A、常温常压下,22.4LN2中含有的质子数为14NA B、动物遗体腐败产生的17 g NH3中含有共价键为3 NA C、1L0.1 mol·L-1NaNO2溶液中 离子数为0.1 NA D、细菌分解过程中,1mol 被还原为N2转移电子数为10 NA3. 贵州凯里酸汤鱼使用的木姜子含有芳樟醇、牻牛儿醇,其结构简式如下。下列有关芳樟醇、牻牛儿醇的说法正确的是 ( )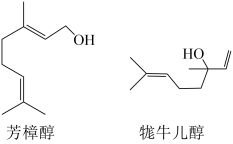 A、互为同分异构体 B、均只能发生加成反应 C、分子中碳原子均能共面 D、可用酸性高锰酸钾溶液鉴别4. 为探究FcCl3的性质,某小组进行如下实验。
A、互为同分异构体 B、均只能发生加成反应 C、分子中碳原子均能共面 D、可用酸性高锰酸钾溶液鉴别4. 为探究FcCl3的性质,某小组进行如下实验。实验1
在 5 mL水中滴加2滴饱和FeCl3溶液,呈棕黄色:煮沸,溶液变为红褐色。
实验2
在 H2O2溶液中滴几滴FeCl2溶液,溶液变黄, 一段时间后溶液中有大量气泡。
实验3
在5mL 0.1 mol·L-1 KI溶液中加入3 mL0.1 mol·L-1 FeCl3溶液:将上述混合液分成两份,一份加入1 mL CCl4充分振荡、静置,下层显紫色;另一份加入1滴KSCN溶液,溶液变红。
依据上述实验现象,结论不合理的是 ( )
A、实验1说明加热促进Fe3+水解 B、实验2说明Fe3+催化了H2O2分解 C、实验3说明氧化性: Fe3+>I2 D、实验3说明该反应中Fe3+过量5. 水系金属燃料电池具有较高的理论容量,常用于大型储能场景。一种水系锌一空气电池(ZAB)如图所示。下列说法错误的是 ( ) A、隔膜为阳离子交换膜 B、该电池具有高安全性,原料丰富等优点 C、放电时,正极发生反应O2+4e-+2H2O = 4OH- D、充电时,当电路中转移2mol电子理论上产生65gZn6. 纳米酶在医学、食品、环境等领域有广泛应用。地壳中含量第二的金属元素R可与短周期主族元素X、Y、Z组成纳米酶。其中X、Y、Z原子序数依次增大且相邻,原子核外电子数之和为31,X与Y同周期。下列判断正确的是 ( )A、原子半径: X>Y> Z B、简单氢化物的沸点: X<Y<Z C、R元素的氧化物都为黑色 D、Y、Z与R可形成既含离子键又含共价键的化合物7. 室温下,向柠檬酸(C6H8O7)溶液中滴入NaOH溶液,随着NaOH溶液的加入,所得溶液中C6H8O7、、 和的分布系数δ (x)随pH变化曲线如图所示。已知δ(x)= , 下列叙述错误的是 ( )
A、隔膜为阳离子交换膜 B、该电池具有高安全性,原料丰富等优点 C、放电时,正极发生反应O2+4e-+2H2O = 4OH- D、充电时,当电路中转移2mol电子理论上产生65gZn6. 纳米酶在医学、食品、环境等领域有广泛应用。地壳中含量第二的金属元素R可与短周期主族元素X、Y、Z组成纳米酶。其中X、Y、Z原子序数依次增大且相邻,原子核外电子数之和为31,X与Y同周期。下列判断正确的是 ( )A、原子半径: X>Y> Z B、简单氢化物的沸点: X<Y<Z C、R元素的氧化物都为黑色 D、Y、Z与R可形成既含离子键又含共价键的化合物7. 室温下,向柠檬酸(C6H8O7)溶液中滴入NaOH溶液,随着NaOH溶液的加入,所得溶液中C6H8O7、、 和的分布系数δ (x)随pH变化曲线如图所示。已知δ(x)= , 下列叙述错误的是 ( )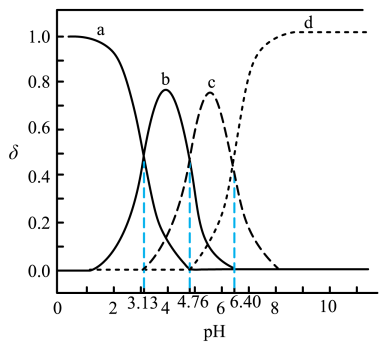 A、C6H8O7的Ka1为10−3.13 B、曲线b表示δ()随pH的变化 C、在C6H6Na2O7溶液中, ()>()>() D、pH大于6时,发生的反应主要为 +OH- = +H2O
A、C6H8O7的Ka1为10−3.13 B、曲线b表示δ()随pH的变化 C、在C6H6Na2O7溶液中, ()>()>() D、pH大于6时,发生的反应主要为 +OH- = +H2O二、非选择题
-
8. 硫酸镁在印染等工业中应用广泛。一种以硼镁泥(主要成分为MgCO3 , 还含有Ca、Fe、Al、 Mn、Si 的氧化物等成分)制取七水硫酸镁的流程如下:
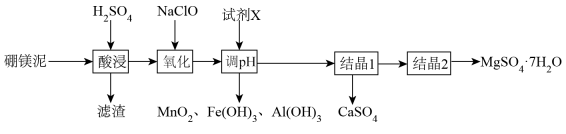
已知:本题中涉及的部分难溶电解质的溶度积如下表:
难溶电解质
Fe(OH)3
Fe(OH)2
Al(OH)3
Mg(OH)2
Ksp
4.0×10-38
8.0 ×10-16
4.6×10-33
1.8×10-11
回答下列问题:
(1)、“酸浸”中主要反应的化学方程式为 ,滤渣的成分为。(2)、“氧化” 的目的: (i)氧化Fe2+; (ii) 氧化Mn2+ , 其离子方程式为。(3)、“调pH”时,最适宜使用的X试剂是____ (填标号)。A、NH3·H2O B、NaOH C、MgO(4)、当溶液中c(Al3+)= 4.6×10 -6mol·L-1时,则所调pH=。(5)、调pH后,要继续加热再过滤出沉淀,继续加热的目的是。(6)、已知CaSO4与MgSO4在水中的溶解度随温度变化的曲线如图所示,则“结晶1”的操作为、。 9. 氧化亚铜主要用于制造船底防污漆等。它是一种难溶于水和乙醇的鲜红色固体,在酸性溶液中歧化为二价铜和铜单质。某小组制备Cu2O并测定其纯度采用如下步骤,回答下列问题:(1)、I.制备Cu2O
9. 氧化亚铜主要用于制造船底防污漆等。它是一种难溶于水和乙醇的鲜红色固体,在酸性溶液中歧化为二价铜和铜单质。某小组制备Cu2O并测定其纯度采用如下步骤,回答下列问题:(1)、I.制备Cu2O将新制Na2SO3溶液和CuSO4溶液按一定量混合, 加热至90℃并不断搅拌。反应生成Cu2O,同时有SO2气体产生。反应结束后,经过滤、洗涤、干燥得到Cu2O粉末。制备装置如图所示:

仪器a的名称是;反应采用的加热方式为。
(2)、制备Cu2O时,原料理论配比为n(Na2SO3) : n(CuSO4)=3:2,该反应的化学方程式为; 装置B的作用是。(3)、实验中,Na2SO3用量比理论用量稍高,原因是。(4)、反应中需不断滴加NaOH溶液,原因是。(5)、过滤后,将滤渣用蒸馏水、无水乙醇洗涤数次,其中用无水乙醇洗涤的目的是。(6)、Ⅱ.测定Cu2O纯度称取m g样品置于烧杯中,加入足量FeCl3溶液,完全溶解后,加入4滴邻菲罗啉指示剂,然后用c mol·L-1硫酸高铈[Ce(SO4)2]溶液进行滴定至终点,共消耗Ce(SO4)2溶液VmL。(已知: Ce4++Fe2+ = Ce3++Fe3+)
加入FeCl3溶液时发生反应的离子方程式为。
(7)、该样品中Cu2O的纯度为。10. 二氧化碳催化加氢制甲醇,有利于解决能源短缺问题,涉及的反应如下:(1)、I.主反应CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) ΔH1Ⅱ.副反应CO2(g)+ H2(g) =CO(g)+ H2O(g) ΔH2= + 41 kJ/mol
回答下列问题:
已知:
①H2(g)+O2(g) = H2O(g) ΔH = -242 kJ/mol
②CH3OH(g) +O2(g) = CO2(g) + 2H2O(g) ΔH = -677 kJ/mol
则ΔH1 =kJ/mol, 该反应在(填“低温”或“高温”)易自发进行。
(2)、关于二氧化碳催化加氢制甲醇的反应体系,下列说法正确的有____。A、平衡时,3 v(H2)正= v(CO2)逆 B、平衡后,增大压强有利于提高CH3OH的产率 C、平衡后,移去部分H2O(g), 反应I、Ⅱ的平衡常数均增大 D、选择理想的催化剂,可提高CH3OH在最终产物中的比率(3)、初始进料比n(CO2): n(H2)=1:3时,在不同温度下达到平衡,体系中CH3OH、CO的选择性和CO2的平衡转化率[ α(CO2)]与温度的关系如图所示:
已知: CH3OH的选择性=
①用各物质的平衡分压p(B)表示反应I的平衡常数表达式Kp=;
②该反应体系中的催化剂活性受温度影响变化不大。图中表示CH3OH选择性变化的曲线是 (填 “a”或“b”),其原因是。
③当T= 250℃时,H2的平衡转化率α(H2)=。
(4)、我国科学家研究Li-CO2电池取得重大科研成果。该电池放电时,CO2在正极放电的反应机理如下:(i) 2CO2+2e →
(ii)→ + CO2
(iii) + →2 +C
电池的正极反应式为。
11. 氮族元素在复合材料等领域的应用十分广泛。(1)、中科院大连化物所某研究团队开发了一种基于氮掺杂碳上的Ru单原子(Ru/NC)高稳定丙烷脱氢制丙烯催化剂。Ru/NC的合成过程如图所示。回答下列问题: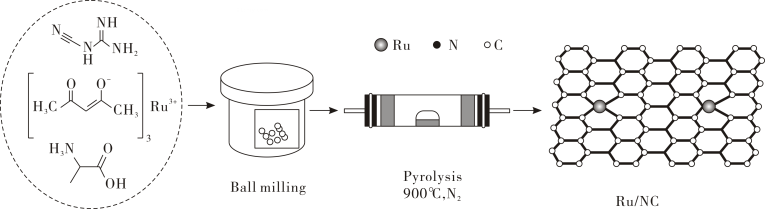
①按电子排布,氮元素位于元素周期表区, 基态氮原子的电子占据的最高能级电子云轮廓图为形。
②由图可知Ru/NC中存在(填标号)。
A.金属键 B.配位键 C. σ键 D. π键
③
 中C的杂化类型为。(2)、AsH3、 NH3、 SbH3 三种氢化物的沸点依次增大,其原因是。(3)、气态时,PCl5分子的空间结构为三角双锥形(如图所示),可溶于非极性溶剂CCl4 , 其原因是;而固态时五氯化磷不再保持三角双锥结构,其晶格中含有[PCl4]+和[PCl6]-离子,可溶于极性溶剂硝基苯,其原因是。
中C的杂化类型为。(2)、AsH3、 NH3、 SbH3 三种氢化物的沸点依次增大,其原因是。(3)、气态时,PCl5分子的空间结构为三角双锥形(如图所示),可溶于非极性溶剂CCl4 , 其原因是;而固态时五氯化磷不再保持三角双锥结构,其晶格中含有[PCl4]+和[PCl6]-离子,可溶于极性溶剂硝基苯,其原因是。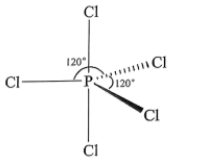 (4)、锗酸铋是重要的光学材料,由锗、铋、氧三种元素组成。 它的一种晶体属立方晶系,可表示为xGeO2·yBi2O3 , 晶胞参数a= 1014.5 pm,密度ρ= 9.22g·cm-3 , 晶胞中有两个Ge原子,则xGeO2·yBi2O3中x= , y=[列出计算式,已知Mr (GeO2)=105,Mr (Bi2O3) = 466, NA为阿伏加德罗常数的值]。12.(1)、I是合成中药丹参主要活性成分的关键化合物,它的一种合成路线如下:
(4)、锗酸铋是重要的光学材料,由锗、铋、氧三种元素组成。 它的一种晶体属立方晶系,可表示为xGeO2·yBi2O3 , 晶胞参数a= 1014.5 pm,密度ρ= 9.22g·cm-3 , 晶胞中有两个Ge原子,则xGeO2·yBi2O3中x= , y=[列出计算式,已知Mr (GeO2)=105,Mr (Bi2O3) = 466, NA为阿伏加德罗常数的值]。12.(1)、I是合成中药丹参主要活性成分的关键化合物,它的一种合成路线如下: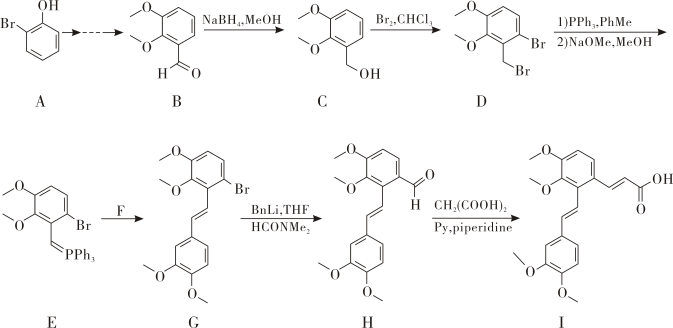
已知:
 (Ph表示苯基)
(Ph表示苯基)请回答:
A的名称是。
(2)、I的官能团的名称是。(3)、C →D的反应类型为。(4)、写出E与F反应生成G的化学方程式。(5)、写出同时满足下列条件的B的同分异构体的结构简式。(i)能发生银镜反应;
(ii) 能发生水解反应;
(iii) 核磁共振氢谱表明有4组峰且峰面积之比为6:2:1:1.
(6)、参考上述合成路线,以溴苯为原料,设计合成 (反应条件可不写)。
(反应条件可不写)。