广东省江门市2023届高三下学期第一次模拟考试化学试题
试卷更新日期:2023-05-25 类型:高考模拟
一、单选题
-
1. 很多珍贵文物都记载着中华民族的灿烂文明。下列文物主要由合金材料制成的是
选项
A
B
C
D
文物




名称
西汉青铜雁鱼灯
秦代竹简
唐代兽首玛瑙杯
秦朝兵马俑
A、A B、B C、C D、D2. “人造太阳”、墨子“传信”、超算“发威”、中国空间站、C919投运,是中国“赶上世界”的强国梦实现了历史性跨越。下列有关说法正确的是A、“人造太阳”核聚变反应堆的2H中子数为2 B、量子通信的光纤和超算“天河一号”的芯片的主要材料均为SiO2 C、火箭用液氢为燃料生成的水,水分子的空间构型为V形 D、C919民航客机材料中的复合纤维属于天然有机高分子3. 设NA为阿伏加德罗常数的值。下列说法正确的是A、标准状况下,22.4 L乙炔中σ键数为2 NA、π键数为2 NA B、0.1 mol/L KAl(SO4)2溶液中,的个数为0.2 NA C、常温常压下,7.8 g Na2O2中含有共价键的数目为0.1 NA D、18 g重水(D2O)中含有的质子数为10 NA4. 化学是以实验为基础的科学。下列实验操作或做法不能达到目的的是选项
操作或做法
目的
A
将装有NO2的注射器的活塞往外拉
探究压强对平衡移动的影响
B
常温下将铁丝插入浓硫酸中
制备SO2
C
向溶有液溴的溴苯中加入足量NaOH溶液,振荡,静置后分液
提纯溴苯
D
实验结束,将剩余白磷固体放回原试剂瓶
防止白磷自燃
A、A B、B C、C D、D5. 铁是应用最广泛的金属,在一定条件下可与水蒸气反应(装置如下图所示),下列说法错误的是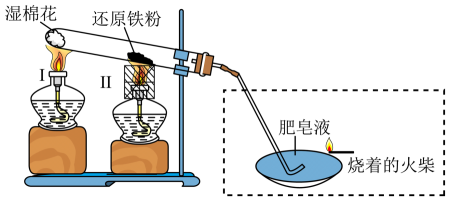 A、充分反应后,还原铁粉变成红色固体 B、湿棉花的作用是提供反应所需水蒸气 C、虚线方框中装置是为了检验反应产生的气体 D、酒精灯Ⅱ配用的金属套筒目的是聚集火焰,提高温度6. 辛勤劳动才能创造美好生活。下列劳动与所涉及的化学知识不相符的是
A、充分反应后,还原铁粉变成红色固体 B、湿棉花的作用是提供反应所需水蒸气 C、虚线方框中装置是为了检验反应产生的气体 D、酒精灯Ⅱ配用的金属套筒目的是聚集火焰,提高温度6. 辛勤劳动才能创造美好生活。下列劳动与所涉及的化学知识不相符的是选项
劳动项目
化学知识
A
社区服务:回收旧衣物并按成分进行分类
棉、麻和丝主要成分均为纤维素
B
家务劳动:柠檬煮水除去水壶中的水垢
柠檬酸可溶解碳酸钙等沉淀
C
趣味实验:氨气可制作美丽喷泉
氨气极易溶于水
D
学农活动:利用豆科植物作绿肥进行施肥
豆科植物可以实现自然固氮
A、A B、B C、C D、D7. 部分短周期元素的原子半径及主要化合价如表所示。元素
X
Y
Z
W
T
原子半径/nm
0.160
0.143
0.102
0.071
0.099
主要化合价
+2
+3
+6、-2
-1
-1
下列有关说法正确的是
A、第一电离能:X比Y小 B、简单离子半径:T>X>Y C、W的气态氢化物沸点比T气态氢化物沸点低 D、T的氧化物对应水化物的酸性一定比Z的氧化物对应水化物的酸性强8. 下列实验装置不能达到预期实验目的的是A、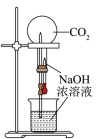 CO2做喷泉实验
B、
CO2做喷泉实验
B、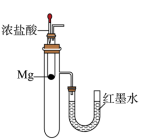 红墨水左高右低
C、
红墨水左高右低
C、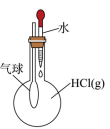 气球膨胀
D、
气球膨胀
D、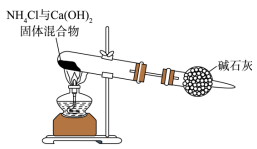 制取干燥氨气
9. 分子结构修饰在药物设计与合成中有广泛的应用。布洛芬具有抗炎、镇痛、解热作用,但口服该药对胃、肠道有刺激性,可对该分子进行如图所示的分子修饰。下列说法错误的是
制取干燥氨气
9. 分子结构修饰在药物设计与合成中有广泛的应用。布洛芬具有抗炎、镇痛、解热作用,但口服该药对胃、肠道有刺激性,可对该分子进行如图所示的分子修饰。下列说法错误的是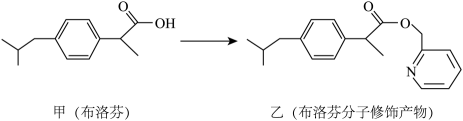 A、乙的含氧官能团是酯基 B、甲和乙都能发生氧化反应和取代反应 C、乙分子中含有两个手性碳原子 D、甲修饰成乙可降低对胃、肠道的刺激10. 下列陈述I、II正确并且有因果关系的是
A、乙的含氧官能团是酯基 B、甲和乙都能发生氧化反应和取代反应 C、乙分子中含有两个手性碳原子 D、甲修饰成乙可降低对胃、肠道的刺激10. 下列陈述I、II正确并且有因果关系的是选项
陈述I
陈述II
A
SO2和氯气都能使品红褪色
两者都有漂白性
B
Al(OH)3是两性氢氧化物
盐酸和氨水能溶解Al(OH)3
C
镁能与氮气发生反应
镁是活泼金属,有较强的还原性
D
氯化氢气体不导电,盐酸导电
两者都属于电解质
A、A B、B C、C D、D11. 在价类二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。下图中的字母分别代表硫及其常见化合物,相关推断不合理的是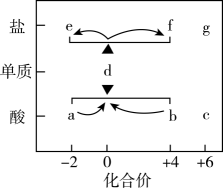 A、a溶液与b溶液反应过程中有淡黄色沉淀生成 B、硫酸型酸雨的形成过程涉及b到c的转化 C、g阴离子的中心原子的杂化轨道类型为sp3 D、d在加热下与强碱溶液反应生成e和f,且n(e):n(f)=1:212. 石墨烯是一种单层二维晶体,可利用强氧化剂在石墨层间引入大量基团(如-OH、-COOH等),以削弱层间作用力,而剥落得到氧化石墨烯。下列说法错误的是
A、a溶液与b溶液反应过程中有淡黄色沉淀生成 B、硫酸型酸雨的形成过程涉及b到c的转化 C、g阴离子的中心原子的杂化轨道类型为sp3 D、d在加热下与强碱溶液反应生成e和f,且n(e):n(f)=1:212. 石墨烯是一种单层二维晶体,可利用强氧化剂在石墨层间引入大量基团(如-OH、-COOH等),以削弱层间作用力,而剥落得到氧化石墨烯。下列说法错误的是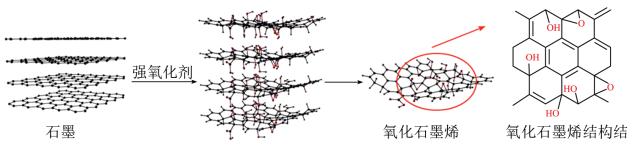 A、氧化石墨烯中C原子杂化方式与石墨相同 B、石墨中C原子个数与C-C键个数比为2:3 C、氧化石墨烯在水中的溶解度大于石墨烯 D、氧化石墨烯能够剥落,是因为削弱了石墨层与层之间的范德华力13. 原油中的硫化氢可采用电化学法处理,并制取氢气,其原理如图所示。下列说法错误的是
A、氧化石墨烯中C原子杂化方式与石墨相同 B、石墨中C原子个数与C-C键个数比为2:3 C、氧化石墨烯在水中的溶解度大于石墨烯 D、氧化石墨烯能够剥落,是因为削弱了石墨层与层之间的范德华力13. 原油中的硫化氢可采用电化学法处理,并制取氢气,其原理如图所示。下列说法错误的是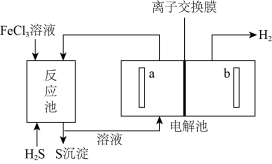 A、电解池中电极a为阳极 B、H+由电解池的左池移向右池 C、从反应池进入电解池的溶液溶质为FeCl2和HCl D、生成11.2LH2(标准状况),理论上在反应池中生成0.25molS沉淀14. 下列物质性质实验对应的反应方程式或离子方程式书写正确的是A、向稀HNO3中滴加Na2SO3溶液:+2H+=SO2↑+H2O B、用醋酸和淀粉−KI溶液检验加碘盐中的:+5I-+6H+=3I2+3H2O C、用碳酸氢钠溶液检验水杨酸中的羧基:
A、电解池中电极a为阳极 B、H+由电解池的左池移向右池 C、从反应池进入电解池的溶液溶质为FeCl2和HCl D、生成11.2LH2(标准状况),理论上在反应池中生成0.25molS沉淀14. 下列物质性质实验对应的反应方程式或离子方程式书写正确的是A、向稀HNO3中滴加Na2SO3溶液:+2H+=SO2↑+H2O B、用醋酸和淀粉−KI溶液检验加碘盐中的:+5I-+6H+=3I2+3H2O C、用碳酸氢钠溶液检验水杨酸中的羧基: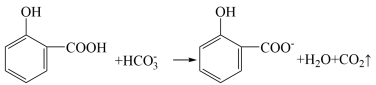 D、向NaAlO2溶液中通入过量CO2:2+CO2+3H2O=2Al(OH)3↓+
15. 偶联反应是合成芳胺的重要方法,反应机理如图(图中Ar表示芳香烃基,……→表示为副反应)。下列说法正确的是
D、向NaAlO2溶液中通入过量CO2:2+CO2+3H2O=2Al(OH)3↓+
15. 偶联反应是合成芳胺的重要方法,反应机理如图(图中Ar表示芳香烃基,……→表示为副反应)。下列说法正确的是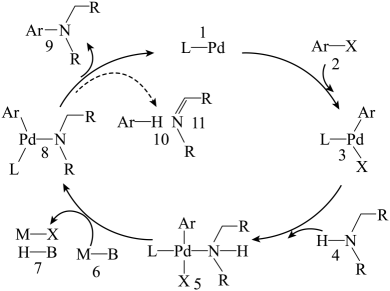 A、该体系中1、3、5和8都是中间体 B、理论上1mol
A、该体系中1、3、5和8都是中间体 B、理论上1mol 最多能消耗1mol
最多能消耗1mol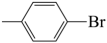 C、该变化过程中涉及到的有机反应类型仅限于取代反应
D、若原料用
C、该变化过程中涉及到的有机反应类型仅限于取代反应
D、若原料用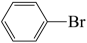 和
和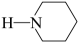 , 则可能得到的产物为
, 则可能得到的产物为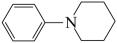 、
、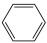 和
和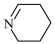 16. 一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)⇌2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:
16. 一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)⇌2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示: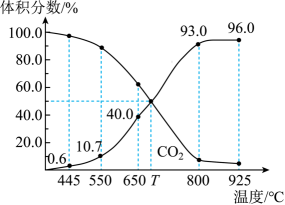
已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法错误的是
A、该反应△H>0 B、550℃时,充入惰性气体将使v正>v逆 C、650℃时,反应达平衡后CO2的转化率为25.0% D、925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0pa二、非选择题
-
17. H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。某研究性学习小组设计如图所示实验装置,探究影响H2O2分解反应速率的因素。
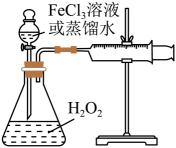 (1)、①写出锥形瓶中反应的化学方程式。
(1)、①写出锥形瓶中反应的化学方程式。②设计实验方案:在不同条件下,测定。(要求所测得的数据能直接体现反应速率大小)
(2)、探究影响H2O2分解反应速率的因素实验方案如下表所示,先向锥形瓶中加入质量分数为10%H2O2 , 再依次通过分液漏斗向锥形瓶中加入一定量的蒸馏水和FeCl3溶液,请回答问题:实验序号
10%H2O2/mL
蒸馏水/mL
0.2mol·LFeCl3溶液/mL
现象
I
10
a
0
无明显变化
II
10
b
2
锥形瓶变热,溶液迅速变红棕色,并有较多气泡产生;2min时,反应变缓,溶液颜色明显变浅
III
5
5
2
锥形瓶变热,溶液变棕色,开始5s后产生较少的气泡;2min时,反应速度加快
①表格中a= , b=。
②通过实验和(填写序号)探究浓度对反应速率影响。
(3)、实验II、III中溶液颜色变深的原因是。(4)、已知FeCl3溶液对H2O2的催化分解分为反应i和反应ii两步进行:已知反应ii的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;①反应i离子方程式为。
②某同学设计实验证明催化过程中有Fe2+产生:取2mLH2O2溶液于试管中,向试管中滴加2滴FeCl3溶液,再滴加2滴溶液,产生蓝色沉淀。
(5)、向实验II中反应后的溶液滴加KSCN溶液,溶液变红色,2min后溶液红色褪去;继续滴加KSCN溶液,溶液又变红色,一段时间后又褪色;此时再向溶液中滴加盐酸酸化后的BaCl2溶液,产生白色沉淀。请分析溶液红色褪去的原因。18. (氧化铬(Cr2O3)可用作着色剂、分析试剂、催化剂等。以含铬废料(含FeCr2O4、MgO、SiO2、Al2O3等)为原料制备氧化铬的一种流程如图所示。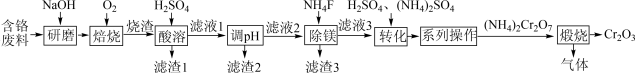
已知:烧渣的成分为Na2CrO4、NaAlO2、Na2SiO3、Fe2O3、MgO;25℃时,Ksp[Fe(OH)3]=4×10-38、Ksp[Al(OH)3]=1×10-33、Ksp[Mg(OH)2]=2×10-11 , 溶液中离子浓度≤10-5mol·L-1时,认为该离子沉淀完全。回答下列问题:
(1)、“研磨”的目的是;“焙烧”过程发生的氧化还原反应中,氧化剂与还原剂的物质的量之比是。(2)、25℃时,若滤液l中金属离子的浓度均为0.2mol·L-1 , 则“调pH”的最小值为。(保留两位有效数字)。(3)、“除镁”工序不能在陶瓷容器中进行的原因是。(4)、“转化”时加入适量H2SO4的作用是。(5)、“煅烧”反应生成的气体中含有一种单质,该反应的化学方程式。(6)、已知MgO具有NaCl型晶体结构,其结构如图所示。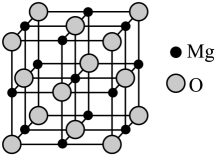
则每个Mg2+周围距离最近的Mg2+个数为。已知MgO晶胞边长为0.4nm,则MgO的密度为g/cm3(设NA为阿伏加德罗常数的值,只需列出算式)。
19. 绿水青山就是金山银山。燃烧煤的烟气含有SO2和NOx , 直接排放会造成环境污染,排放前需要进行处理。试回答下列问题:(1)、某实验小组设想利用CO还原SO2。已知S和CO的燃烧热分别是296.0kJ·mol-l、283.0kJ·mol-l , 试写出CO还原SO2生成CO2和S(s)的热化学方程式。(2)、采用Na2SO3溶液吸收法处理SO2 , 25℃时用1mol·L-1的Na2SO3溶液吸收SO2 , 当溶液pH=7时,溶液中各离子浓度的大小关系为。(已知25℃时:H2SO3的电离常数Kal=l.3×10-2 , Ka2=6.2×10-8)(3)、采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在脱硫、脱硝过程中,反应器中一直维持下列条件:温度为298K,pH=12,NaClO2溶液浓度为5×10-3mol·L-1。通入含有SO2和NO的烟气,则反应一段时间后溶液中离子浓度的分析结果如下表。离子
Cl-
c/(mol·L-1)
8.35×10-4
6.87×10-6
1.5×10-4
l.2×10-5
3.4×10-3
在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。

①写出NaClO2溶液脱硫过程中主要反应的离子方程式。脱硫、脱硝反应的△H0(填“<”“>”或“=”)。
②已知脱硝主要反应为;4NO+3+4OH-=4+3Cl-+2H2O。由实验结果可知,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是(写出其中一个原因)。欲提高烟气中NO的脱硝反应速率,可以采用的措施是(写出其中一条措施)。
③脱硝主要反应的平衡表达式为: , 其中pe(NO)为平衡分压。结合题目信息,计算298K时脱硫过程主要反应的化学平衡常数:K=(只列算式代入数据,不作运算)
(4)、如果采用Ca(ClO2)2替代NaClO2 , 能得到更好的烟气脱硫效果,其原因是。20. 维生素是维持正常生理功能的一类有机物。以下是合成某维生素部分路线: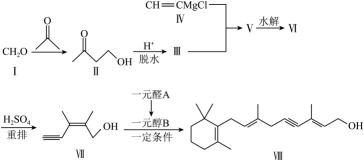
已知:
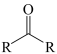
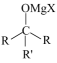
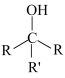 (1)、化合物Ⅶ的分子式为 , 该分子中处在同一平面的碳原子数为。(2)、分析一元醛A的结构特征,预测其可能的化学性质,完成下表
(1)、化合物Ⅶ的分子式为 , 该分子中处在同一平面的碳原子数为。(2)、分析一元醛A的结构特征,预测其可能的化学性质,完成下表序号
结构特征
反应的试剂
反应形成的新结构
反应类型
①
-CHO
Ag(NH3)2OH
②
(3)、写出由化合物Ⅲ和Ⅳ反应生成化合物V的方程式:。(4)、化合物Ⅱ的同分异构体中能发生银镜反应但不能发生水解反应的共种,其中核磁共振氢谱有3组峰,且峰面积比为6:1:1的同分异构结构简式为。(5)、聚苯乙烯树脂是一种良好的保温材料,请以苯甲醛为原料,设计路线合成其单体苯乙烯 , 其他试剂任选。