广东省惠州市2023届高三下学期第一次调研考试化学试题
试卷更新日期:2023-05-25 类型:高考模拟
一、单选题
-
1. 下列邮票内容所涉及的主要物质,属于无机化合物的是
A
B
C
D




工业合成乙烯
生产橡胶
侯氏制碱
人工合成结晶牛胰岛素
A、A B、B C、C D、D2. 孔雀石古称石绿,是铜的表生矿物[化学式 , “水色”从植物中提取,如花青(分子式)。下列说法错误的是A、“石绿”耐酸、耐碱 B、属于纯净物 C、保存不善的国画,“水色”容易变色 D、从蓝草中提取花青,可用有机溶剂萃取3. 下列文物修复和保护的过程中涉及化学变化的是A
B
C
D




复原变形金属
补配玉器缺损
青铜器除锈见新
剥离丝绸残片
A、A B、B C、C D、D4. 下列有关化学用语的表述正确的是A、乙烯的结构简式: B、乙酸的分子式: C、铝离子的结构示意图: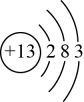 D、的电子式:
5. 为检验下列久置于空气中的物质是否变质,所选检验试剂(括号内)能达到目的的是A、新制氯水(AgNO3溶液) B、FeCl2溶液(KSCN溶液) C、漂白粉(Na2CO3溶液) D、Na2SO3溶液(BaCl2溶液)6. 勤劳致富,越努力越幸福。下列劳动项目与所述的化学知识没有关联的是
D、的电子式:
5. 为检验下列久置于空气中的物质是否变质,所选检验试剂(括号内)能达到目的的是A、新制氯水(AgNO3溶液) B、FeCl2溶液(KSCN溶液) C、漂白粉(Na2CO3溶液) D、Na2SO3溶液(BaCl2溶液)6. 勤劳致富,越努力越幸福。下列劳动项目与所述的化学知识没有关联的是选项
劳动项目
化学知识
A
明矾净水
明矾具有氧化性
B
小苏打用作发泡剂烘焙面包
小苏打受热分解产生气体
C
用热的纯碱溶液洗去油污
热的纯碱溶液水解显碱性
D
用厨余垃圾制肥料
厨余垃圾含N、P等元素
A、A B、B C、C D、D7. X、Y、Z、W为短周期元素,它们在周期表的位置如图所示,Y原子的最外层电子数是次外层电子数的3倍。下列说法中正确的是X
Y
Z
W
A、X的单质中键和键个数之比为1∶1 B、Y和Z只能组成一种化合物 C、Z的氧化物的晶体属于分子晶体 D、最高价氧化物对应水化物的酸性:Z>W8. 下列有关实验操作正确的是A、点燃酒精灯 B、称量10.05g固体
B、称量10.05g固体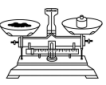 C、检查容量瓶是否漏水
C、检查容量瓶是否漏水 D、稀释浓硫酸
D、稀释浓硫酸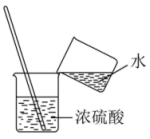 9. 设NA为阿伏加德罗常数的值。下列说法正确的是A、固体中含有的离子数目为 B、标况下所含的分子数为 C、一定条件下,与足量的反应,转移的电子数为 D、溶液中含有的氧原子数为10. 下列有关微粒性质的排列顺序中,错误的是A、元素的电负性:P<O<F B、元素的第一电离能:C<N<O C、离子半径: D、原子的未成对电子数:P>S>Cl11. 水合肼(N2H4·H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,其制备的反应原理为NaClO+2NH3=N2H4·H2O+NaCl。下列关于实验室制备水合肼的操作不正确的是( )
9. 设NA为阿伏加德罗常数的值。下列说法正确的是A、固体中含有的离子数目为 B、标况下所含的分子数为 C、一定条件下,与足量的反应,转移的电子数为 D、溶液中含有的氧原子数为10. 下列有关微粒性质的排列顺序中,错误的是A、元素的电负性:P<O<F B、元素的第一电离能:C<N<O C、离子半径: D、原子的未成对电子数:P>S>Cl11. 水合肼(N2H4·H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,其制备的反应原理为NaClO+2NH3=N2H4·H2O+NaCl。下列关于实验室制备水合肼的操作不正确的是( )甲
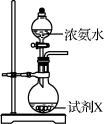 乙
乙 丙
丙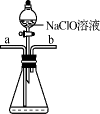 丁
丁 A、装置甲中试剂X可以选择生石灰 B、装置乙作为反应过程的安全瓶 C、装置丙制备水合肼时氨气从b口进入 D、装置丁可用于吸收多余的尾气12. 电解法制取Na2FeO4的总反应为 , 工作原理如图所示。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。下列叙述正确的是
A、装置甲中试剂X可以选择生石灰 B、装置乙作为反应过程的安全瓶 C、装置丙制备水合肼时氨气从b口进入 D、装置丁可用于吸收多余的尾气12. 电解法制取Na2FeO4的总反应为 , 工作原理如图所示。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。下列叙述正确的是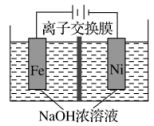 A、铁电极做阳极,发生还原反应 B、Ni电极发生的反应为: C、通电后Na+向右移动,阴极区Na+浓度增大 D、当电路中通过1 mol电子时,阴极区有11.2 L H2生成13. 在体积为1 L的恒容密闭容器中充入1 mol CO2和3 mol H2 , 一定条件下反应: 。测得CO2和H2的浓度随时间变化如图所示。下列说法正确的是
A、铁电极做阳极,发生还原反应 B、Ni电极发生的反应为: C、通电后Na+向右移动,阴极区Na+浓度增大 D、当电路中通过1 mol电子时,阴极区有11.2 L H2生成13. 在体积为1 L的恒容密闭容器中充入1 mol CO2和3 mol H2 , 一定条件下反应: 。测得CO2和H2的浓度随时间变化如图所示。下列说法正确的是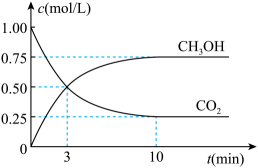 A、平衡时的转化率为75% B、平衡后充入惰性气体,平衡向正向移动 C、该条件下,第9 min时大于第3 min时 D、混合气体的密度不随时间的变化而变化,则说明上述反应达到平衡状态14. 下列有关铁及其化合物转化过程中的离子方程式书写正确的是A、氧化亚铁溶于稀硝酸: B、铁溶于盐酸: C、醋酸除铁锈: D、三氯化铁腐蚀铜板:15. 关于下列转化过程分析不正确的是
A、平衡时的转化率为75% B、平衡后充入惰性气体,平衡向正向移动 C、该条件下,第9 min时大于第3 min时 D、混合气体的密度不随时间的变化而变化,则说明上述反应达到平衡状态14. 下列有关铁及其化合物转化过程中的离子方程式书写正确的是A、氧化亚铁溶于稀硝酸: B、铁溶于盐酸: C、醋酸除铁锈: D、三氯化铁腐蚀铜板:15. 关于下列转化过程分析不正确的是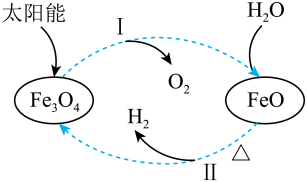 A、中Fe元素的化合价为+2、+3 B、该转化过程中FeO和均做催化剂 C、过程Ⅱ的化学方程式为: D、该过程的总反应为:16. 热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,此时硫酸铅电极处生成Pb。下列有关说法正确的是
A、中Fe元素的化合价为+2、+3 B、该转化过程中FeO和均做催化剂 C、过程Ⅱ的化学方程式为: D、该过程的总反应为:16. 热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,此时硫酸铅电极处生成Pb。下列有关说法正确的是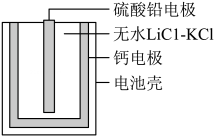 A、输出电能时,外电路中的电子由硫酸铅电极流向钙电极 B、放电时电解质LiCl-KCl中的Li+向钙电极区迁移 C、电池总反应为Ca+PbSO4+2LiCl=Pb+Li2SO4+CaCl2 D、每转移0.2 mol电子,理论上消耗42.5 g LiCl
A、输出电能时,外电路中的电子由硫酸铅电极流向钙电极 B、放电时电解质LiCl-KCl中的Li+向钙电极区迁移 C、电池总反应为Ca+PbSO4+2LiCl=Pb+Li2SO4+CaCl2 D、每转移0.2 mol电子,理论上消耗42.5 g LiCl二、非选择题
-
17. 某化学小组同学发现“84”消毒液(主要成分为NaClO)与洁厕剂(主要成分为盐酸)室温下混合有生成,于是尝试在实验室利用该反应原理制取。
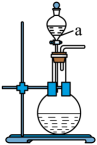 (1)、若用次氯酸钙、浓盐酸为原料,利用上图装置制取。装置中仪器a的名称为 , 反应的化学方程式为。(2)、实验室制取干燥的时,净化与收集所需装置的接口连接顺序为。
(1)、若用次氯酸钙、浓盐酸为原料,利用上图装置制取。装置中仪器a的名称为 , 反应的化学方程式为。(2)、实验室制取干燥的时,净化与收集所需装置的接口连接顺序为。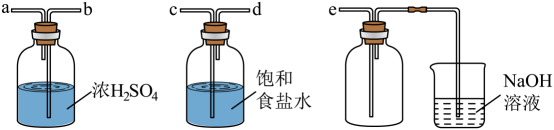 (3)、经查阅资料得知:无水在空气中易潮解,加热易升华。设计如图所示装置制备无水。
(3)、经查阅资料得知:无水在空气中易潮解,加热易升华。设计如图所示装置制备无水。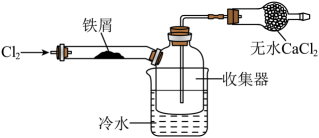
①下列操作步骤的正确顺序为(填字母)。
a.体系冷却后,停止通入 b.通入干燥的赶尽装置中的空气
c.在铁屑下方加热至反应完成 d.用干燥的赶尽
e.检验装置的气密性
②该实验装置存在的明显缺陷是。
(4)、世界环保联盟要求逐渐取代作为自来水消毒剂。已知: , 。
有关物质的熔、沸点如下表:
物质
熔点/℃
沸点/℃
-59
11
-107
-34.6
的生产流程示意图如下:

该工艺中,需要补充的物质X为(填化学式,下同),能参与循环的物质是。从发生器中分离出 , 可采用的方法是。
18. 利用硫酸烧渣(主要含、FeO,还含有和CuO等)来制取溶液。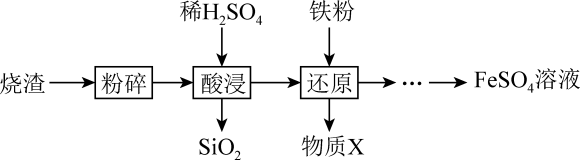 (1)、①将硫酸烧渣进行粉碎,其目的是。
(1)、①将硫酸烧渣进行粉碎,其目的是。②“酸浸”时,发生反应的离子方程式是。
(2)、“还原”时,铁粉将、还原为和Cu。检验是否已全部被还原,所选用试剂的化学式是。(3)、将得到的溶液进行下列操作,测定其物质的量浓度:步骤一:取溶液,将其稀释成100.00mL溶液。
步骤二:取25.00mL稀释后的溶液,向其中加入酸性溶液。恰好反应时,记下消耗溶液的体积。
步骤三:重复上述实验3次,平均消耗溶液20.00mL。
已知:(未配平)
①配平上述方程式。
②“步骤一”中稀释时所用的水需先进行加热煮沸,其目的是。
③试通过计算,求原溶液的物质的量浓度是多少?(写出计算过程)
19. 2021年,我国科学家以二氧化碳为原料,通过全合成方法成功制得了淀粉,取得了科技领域的一个重大突破。以为原料制备甲醇、合成气、淀粉等能源物质具有广阔的发展前景。在催化剂的作用下,氢气还原的过程中可同时发生反应①②。
①
②
(1)、。(2)、已知时,反应能自发进行反应,反应①的 , 则反应①自发进行的温度不超过K(保留一位小数)。(3)、在恒温恒容密闭容器中,充入一定量的及 , 起始及达到平衡时,容器内各气体的物质的量及总压强数据如表所示:总压/
起始
0.5
0.9
0
0
0
平衡
m
0.3
p
已知 , 则表中;反应①的平衡常数(用含p的代数式表示),为压强平衡常数,是在化学平衡体系中,用各气体物质的分压替代浓度计算的平衡常数。
(4)、向恒压反应器中通入和 , 的平衡转化率及的平衡产率随温度变化的关系如图所示。已知:的产率。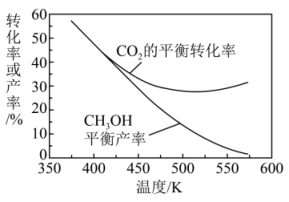
图中500K以后,的平衡转化率随温度升高而增大的原因是。
(5)、的综合利用有利于“碳中和”,分子在晶体中的堆积方式如图所示,该晶体面心立方最密堆积结构,晶胞边长为apm,则该晶体的密度(列出计算式,设为阿伏加德罗常数)。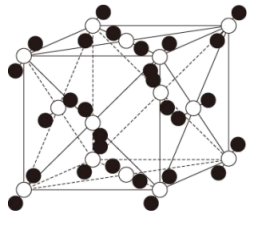 (6)、温室气体的用途广泛,请写出一种与其物理性质相关的用途:。20. W是一种高分子功能材料,在生产、生活中有广泛应用。一种合成W的路线如图。
(6)、温室气体的用途广泛,请写出一种与其物理性质相关的用途:。20. W是一种高分子功能材料,在生产、生活中有广泛应用。一种合成W的路线如图。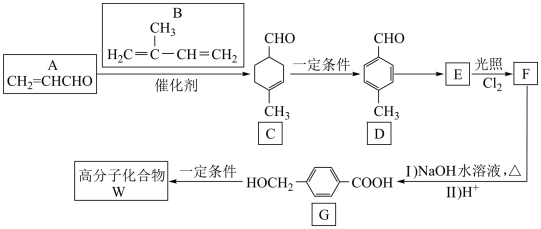
已知:

请回答下列问题:
(1)、D的名称是。G中官能团名称是。(2)、已知E的分子式为C8H8O2 , F的结构简式为。(3)、G→W的化学方程式为。(4)、M是G的同分异构体,同时满足下列条件的结构有种(不考虑立体异构)。①遇氯化铁溶液能发生显色反应;②能与NaHCO3反应产生气体。
其中核磁共振氢谱上有5组峰且峰的面积比为1∶2∶2∶2∶1的结构简式为。
(5)、设计以2,3-二氯丁烷( )、丙烯醛(CH2=CHCHO)为原料合成苯甲醛的合成路线(无机试剂任选)。
)、丙烯醛(CH2=CHCHO)为原料合成苯甲醛的合成路线(无机试剂任选)。