广东省佛山市2023届普通高中教学质量检测(二)化学试题
试卷更新日期:2023-05-25 类型:高考模拟
一、单选题
-
1. 起源于西汉的丝绸之路是最早的东西方文明交流通道。下列商品主要成分是无机非金属材料的是
商品




选项
A.玉器
B.丝绸
C.铁器
D.纸张
A、A B、B C、C D、D2. 党的二十大报告指出我国已进入创新型国家行列。下列说法正确的是A、“华龙一号”核电机组使用的氦气不存在分子 B、“奋斗者号”潜水器含钛合金,其强度、韧性高于纯钛金属 C、“祖冲之二号”中的半导体存储器主要成分为 D、“嫦娥五号”带回的月壤中含有磁铁矿,其主要成分为3. 硫化钠法制备涉及的化学反应为:。下列说法正确的是A、的电子式为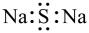 B、的空间构型为平面三角形
C、可用作还原剂
D、该反应可以说明非金属性:S>C
4. 对乙酰氨基酚是一种用于治疗疼痛与发热的药物,可用于缓解轻度至中度的疼痛,其结构如图所示。关于对乙酰氨基酚的说法错误的是
B、的空间构型为平面三角形
C、可用作还原剂
D、该反应可以说明非金属性:S>C
4. 对乙酰氨基酚是一种用于治疗疼痛与发热的药物,可用于缓解轻度至中度的疼痛,其结构如图所示。关于对乙酰氨基酚的说法错误的是 A、含有羟基、酮羰基、氨基三种官能团 B、分子中所有原子不可能共平面 C、1mol该有机物最多能与2mol NaOH发生反应 D、可发生取代反应、氧化反应、加成反应5. 对乙酰氨基酚是一种用于治疗疼痛与发热的药物,可用于缓解轻度至中度的疼痛,其结构如图所示。基于结构视角,下列说法正确的是
A、含有羟基、酮羰基、氨基三种官能团 B、分子中所有原子不可能共平面 C、1mol该有机物最多能与2mol NaOH发生反应 D、可发生取代反应、氧化反应、加成反应5. 对乙酰氨基酚是一种用于治疗疼痛与发热的药物,可用于缓解轻度至中度的疼痛,其结构如图所示。基于结构视角,下列说法正确的是 A、所有C原子的杂化方式均相同 B、所含元素的第一电离能:O>N>C C、该分子能与水形成分子间氢键 D、O的价层电子轨道表示式:6. 氯元素的单质及化合物之间可互相转化。下列反应的离子方程式书写错误的是A、单质转化为两种盐: B、盐转化为酸: C、酸转化为单质和盐: D、两种盐转化为单质:7. 模拟从海水中提取镁的实验装置、操作及目的如图所示,能达到实验目的的是
A、所有C原子的杂化方式均相同 B、所含元素的第一电离能:O>N>C C、该分子能与水形成分子间氢键 D、O的价层电子轨道表示式:6. 氯元素的单质及化合物之间可互相转化。下列反应的离子方程式书写错误的是A、单质转化为两种盐: B、盐转化为酸: C、酸转化为单质和盐: D、两种盐转化为单质:7. 模拟从海水中提取镁的实验装置、操作及目的如图所示,能达到实验目的的是选项
A
B
C
D
装置




操作及目的
煅烧贝壳至900℃,得到生石灰
浓缩海水,加生石灰反应后过滤,得到
蒸发溶液,得到无水
电解溶液,制备金属Mg
A、A B、B C、C D、D8. 绿矾()分解可制备铁红,同时产生、和。设NA为阿伏加德罗常数的值,下列说法错误的是A、溶液含有的阳离子数大于NA B、0.5mol三聚分子(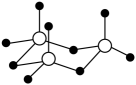 )中含有σ键数目为6 NA
C、绿矾分解生成16g时,转移电子数为0.2 NA
D、22.4L溶于水,溶液中、、的数目总和为NA
9. 卤代烃的水解反应常伴随消去反应的发生。溴乙烷与NaOH水溶液共热一段时间后,下列实验设计能达到对应目的的是A、观察反应后溶液的分层现象,检验溴乙烷是否完全反应 B、取反应后溶液滴加溶液,检验是否有生成 C、取反应后溶液加入一小块金属Na,检验是否有乙醇生成 D、将产生的气体通入酸性溶液,检验是否有乙烯生成10. 工业上利用含铅废渣(主要成分为)制备碱式硫酸铅()的简易流程如图所示。下列说法错误的是
)中含有σ键数目为6 NA
C、绿矾分解生成16g时,转移电子数为0.2 NA
D、22.4L溶于水,溶液中、、的数目总和为NA
9. 卤代烃的水解反应常伴随消去反应的发生。溴乙烷与NaOH水溶液共热一段时间后,下列实验设计能达到对应目的的是A、观察反应后溶液的分层现象,检验溴乙烷是否完全反应 B、取反应后溶液滴加溶液,检验是否有生成 C、取反应后溶液加入一小块金属Na,检验是否有乙醇生成 D、将产生的气体通入酸性溶液,检验是否有乙烯生成10. 工业上利用含铅废渣(主要成分为)制备碱式硫酸铅()的简易流程如图所示。下列说法错误的是 A、“转化”过程生成的气体为 B、由流程可推测, C、该工艺中滤液2可循环利用 D、该流程发生了氧化还原反应11. 离子液体是室温下呈液态的离子化合物。由原子序数依次增大的短周期主族元素X、Y、Z、W、R组成的一种离子液体的结构如图所示,W的简单氢化物易液化,可用作制冷剂,R的简单阴离子含10个电子。下列说法正确的是
A、“转化”过程生成的气体为 B、由流程可推测, C、该工艺中滤液2可循环利用 D、该流程发生了氧化还原反应11. 离子液体是室温下呈液态的离子化合物。由原子序数依次增大的短周期主族元素X、Y、Z、W、R组成的一种离子液体的结构如图所示,W的简单氢化物易液化,可用作制冷剂,R的简单阴离子含10个电子。下列说法正确的是 A、电负性:R>X>Z B、氢化物的沸点:R>Z C、分子YR3的空间构型为三角锥形 D、最高价含氧酸的酸性:W>Z12. 在催化剂作用下,向容积为1L的容器中加入1molX和3molY,发生反应: , 平衡时和反应10min时X的转化率(X)随温度的变化分别如曲线I、Ⅱ所示。下列说法错误的是
A、电负性:R>X>Z B、氢化物的沸点:R>Z C、分子YR3的空间构型为三角锥形 D、最高价含氧酸的酸性:W>Z12. 在催化剂作用下,向容积为1L的容器中加入1molX和3molY,发生反应: , 平衡时和反应10min时X的转化率(X)随温度的变化分别如曲线I、Ⅱ所示。下列说法错误的是 A、该反应 B、200℃时,前10min的平均反应速率 C、400℃时,反应的平衡常数K=2 D、bc段变化可能是催化剂在温度高于400℃时活性降低导致13. 电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。常温下,的电离常数 , , 利用盐酸滴定某溶液中的含量,其电位滴定曲线与pH曲线如图所示。下列说法正确的是
A、该反应 B、200℃时,前10min的平均反应速率 C、400℃时,反应的平衡常数K=2 D、bc段变化可能是催化剂在温度高于400℃时活性降低导致13. 电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。常温下,的电离常数 , , 利用盐酸滴定某溶液中的含量,其电位滴定曲线与pH曲线如图所示。下列说法正确的是
(注:−表示电极电位曲线;…表示pH曲线)
A、该滴定过程需要加入酸碱指示剂 B、水的电离程度:a<b C、a点溶液中 D、b点溶液中存在:14. 过硫酸铵可用作氧化剂、漂白剂。利用电解法在两极分别生产过硫酸铵和过氧化氢的装置如图所示。下列说法错误的是 A、a为外接电源的负极 B、电解总反应: C、阴离子交换膜可用阳离子交换膜替代 D、电解池工作时,I室溶液质量理论上逐渐减小
A、a为外接电源的负极 B、电解总反应: C、阴离子交换膜可用阳离子交换膜替代 D、电解池工作时,I室溶液质量理论上逐渐减小二、非选择题
-
15. 利用电极反应可探究物质氧化性、还原性的变化规律。
已知:酸性介质中,1mol/L不同电对的电极电势见下表。电极电势越高,其氧化型物质的氧化性越强;电极电势越低,其还原型物质的还原性越强。
电对(氧化型/还原型)
电极电势/V
0.771
1.776
0.695
1.224
0.536
回答下列问题:
(1)、I.探究的分解反应催化分解反应过程包括i、ii两步:
反应i: (未配平)
反应ii:
反应i的离子方程式为。
(2)、验证生成:反应过程中,加入溶液,产生蓝色沉淀,证明有生成。(3)、酸性条件下也可催化分解。结合表中数据判断,上述条件下、、的氧化性由强到弱的顺序为。(4)、Ⅱ.探究物质氧化性变化对电化学反应方向的影响用可逆反应设计电池,按图a装置进行实验,测得电压E()随时间t的变化如图b所示:

电池初始工作时,正极的电极反应式为。
(5)、某小组从还原型物质浓度、氧化性变化的角度分析图b,提出以下猜想:猜想1:增大,的氧化性减弱,正极的电极电势降低。
猜想2:减小,的氧化性增强,负极的电极电势升高。
①时间后,按图a装置探究,验证上述猜想的合理性,完成表中填空。
实验
实验操作
电压E/V
结论
i
往烧杯A中加入适量Fe
E0
猜想1成立
ii
往烧杯B中加入适量
E<0
猜想2成立
②有同学认为,上述实验不足以证明猜想1成立。利用上述反应,从化学平衡移动的角度解释猜想1不足以成立的理由。
③为进一步验证猜想1,进行实验Ⅱi,完成表中填空。
实验
实验操作
电压E/V
结论
iii
往烧杯A中加入适量
E<0
猜想1成立
结论:可逆氧化还原反应中,浓度的变化引起电对氧化性变化,从而改变电池反应方向。
16. 分铜液净化渣主要含铜、碲(Te)、锑(Sb)、砷(As)等元素的化合物,一种回收工艺流程如图所示:
已知:①“碱浸”时,铜、锑转化为难溶氢氧化物或氧化物,碱浸液含有、。
②“酸浸”时,锑元素反应生成难溶的浸渣。
回答下列问题:
(1)、As位于第四周期VA族,基态As的价层电子排布式为。(2)、“碱浸”时,与NaOH反应的离子方程式为。(3)、向碱浸液加入盐酸调节pH=4,有析出,分离出的操作是。滤液中As元素最主要的存在形式为(常温下,的各级电离常数为:、、)。A. B. C. D.
(4)、①中,Sb的化合价为。②“氯盐酸浸”时,通入的目的是。
(5)、“水解”时,生成SbOCl的化学方程式为。(6)、可用作电子元件材料,熔点为733℃,其熔点远高于的原因为。晶胞是长方体结构(如图所示),碲的配位数为。已知为阿伏加德罗常数的值,则该晶体的密度为(列出计算表达式) 17. 工业利用、催化合成氨实现了人类“向空气中要面包”的梦想。(1)、原料气(含、、CO)中的CO能被催化剂吸附,需经过铜氨液处理除去,反应为: 。
17. 工业利用、催化合成氨实现了人类“向空气中要面包”的梦想。(1)、原料气(含、、CO)中的CO能被催化剂吸附,需经过铜氨液处理除去,反应为: 。①除去原料气中CO的理由是。
②为提高CO吸收率,应选择的条件为。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
③中的配体为
(2)、研究发现铁催化剂表面上合成氨的反应历程如图所示,其中吸附在铁催化剂表面上的物种用*标注。
①该反应历程中最大活化能对应步骤的化学方程式为。合成氨反应:的(用图中字母表示)。
②铁催化合成氨时与需吸附在催化剂表面活性位点进行反应,由合成氨反应的速率方程(k为速率常数)可知,越大,反应速率越小。原因是。
(3)、反应的标准平衡常数可表达为: , 其中为标准压强(0.1MPa),、和分别为各组分的平衡分压(分压=总压×物质的量分数)。若和起始物质的量之比为1∶3,反应在恒温、恒压(10MPa)下进行,平衡时转化率为50%,则(写出计算过程,结果保留两位有效数字)。18. 有机物IX是重要药物中间体,其合成路线如图所示:
回答下列问题:
(1)、I的分子式为。(2)、反应①、⑤的反应类型分别为、。(3)、Ⅴ的结构简式为。(4)、Ⅶ可与新制发生反应,其化学反应方程式为。(5)、由反应④~⑦可推测的作用为。(6)、同时满足以下条件的Ⅲ的同分异构体有种。①含有苯环,能使溶液显色:
②核磁共振氢谱中有6个化学环境相同的氢原子。
写出核磁共振氢谱中峰面积为6:2:1:1的同分异构体的结构简式(任写一种)。
(7)、参照上述信息和所学知识,将下列合成路线补充完整