北京市门头沟区2023届高三下学期一模考试化学试题
试卷更新日期:2023-05-25 类型:高考模拟
一、单选题
-
1. 北京冬奥会成功举办、“天宫课堂”授课、神舟十五号载人飞船发射成功、及“C919”飞机等,均展示了国科技发展的巨大成就。下列相关叙述正确的是A、冬奥会“飞扬”火炬所用的燃料H2为氧化性气体 B、乙酸钠过饱和溶液析出结晶水合物属于化学变化 C、载人飞船采用了太阳能刚性电池阵,将化学能转化为电能供飞船使用 D、“C919”飞机机身使用的材料碳纤维属于新型无机非金属材料2. 下列化学用语或图示表达不正确的是A、氯化钙的电子式:
 B、基态C原子的轨道表示式:
B、基态C原子的轨道表示式: C、顺-2-丁烯的分子结构模型:
C、顺-2-丁烯的分子结构模型: D、Cl-Cl的p-pσ键电子云图形:
D、Cl-Cl的p-pσ键电子云图形: 3. 我国发布了《医用同位素中长期发展规划(2021-2035年)》,对提升医用同位素相关产业能力水平、保障健康中国战略实施具有重要意义。医用同位素有14C、18F、 131I、60Co等,有关说法不正确的是A、60Co位于元素周期表的第四周期第VIII族 B、18F和131I的最外层电子数相同 C、14C与12C的化学性质几乎相同 D、化合物23Na18F的中子总数为414. 下列方程式与所提供的事实不相符的是A、向氯水中通入SO2 , 溶液褪色:SO2 + Cl2 + 2H2O = 2HCl + H2SO4 B、向NaHCO3溶液中滴入少量酚酞溶液,溶液变为浅红色:HCO CO+ H+ C、实验室制取氨气:2NH4Cl + Ca(OH)2 2NH3↑+ CaCl2 + 2H2O D、少量铁粉与稀硝酸反应:Fe + 4H++ NO= Fe3+ + NO↑+ 2H2O5. 下图所示的实验,不能达到实验目的的是
3. 我国发布了《医用同位素中长期发展规划(2021-2035年)》,对提升医用同位素相关产业能力水平、保障健康中国战略实施具有重要意义。医用同位素有14C、18F、 131I、60Co等,有关说法不正确的是A、60Co位于元素周期表的第四周期第VIII族 B、18F和131I的最外层电子数相同 C、14C与12C的化学性质几乎相同 D、化合物23Na18F的中子总数为414. 下列方程式与所提供的事实不相符的是A、向氯水中通入SO2 , 溶液褪色:SO2 + Cl2 + 2H2O = 2HCl + H2SO4 B、向NaHCO3溶液中滴入少量酚酞溶液,溶液变为浅红色:HCO CO+ H+ C、实验室制取氨气:2NH4Cl + Ca(OH)2 2NH3↑+ CaCl2 + 2H2O D、少量铁粉与稀硝酸反应:Fe + 4H++ NO= Fe3+ + NO↑+ 2H2O5. 下图所示的实验,不能达到实验目的的是A
B
C
D




比较Fe3+的催化效果好于Cu2+
用溴水检验CH3CH2Br与NaOH乙醇溶液生成的乙烯
验证铁发生吸氧腐蚀
实验室制Cl2时,除去Cl2中的HCl并干燥
A、A B、B C、C D、D6. 2022年诺贝尔化学奖授予了对点击化学和生物正交化学做出贡献的科学家。点击化学的代表反应为铜([Cu])催化的叠氮−炔基Husigen成环反应,其原理如下图。
下列说法不正确的是
A、上述循环中H+ 是中间产物之一 B、上述循环过程中只有极性键的断裂和形成 C、Cu能降低反应的活化能,但不改变总反应的焓变 D、中间产物 中N采取sp2、杂化
7. 我国科学家突破了二氧化碳人工合成淀粉的技术,部分核心反应如下图。
中N采取sp2、杂化
7. 我国科学家突破了二氧化碳人工合成淀粉的技术,部分核心反应如下图。
设NA为阿伏加德罗常数的值,下列有关说法正确的是
A、DHA难溶于水,易溶于有机溶剂 B、DHA与葡萄糖具有相同种类的官能团 C、3.0 g HCHO与DHA的混合物中含碳原子数为0.1 NA D、淀粉属于有机高分子,可溶于冷水,可水解生成乙醇8. 北京化工大学研究团队首次实现了利用微生物生产非天然产物对乙酰氨基酚,又称扑热息痛,是镇痛和治疗发热的主要药物之一、下列关于对乙酰氨基酚的说法不正确的是 A、分子式为C8H10NO2 B、遇FeCl3溶液显紫色 C、既能与氢氧化钠溶液反应,又能与盐酸反应 D、对乙酰氨基酚与甲醛在一定条件下可以发生反应9. 下列事实不能依据键能大小解释的是A、熔点:HF >HCl B、活泼性:N2 < P4 C、热稳定性:CH4 > SiH4 D、硬度:金刚石 > 晶体硅10. D是一种具有交联结构的吸附性高分子材料,其部分合成路线如下图。
A、分子式为C8H10NO2 B、遇FeCl3溶液显紫色 C、既能与氢氧化钠溶液反应,又能与盐酸反应 D、对乙酰氨基酚与甲醛在一定条件下可以发生反应9. 下列事实不能依据键能大小解释的是A、熔点:HF >HCl B、活泼性:N2 < P4 C、热稳定性:CH4 > SiH4 D、硬度:金刚石 > 晶体硅10. D是一种具有交联结构的吸附性高分子材料,其部分合成路线如下图。
下列说法不正确的是
A、A,B,C 生成D的反应是加聚反应 B、C中的核磁共振氢谱图吸收峰面积之比为2:1:1:1 C、D在碱性条件下水解可以生成NH3 D、生成 1mol D 参与反应的A,B 物质的量之比为1:111. 二氧化氯(ClO2 , 黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备ClO2的原理如下图。
下列说法正确的是
A、a极与电源的负极连接 B、X溶液显碱性,在b极区流出的Y溶液是浓盐酸 C、电解池a极上发生的电极反应为 NH-6e- + 3Cl- + 4OH- =NCl3+ 4H2O D、ClO2发生器内发生的氧化还原反应中,生成的ClO2与NH3的物质的量之比为6:112. 为探究FeCl3的性质,进行了如下实验(FeCl3和Na2SO3溶液浓度均为0.1mol·L−1)。实验
操作与现象
①
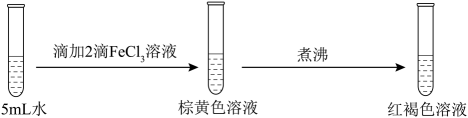
②
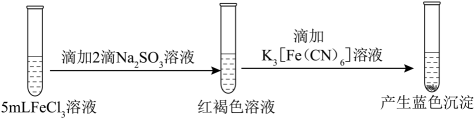
③
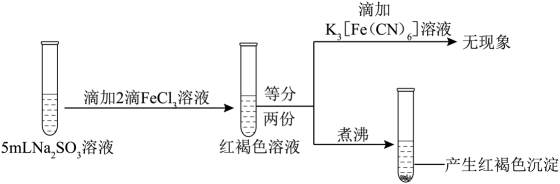
分析上述实验现象,所得结论不合理的是
A、实验①说明加热促进Fe3+水解反应 B、实验②说明Fe3+ 既发生了水解反应,又发生了还原反应 C、实验③说明Fe3+ 发生了水解反应,但没有发生还原反应 D、实验①-③说明SO对Fe3+ 的水解反应无影响,但对还原反应有影响13. 实验测得0.10 mol·L−1 NaHCO3溶液的pH随温度变化如下图。
下列说法正确的是
A、OM段随温度升高溶液的pH减小,原因是HCO水解被抑制 B、O点溶液和P点溶液中c(OH-)相等 C、将N点溶液恢复到25℃,pH可能大于8.62 D、Q点、M点溶液中均有:c(CO) + c(HCO) + c(OH-) = c(Na+) + c(H+)14. 在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法不正确的是 A、反应2NO(g)+O2(g)2NO2(g)的△H<0 B、图中X点所示条件下,延长反应时间能提高NO转化率 C、图中Y点所示条件下,增加O2的浓度不能提高NO转化率 D、380℃下,c起始(O2)=5.0×10-4mol/L,NO平衡转化率为50%,则平衡常数K>2000
A、反应2NO(g)+O2(g)2NO2(g)的△H<0 B、图中X点所示条件下,延长反应时间能提高NO转化率 C、图中Y点所示条件下,增加O2的浓度不能提高NO转化率 D、380℃下,c起始(O2)=5.0×10-4mol/L,NO平衡转化率为50%,则平衡常数K>2000二、非选择题
-
15. 铁(26Fe)、镍(28Ni)的单质及其化合物在医药、材料等领域有广泛的应用。回答下列问题:(1)、基态Fe原子核外电子排布式为 , Ni位于元素周期表的区。(2)、乳酸亚铁口服液是缺铁人群补铁保健品,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+ , 从结构角度分析,Fe2+易被氧化成Fe3+的原因是。(3)、FeCl3常用作净水剂、刻蚀剂等。
① FeCl3的熔点(306℃)显著低于FeF3的熔点(1000℃)的原因是。
② FeCl3水溶液中Fe3+可水解生成双核阳离子[Fe2(H2O)8(OH)2]4+ , 结构如下图,解释能够形成双核阳离子的原因:。
 (4)、镍白铜(铜镍合金)常用作海洋工程应用材料。某镍白铜合金的晶胞结构如图所示。
(4)、镍白铜(铜镍合金)常用作海洋工程应用材料。某镍白铜合金的晶胞结构如图所示。
① 晶胞中铜原子与镍原子的原子个数比为 。
②已知一定条件下晶胞的棱长为a cm,用NA表示阿伏加德罗常数的值,在该条件下该晶体的摩尔体积为 m3·mol-1(用含a, NA的代数式表示)。
16. 减少NOx、CO2的排放,实现资源化利用是化学工作者研究的重要课题。(1)、尿素水解生成的NH3催化还原NO是重要的烟气脱硝技术,且为可逆过程。反应过程与能量关系如图1,在以Fe2O3为主的催化剂表面可能发生的反应过程如图2。
① NH3催化还原NO为(填“放热”“吸热”)反应。
② 上述脱硝的总反应化学方程式为:。
(2)、电厂烟气脱氮的反应为:4NH3(g) + 6NO(g) 5N2(g) + 6H2O(g) ΔH<0,现向某2 L密闭容器中分别投入一定量的NH3、NO发生以上反应,其他条件相同时,在甲、乙两种催化剂的作用下,相同时间内NO的转化率与温度的关系如图3。工业上应选择催化剂(填“甲”或“乙”)。 在催化剂甲的作用下,温度高于210℃时, NO转化率降低的可能原因是。 (3)、工业以NH3和CO2为原料合成尿素。液相中,合成尿素的热化学方程式为: 2NH3(l) + CO2(l) H2O(l) + NH2CONH2(l) ΔH<0 , 在液相中,CO2 的平衡转化率与温度、初始氨碳比(用L表示,L= )、初始水碳比(用W表示,W=)关系如图4。
(3)、工业以NH3和CO2为原料合成尿素。液相中,合成尿素的热化学方程式为: 2NH3(l) + CO2(l) H2O(l) + NH2CONH2(l) ΔH<0 , 在液相中,CO2 的平衡转化率与温度、初始氨碳比(用L表示,L= )、初始水碳比(用W表示,W=)关系如图4。
①曲线A、B中,(填 “A”或“B”)的W较小。
②对于液相反应,常用某组分M达到平衡时的物质的量分数x(M)代替平衡浓度来计算平衡常数(记作Kx)。195℃时,2NH3(l) + CO2(l) H2O(l) + NH2CONH2(l)的Kx的值为 。
(4)、氨气可以用于燃料电池,其原理是氨气与氧气在碱性条件下反应生成一种常见的无毒气体和水,负极的电极反应式是。17. 物质L是医药工业中广泛使用的一种具有生物活性的中间体。该化合物的一种合成路线如图所示(部分反应条件或试剂略去)。
已知:
①

②
 (1)、B→C的反应条件为。(2)、C有多种同分异构体,属于二元取代苯,且均为两性化合物的有三种,可通过蒸馏的方法来分离这三种混合物,其中最先被蒸馏出来的物质是(写出结构简式)。(3)、F→G的反应类型为。(4)、G→H的化学方程式为。(5)、L中的手性碳原子个数为(连4个不同的原子或原子团的碳原子称手性碳原子)。(6)、参照上述合成路线,以
(1)、B→C的反应条件为。(2)、C有多种同分异构体,属于二元取代苯,且均为两性化合物的有三种,可通过蒸馏的方法来分离这三种混合物,其中最先被蒸馏出来的物质是(写出结构简式)。(3)、F→G的反应类型为。(4)、G→H的化学方程式为。(5)、L中的手性碳原子个数为(连4个不同的原子或原子团的碳原子称手性碳原子)。(6)、参照上述合成路线,以 和
和 为原料,设计合成
为原料,设计合成 的路线 (无机试剂任选)。 18. 为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员研制了一种回收V2O5的新工艺,主要流程如下图。
的路线 (无机试剂任选)。 18. 为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员研制了一种回收V2O5的新工艺,主要流程如下图。
已知:i.部分含钒物质常温下在水中的溶解性如下表所示:
物质
VOSO4
V2O5
NH4VO3
(VO2)2SO4
溶解性
可溶
难溶
难溶
易溶
ii.VO+ 2 OH- VO+H2O
回答下列问题:
(1)、用水浸泡废钒催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为 ; (写两条)。(2)、滤液1和滤液2中含钒的主要物质成分相同。在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式为。(3)、生成VO的反应中消耗1mol KClO3时转移6mol电子,该反应的离子方程式为。(4)、结合化学用语,用平衡移动原理解释加入氨水的作用为。(5)、最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂中V的质量之比)表示该步反应钒的回收率。请解释下图温度超过80℃以后,沉钒率下降的可能原因是;(写两条)。 (6)、测定产品中V2O5的纯度,称取a g产品,先用硫酸溶解,得到 (VO2)2SO4溶液,再加入b1 mL c1 mol·L−1 H2C2O4溶液(2VO+H2C2O4+2H+= 2VO2++2CO2↑+2H2O),最后用c2 mol·L-1 KMnO4溶液滴定过量的H2C2O4至终点,消耗KMnO4溶液的体积为b2 mL。已知MnO被还原为Mn2+ , 假设杂质不参与反应。则产品中V2O5(摩尔质量:182 g·mol−1)的质量分数是(列出计算式)。19. 某小组同学探究MnO、MnO的性质。
(6)、测定产品中V2O5的纯度,称取a g产品,先用硫酸溶解,得到 (VO2)2SO4溶液,再加入b1 mL c1 mol·L−1 H2C2O4溶液(2VO+H2C2O4+2H+= 2VO2++2CO2↑+2H2O),最后用c2 mol·L-1 KMnO4溶液滴定过量的H2C2O4至终点,消耗KMnO4溶液的体积为b2 mL。已知MnO被还原为Mn2+ , 假设杂质不参与反应。则产品中V2O5(摩尔质量:182 g·mol−1)的质量分数是(列出计算式)。19. 某小组同学探究MnO、MnO的性质。资料:i.MnO的氧化能力与溶液的酸碱度有关,在酸性环境、中性环境、碱性环境能
被SO分别还原为Mn2+(无色)、MnO2、MnO (绿色)。
ii. MnO在强碱溶液中能稳定存在,在酸性或纯水环境中易转化为MnO和MnO2。
(1)、I.验证MnO与SO的反应,实验如下:
实验①参与反应的高锰酸钾和亚硫酸钠物质的量之比为。实验 序号 试剂X 现象  1mL0.01mol·L−1 KMnO4溶液
1mL0.01mol·L−1 KMnO4溶液① 2滴3mol·L−1 H2SO43滴0.1mol·L−1 Na2SO3 溶液褪为无色 ② 2滴纯水3滴0.1mol·L−1 Na2SO3 产生棕色沉淀 ③ 2滴6mol·L−1 NaOH3滴0.1 mol·L−1 Na2SO3 溶液变为绿色 ④ 2滴6mol·L−1 NaOH10滴0.1mol·L−1 Na2SO3 溶液变为绿色溶液,有浑浊,绿色很快消失,有大量棕色沉淀生成 (2)、实验④中绿色很快消失,有大量棕色沉淀生成,结合离子方程式分析可能的原因 。甲同学补做了实验(填操作和现象),证明猜测合理。(3)、II.验证 MnO的性质。某同学用b试管得到的绿色溶液设计实验如下:

c试管中得到紫色溶液和棕色浑浊的离子反应方程式为。继续滴加醋酸,沉淀溶解,得到无色透明溶液,有如下两种猜想:
① MnO、MnO2可能被CH3COOH还原。
设计实验:将1mL 0.01mol·L−1 KMnO4溶液与少量MnO2固体混合,再向其中加入少许2mol·L−1 CH3COOH溶液,(填现象),证明猜想不合理。
② MnO、MnO2 可能被还原,发生的反应: , 。
经实验验证,猜想合理。
由以上实验可知:MnO、MnO2的性质不仅与溶液的酸碱度有关;还与试剂的用量等有关。