山西省吕梁市孝义市2022-2023学年高二下学期期中考试化学试题
试卷更新日期:2023-05-24 类型:期中考试
一、单选题
-
1. 原子模型是由人们对物质世界微观结构的认识而建立的。从电子层模型分析,基态Cr原子的M层核外电子的运动状态有( )A、8种 B、13种 C、14种 D、18种2. 下列描述原子结构的化学用语正确的是( )A、氯化铵的电子式:
 B、基态铜原子的价层电子排布式:
C、乙烯分子的结构简式为
D、的VSEPR模型:
B、基态铜原子的价层电子排布式:
C、乙烯分子的结构简式为
D、的VSEPR模型: 3. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、1mol[Cu(NH3)4]2+中σ键的数目为12NA B、23gCH3CH2OH中为sp3杂化的原子数为NA C、0.5molSF6中S的价层电子对数为3NA D、甲烷酸性燃料电池中正极有1mol气体反应时转移的电子数目2NA4. 硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应的化学方程式为:AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr。下列说法正确的是( )A、基态Br原子中电子的空间运动状态有35种 B、[Ag(S2O3)2]3-中含有离子键、共价键、配位键 C、中心原子S的杂化方式为sp3 D、非金属元素S、O、Br中电负性最大的是Br5. 下列说法错误的是( )A、某烯烃(
3. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、1mol[Cu(NH3)4]2+中σ键的数目为12NA B、23gCH3CH2OH中为sp3杂化的原子数为NA C、0.5molSF6中S的价层电子对数为3NA D、甲烷酸性燃料电池中正极有1mol气体反应时转移的电子数目2NA4. 硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应的化学方程式为:AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr。下列说法正确的是( )A、基态Br原子中电子的空间运动状态有35种 B、[Ag(S2O3)2]3-中含有离子键、共价键、配位键 C、中心原子S的杂化方式为sp3 D、非金属元素S、O、Br中电负性最大的是Br5. 下列说法错误的是( )A、某烯烃( )与溴发生1∶1加成反应,产物有3种(不考虑立体异构)
B、主链含5个碳原子,有甲基、乙基两个支链的烷烃有2种
C、丙烯分子中最多有7个原子共平面
D、
)与溴发生1∶1加成反应,产物有3种(不考虑立体异构)
B、主链含5个碳原子,有甲基、乙基两个支链的烷烃有2种
C、丙烯分子中最多有7个原子共平面
D、 的名称为3,3-二甲基-2-乙基-1-丁烯
6. 有三种有机物I、Ⅱ、Ⅲ存在如图转化关系。下列说法正确的是( )
的名称为3,3-二甲基-2-乙基-1-丁烯
6. 有三种有机物I、Ⅱ、Ⅲ存在如图转化关系。下列说法正确的是( ) A、反应1和反应2均为加成反应 B、有机物I中所有原子均可共平面 C、有机物Ⅲ的二氯代物有7种(不考虑立体异构) D、有机物Ⅱ和Ⅲ互为同系物,且均可发生取代反应7. 一种用作锂离子电池电解液的锂盐结构如图所示,X、Y、Z、W为原子序数依次增大的短周期主族元素,W原子的最外层电子数等于其总电子数的。下列说法不正确的是( )
A、反应1和反应2均为加成反应 B、有机物I中所有原子均可共平面 C、有机物Ⅲ的二氯代物有7种(不考虑立体异构) D、有机物Ⅱ和Ⅲ互为同系物,且均可发生取代反应7. 一种用作锂离子电池电解液的锂盐结构如图所示,X、Y、Z、W为原子序数依次增大的短周期主族元素,W原子的最外层电子数等于其总电子数的。下列说法不正确的是( ) A、简单离子半径:W>Y>Z B、X元素的各种含氧酸盐水溶液均显碱性 C、与W同周期的元素中,第一电离能小于W的有5种 D、该锂盐中所有非金属元素均属于元素周期表p区元素8. 将少量硫酸铜溶液滴入氨基乙酸钠溶液(H2N-CH2-COONa)中即可得到结构如图所示的产物。下列叙述错误的是( )
A、简单离子半径:W>Y>Z B、X元素的各种含氧酸盐水溶液均显碱性 C、与W同周期的元素中,第一电离能小于W的有5种 D、该锂盐中所有非金属元素均属于元素周期表p区元素8. 将少量硫酸铜溶液滴入氨基乙酸钠溶液(H2N-CH2-COONa)中即可得到结构如图所示的产物。下列叙述错误的是( ) A、向该反应后的混合溶液中滴加NaOH溶液,会产生蓝色沉淀 B、1molH2N-CH2-COONa中含有8NA个σ键 C、产物中Cu、N原子均为四面体形结构 D、氨基乙酸钠中的氮原子采取sp3杂化9. 第VIA族元素的单质和化合物在生产、生活中有广泛应用。已知:分子中形成大π键的轨道必须垂直平面且相互平行,大π键可以表示为π , 其中n代表大π键的原子数,m代表大π键的电子数,下列说法正确的是( )A、在氧族气态氢化物中,H2Se的沸点最低 B、SeO和SeO3的空间结构相同 C、SO中的键角小于SO3中的键角 D、噻吩(
A、向该反应后的混合溶液中滴加NaOH溶液,会产生蓝色沉淀 B、1molH2N-CH2-COONa中含有8NA个σ键 C、产物中Cu、N原子均为四面体形结构 D、氨基乙酸钠中的氮原子采取sp3杂化9. 第VIA族元素的单质和化合物在生产、生活中有广泛应用。已知:分子中形成大π键的轨道必须垂直平面且相互平行,大π键可以表示为π , 其中n代表大π键的原子数,m代表大π键的电子数,下列说法正确的是( )A、在氧族气态氢化物中,H2Se的沸点最低 B、SeO和SeO3的空间结构相同 C、SO中的键角小于SO3中的键角 D、噻吩( )含有的大π键为π
10. 冠醚能识别碱金属离子,X、Y、Z是常见的三种冠醚,Li⁺与X作用形成稳定的结构W。下列说法正确的是( )
)含有的大π键为π
10. 冠醚能识别碱金属离子,X、Y、Z是常见的三种冠醚,Li⁺与X作用形成稳定的结构W。下列说法正确的是( ) A、X与Y属于同系物 B、上述冠醚分子中,所有碳原子和氧原子都采取sp2杂化 C、W中存在极性键、非极性键、离子键 D、冠醚Y能与K+形成稳定结构但不能与Li+形成稳定结构的原因是Li+半径太小11. 氮化硼是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到和 , 如图所示。下列叙述正确的是
A、X与Y属于同系物 B、上述冠醚分子中,所有碳原子和氧原子都采取sp2杂化 C、W中存在极性键、非极性键、离子键 D、冠醚Y能与K+形成稳定结构但不能与Li+形成稳定结构的原因是Li+半径太小11. 氮化硼是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到和 , 如图所示。下列叙述正确的是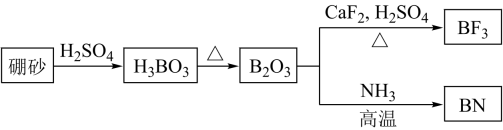 A、硼酸具有片层状结构,层与层之间,单元间都以范德华力连接 B、立方氮化硼结构与金刚石相似。立方氮化硼晶胞中每个氮原子周围有4个硼原子 C、与反应后再用氨气中和得到 , 含有配位键的数目为 D、与都是由极性键构成的极性分子12. 甲胺铅碘[]是新型太阳能电池的敏化剂,已知[]的摩尔质量为 , 其晶胞结构如图所示。下列有关说法不正确的是( )
A、硼酸具有片层状结构,层与层之间,单元间都以范德华力连接 B、立方氮化硼结构与金刚石相似。立方氮化硼晶胞中每个氮原子周围有4个硼原子 C、与反应后再用氨气中和得到 , 含有配位键的数目为 D、与都是由极性键构成的极性分子12. 甲胺铅碘[]是新型太阳能电池的敏化剂,已知[]的摩尔质量为 , 其晶胞结构如图所示。下列有关说法不正确的是( )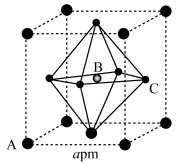 A、若B代表 , 则C代表 B、该晶胞沿体对角线方向的投影图为
A、若B代表 , 则C代表 B、该晶胞沿体对角线方向的投影图为 C、距离A最近且等距离的C有8个
D、为阿伏加德罗常数的值,则该晶体的密度为
13. 基于硫化学的金属硫电池有望替代当前锂离子电池技术,满足人类社会快速增长的能源需求,该电池的结构及原理如图所示。
C、距离A最近且等距离的C有8个
D、为阿伏加德罗常数的值,则该晶体的密度为
13. 基于硫化学的金属硫电池有望替代当前锂离子电池技术,满足人类社会快速增长的能源需求,该电池的结构及原理如图所示。
下列有关叙述正确的是( )
A、该电池可采用含的水溶液或有机物为电解质溶液 B、放电时,电子的移动方向:电极a→电极b→隔膜→电极a C、充电时,阳极区可能发生的反应有 D、充电时。电路中转移时,阴极质量减重78g14. 室温下,向20mL0.05mol•L-1的H2X溶液中逐滴加入0.1mol•L-1的NaOH溶液,溶液pH随着NaOH溶液体积变化的关系如图所示。下列叙述错误的是( ) A、室温下,H2X的电离常数Ka1(H2X)≈2.0×10-5 B、随着NaOH溶液的不断加入,水的电离程度先增大后减小 C、V[NaOH(aq)]=10mL时,溶液中c(Na+)>c(HX-)>c(H2X)>c(H+)>c(X2-) D、pH=7时,V0<20mL,溶液中c(Na+)=c(HX-)+2c(X2-)
A、室温下,H2X的电离常数Ka1(H2X)≈2.0×10-5 B、随着NaOH溶液的不断加入,水的电离程度先增大后减小 C、V[NaOH(aq)]=10mL时,溶液中c(Na+)>c(HX-)>c(H2X)>c(H+)>c(X2-) D、pH=7时,V0<20mL,溶液中c(Na+)=c(HX-)+2c(X2-)二、非选择题
-
15. 按要求回答下列问题:(1)、
 的分子式为 , 所含官能团的名称为。 (2)、CH3-C≡C-CH=CHCH3分子中有个碳原子共平面,最多有个原子共平面。(3)、一定条件下,某些不饱和烃分子可以进行自身加成反应,例如:
的分子式为 , 所含官能团的名称为。 (2)、CH3-C≡C-CH=CHCH3分子中有个碳原子共平面,最多有个原子共平面。(3)、一定条件下,某些不饱和烃分子可以进行自身加成反应,例如:
有机物甲的结构简式为
 ,它是由不饱和烃乙的两个分子在一定条件下自身加成而得到的。在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长碳链仍为5个碳原子,丙是甲的同分异构体。则乙的结构简式是 , 丙的结构简式是。16. “祝融号”火星车到达火星表面。据悉火星上存在甲醇()、羰基硫(OCS)等有机物。回答下列问题:(1)、中O的杂化类型为 , 8g中含有mol键。(2)、常用于酯交换等有机合成反应,下列各种Li原子电子排布图(轨道表示式)表示的状态中能量最低和最高的分别为、(填字母)。
,它是由不饱和烃乙的两个分子在一定条件下自身加成而得到的。在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长碳链仍为5个碳原子,丙是甲的同分异构体。则乙的结构简式是 , 丙的结构简式是。16. “祝融号”火星车到达火星表面。据悉火星上存在甲醇()、羰基硫(OCS)等有机物。回答下列问题:(1)、中O的杂化类型为 , 8g中含有mol键。(2)、常用于酯交换等有机合成反应,下列各种Li原子电子排布图(轨道表示式)表示的状态中能量最低和最高的分别为、(填字母)。A.
 B.
B.
C.
 D.
D.
与具有相同的电子结构,小于 , 原因是。
(3)、分子中键与键间的夹角为 , 该分子属于(填“极性”或“非极性”)分子;OCS分子中键长:C=O(填“>”或“<”,下同)C=S,键能:C=OC=S。17. 铁、钴均为第四周期第Ⅷ族元素,它们的单质及其化合物均具有广泛用途。(1)、基态Co2+中未成对电子数为;Fe和Co的第三电离能:I3(Fe)I3(Co)(填“>”“<”或“=”)。(2)、化学上可用EDTA测定Fe2+和Co2+的含量。EDTA的结构简式如图所示:
①EDTA中电负性最大的元素是(填元素符号),其中C原子的杂化轨道类型为。
②EDTA分子中存在的化学键有(填选项字母)。
a.离子键 b.共价键 c.氢键 d.σ键 e.π键 f.配位键
(3)、将1molCoCl3·4NH3溶于水中,加入足量AgNO3溶液生成1molAgCl沉淀。则CoCl3·4NH3中配离子的化学式为。已知孤电子对与成键电子对的排斥作用大于成键电子对的排斥作用,则NH3分子与Co3+形成配合物后,H-N-H键角(填“变大”“变小”或“不变”)。(4)、一种铁氮化合物具有高磁导率,其结构如图所示。已知晶体的密度为ρg•cm-3 , 阿伏加德罗常数的值为NA。
①该铁氮化合物的化学式为。
②一个晶胞内Fe(Ⅱ)构成的一个正八面体的体积为cm3。
18. 大力推广磷酸亚铁锂电池新能源汽车对实现“碳达峰”和“碳中和”具有重要意义。电极材料以硫铁矿(主要成分FeS2 , 含少量Al2O3、SiO2和Fe2O3)为原料制备,工业流程如图所示。回答下列问题: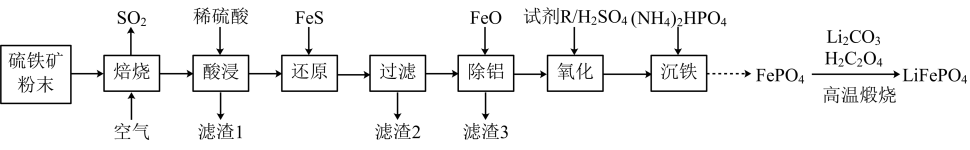 (1)、SO2分子的空间结构名称为 , 试剂R是一种绿色氧化剂,其中心原子杂化方式是。(2)、从平衡的角度解释加FeO除铝的原因(结合离子方程式说明)。(3)、若“沉铁”时溶液中c(PO)=1.0×10-4mol•L-1 , 则“沉铁”时pH不能高于 , [已知:常温下,Ksp(FePO4)=5.0×10-16、Ksp[Fe(OH)3]=4×10-38、lg2=0.3,溶液体积变化忽略不计]。(4)、流程中在高温煅烧条件下,由FePO4制备LiFePO4的化学方程式为。(5)、磷酸亚铁锂(LiFePO4)的晶胞结构如图所示:
(1)、SO2分子的空间结构名称为 , 试剂R是一种绿色氧化剂,其中心原子杂化方式是。(2)、从平衡的角度解释加FeO除铝的原因(结合离子方程式说明)。(3)、若“沉铁”时溶液中c(PO)=1.0×10-4mol•L-1 , 则“沉铁”时pH不能高于 , [已知:常温下,Ksp(FePO4)=5.0×10-16、Ksp[Fe(OH)3]=4×10-38、lg2=0.3,溶液体积变化忽略不计]。(4)、流程中在高温煅烧条件下,由FePO4制备LiFePO4的化学方程式为。(5)、磷酸亚铁锂(LiFePO4)的晶胞结构如图所示:
长方体晶胞的长和宽均为apm,高为bpm,NA为阿伏加德罗常数的值,晶体的密度为g•cm-3。
19. 氮的氧化物是造成大气污染的主要成分之一,降低氮氧化物的排放可改善大气质量。(1)、已知:N2(g)+O2(g)=2NO(g) △H1=+181kJ•mol-12C(s)+O2(g)=2CO(g) △H2=-221kJ•mol-1
2NO(g)+2CO(g)N2(g)+2CO2(g) △H3=-747kJ•mol-1
碳完全燃烧时的热化学方程式为。
(2)、向密闭反应器中按n(NO):n(CO)=1:1投料,发生(1)中的反应③。不同温度下,反应达到平衡时,NO的平衡转化率随压强的变化曲线如图所示。
①曲线a、b对应温度较低的是(填“曲线a”或“曲线b”)。
②M点时混合气体的平均相对分子质量为(结果保留两位小数)。
(3)、一定温度下,向恒容密闭容器中通入1molNO、1molCO,发生(1)中的反应③。测得容器中混合气体的压强(p)随时间(t)的变化关系如表所示。t/min
0
1
2
3
4
5
p/kPa
200
185
173
165
160
160
①反应开始到刚达平衡状态的时间段内,v(CO)=kPa·min-1 , 该反应条件下的平衡常数Kp=(kPa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。该反应中正反应速率v正=k正·p2(NO)·p2(CO),逆反应速率v逆=k逆·p(N2)·p2(CO2),则该温度下,该反应的k正 (填“>”“<”或“=”)k逆。
②能判断反应已达到化学平衡状态的是(填字母序号)。
A.N2和CO2的浓度比保持不变 B.容器中熵值保持不变
C.2v正(NO)=v逆(N2) D.气体的密度保持不变
(4)、工业上利用电化学方法处理NO的原理如图所示。正极的电极反应式为。