山西省大同市2022-2023学年高二下学期期中考试化学试题
试卷更新日期:2023-05-24 类型:期中考试
一、单选题
-
1. 2022年北京冬奥会已经成功落下帷幕,安全、绿色、高效、智能给世界人民留下了深刻印象。下列相关说法不正确的是( )
 A、速滑馆跨临界直接制冰使用的CO2分子属于非极性分子 B、冬奥会机器人所用芯片的主要成分单晶硅属于共价晶体 C、滑冰场上的冰(H2O)融化过程中,密度随温度升高而增大 D、闭幕式鸟巢上空绽放的璀璨焰火与原子核外电子跃迁有关2. 下列化学用语表达正确的是( )A、基态Br的简化电子排布式:[Ar]4s24p5 B、HClO的电子式:
A、速滑馆跨临界直接制冰使用的CO2分子属于非极性分子 B、冬奥会机器人所用芯片的主要成分单晶硅属于共价晶体 C、滑冰场上的冰(H2O)融化过程中,密度随温度升高而增大 D、闭幕式鸟巢上空绽放的璀璨焰火与原子核外电子跃迁有关2. 下列化学用语表达正确的是( )A、基态Br的简化电子排布式:[Ar]4s24p5 B、HClO的电子式: C、基态Mn2+的价层电子轨道表示式:
C、基态Mn2+的价层电子轨道表示式: D、基态Fe的原子结构示意图:
D、基态Fe的原子结构示意图: 3. 镍常在合成工业中作催化剂。下列有关基态镍原子的描述不正确的是( )A、最外层电子数为2 B、未成对电子数为2 C、电子所占据的最高能层符号为M D、价层电子的空间运动状态有6种4. 下列关于共价键的理解正确的是( )A、σ键和π键电子形状的对称性相同 B、所有分子中都存在共价键 C、只有共价化合物中存在共价键 D、多原子分子中的键角表明共价键有方向性5. VSEPR理论可用来预测分子的空间结构。下列微粒的VSEPR模型与其粒子的空间结构不一致的是( )A、SO2 B、NH C、HCN D、ClO6. 下列轨道表示式能表示基态铬原子价层电子结构的是( )A、
3. 镍常在合成工业中作催化剂。下列有关基态镍原子的描述不正确的是( )A、最外层电子数为2 B、未成对电子数为2 C、电子所占据的最高能层符号为M D、价层电子的空间运动状态有6种4. 下列关于共价键的理解正确的是( )A、σ键和π键电子形状的对称性相同 B、所有分子中都存在共价键 C、只有共价化合物中存在共价键 D、多原子分子中的键角表明共价键有方向性5. VSEPR理论可用来预测分子的空间结构。下列微粒的VSEPR模型与其粒子的空间结构不一致的是( )A、SO2 B、NH C、HCN D、ClO6. 下列轨道表示式能表示基态铬原子价层电子结构的是( )A、 B、
B、 C、
C、 D、
D、 7. 徐光宪在《分子共和国》一书中介绍了许多明星分子,如O3、CO2、Cl2、CH3COOH等。下列说法不正确的是( )A、Cl2分子中,Cl-Cl键是p-pσ键 B、酸性:甲酸<乙酸<丙酸 C、干冰晶体采用分子密堆积,每个CO2周围紧邻12个CO2 D、O3极性微弱,在CCl4中的溶解度高于在水中的溶解度8. 杂化轨道理论可以用来解释分子的空间结构,下列有关该理论的说法正确的是( )A、杂化轨道能用来形成σ键和π键 B、原子轨道杂化前后轨道总数不变,但轨道电子云轮廓图发生了改变 C、空间结构为V形的分子,其中心原子一定采取sp2杂化轨道成键 D、sp杂化轨道是由能量相同的1个s轨道和1个p轨道混合形成的9. 下列变化过程中,所需克服的作用力均相同的是( )A、单晶硅熔化和C60熔化 B、Mg熔化和I2的升华 C、NaCl溶于水和NaHSO4熔化 D、纯碱电离和电解水10. 元素Li、Na、K的某种性质Y随核电荷数的变化趋势如图所示,则坐标轴Y不可以代表的是( )
7. 徐光宪在《分子共和国》一书中介绍了许多明星分子,如O3、CO2、Cl2、CH3COOH等。下列说法不正确的是( )A、Cl2分子中,Cl-Cl键是p-pσ键 B、酸性:甲酸<乙酸<丙酸 C、干冰晶体采用分子密堆积,每个CO2周围紧邻12个CO2 D、O3极性微弱,在CCl4中的溶解度高于在水中的溶解度8. 杂化轨道理论可以用来解释分子的空间结构,下列有关该理论的说法正确的是( )A、杂化轨道能用来形成σ键和π键 B、原子轨道杂化前后轨道总数不变,但轨道电子云轮廓图发生了改变 C、空间结构为V形的分子,其中心原子一定采取sp2杂化轨道成键 D、sp杂化轨道是由能量相同的1个s轨道和1个p轨道混合形成的9. 下列变化过程中,所需克服的作用力均相同的是( )A、单晶硅熔化和C60熔化 B、Mg熔化和I2的升华 C、NaCl溶于水和NaHSO4熔化 D、纯碱电离和电解水10. 元素Li、Na、K的某种性质Y随核电荷数的变化趋势如图所示,则坐标轴Y不可以代表的是( ) A、元素的电负性 B、单质的还原性 C、元素的第一电离能 D、单质的熔沸点11. 科学家用48Ca原子轰击镕的一种同位素原子产生了一种超重元素Ts,其反应可表示为Ca+Bk→Ts+3n,下列说法不正确的是( )A、上述反应中共有4种核素 B、钙原子核内中子数为28 C、Ts位于周期表中的p区 D、元素Ts所在的周期共有32种元素12. 氢键的存在对生命的繁衍具有重要意义。下列物质的结构或者性质与氢键无关的是( )A、乙醇可与水以任意比例互溶 B、S单质难溶于水,却易溶于CS2 C、邻羟基苯甲醛(
A、元素的电负性 B、单质的还原性 C、元素的第一电离能 D、单质的熔沸点11. 科学家用48Ca原子轰击镕的一种同位素原子产生了一种超重元素Ts,其反应可表示为Ca+Bk→Ts+3n,下列说法不正确的是( )A、上述反应中共有4种核素 B、钙原子核内中子数为28 C、Ts位于周期表中的p区 D、元素Ts所在的周期共有32种元素12. 氢键的存在对生命的繁衍具有重要意义。下列物质的结构或者性质与氢键无关的是( )A、乙醇可与水以任意比例互溶 B、S单质难溶于水,却易溶于CS2 C、邻羟基苯甲醛( )的熔点低于对羟基苯甲醛(
)的熔点低于对羟基苯甲醛( )的熔点
D、可燃冰(CH4·8H2O)中水分子笼的形成
13. 结合元素周期律,根据下列事实所得推测合理的是( )
)的熔点
D、可燃冰(CH4·8H2O)中水分子笼的形成
13. 结合元素周期律,根据下列事实所得推测合理的是( )选项
事实
推测
A
CO2是分子晶体,熔点较低
SiO2是分子晶体,但熔点高于CO2
B
根据“对角线规则”,元素Be和Al的化学性质相似
Be(OH)2具有两性,可与稀氨水反应
C
电解CuCl2溶液可得到金属Cu
电解MgCl2溶液可得到金属Mg
D
三氟乙酸的酸性强于三氯乙酸的酸性
三氯乙酸酸性强于三溴乙酸酸性
A、A B、B C、C D、D14. 由键能数据大小,不能解释下列事实的是( )化学键
N≡N
O=O
F-F
H-F
H-Cl
H-Br
H-I
键能/kJ•mol-1
946
497.3
157
568
431.8
366
298.7
A、熔沸点:HF>HCl>HBr B、稳定性:HCl>HBr>HI C、与H2的反应能力:F2>O2>N2 D、热分解温度:HCl>HBr>HI15. 阿斯巴甜作为甜味剂被广泛应用于糖果、饮料等食品行业,该有机物的结构简式如图所示。已知当碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳原子,则下列说法不正确的是( ) A、该分子含有2个手性碳原子 B、该分子存在手性异构体 C、该化合物与石墨的晶体类型相同 D、可通过红外光谱法确定该化合物中的官能团16. 砷是氮族元素,下列有关黄砷As4(结构如图:
A、该分子含有2个手性碳原子 B、该分子存在手性异构体 C、该化合物与石墨的晶体类型相同 D、可通过红外光谱法确定该化合物中的官能团16. 砷是氮族元素,下列有关黄砷As4(结构如图: )的叙述正确的是( ) A、黄砷晶体为共价键三维骨架结构 B、7.5g黄砷含有0.4NA个σ键 C、该结构中共价键的键角约为109°28′ D、熔点:白磷<黄砷17. 已知五种短周期元素的相关信息如表,则下列有关判断正确的是( )
)的叙述正确的是( ) A、黄砷晶体为共价键三维骨架结构 B、7.5g黄砷含有0.4NA个σ键 C、该结构中共价键的键角约为109°28′ D、熔点:白磷<黄砷17. 已知五种短周期元素的相关信息如表,则下列有关判断正确的是( )元素代号
X
Y
Z
P
Q
原子半径/nm
0.160
0.143
0.089
0.102
0.071
主要化合价
+2
+3
+2
+6、+4、-2
-1
A、元素X的单质可在干冰中燃烧 B、非金属性:P>Q C、最高价氧化物的水化物的碱性:X<Z D、元素X、Y、Q的简单离子半径:X>Y>Q18. 蒽的某种衍生物(结构如图)是荧光分子,分子中含有冠醚结构,可用作由光引发的分子开关。下列说法正确的是( )
15-冠-5冠醚空腔直径/pm
离子直径/pm
170~220
Li+:152
Na+:204
K+:276
A、冠醚结构中5个O原子与Na+不可能在同一平面上 B、15-冠-5空穴也能适配Li+、K+ C、分子识别是超分子的唯一特征 D、一个该荧光分子中Na+周围的配位键数目为619. 我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时可发生反应:2KNO3+S+3CK2S+N2↑+3CO2↑,生成物K2S的晶胞结构如图。下列有关说法不正确的是( )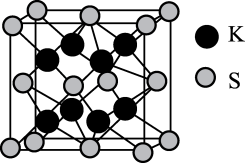 A、S和C均有多种同素异形体 B、N2中含有的σ键和π键数目之比为1∶2 C、K2S晶胞无隙并置后的晶体具有各向异性 D、K2S晶体中,每个S2-周围紧邻4个K+20. 离子液体是在室温或接近室温时呈液态的盐类物质。1-乙基-3-甲基咪唑四氟硼酸盐离子液体的结构如图所示,下列相关叙述不正确的是( )
A、S和C均有多种同素异形体 B、N2中含有的σ键和π键数目之比为1∶2 C、K2S晶胞无隙并置后的晶体具有各向异性 D、K2S晶体中,每个S2-周围紧邻4个K+20. 离子液体是在室温或接近室温时呈液态的盐类物质。1-乙基-3-甲基咪唑四氟硼酸盐离子液体的结构如图所示,下列相关叙述不正确的是( ) A、所有原子均满足8电子稳定结构 B、该离子液体属于离子化合物 C、BF的空间结构为正四面体 D、离子晶体中引入有机基团有利于降低离子化合物的熔点
A、所有原子均满足8电子稳定结构 B、该离子液体属于离子化合物 C、BF的空间结构为正四面体 D、离子晶体中引入有机基团有利于降低离子化合物的熔点二、非选择题
-
21. C、N、O、F等元素的化合物在航天、美容、食品等多领域中有广泛的用途,请回答:(1)、OF2主要用于火箭工程液体助燃剂,该分子的空间结构为;N、O、F的第一电离能由大到小的顺序为(用元素符号表示)。(2)、XeF2是一种选择性很好的氟化试剂,但在室温下易升华,推测XeF2为晶体(填晶体类型)。(3)、FeSO4是一种重要的食品和饲料添加剂:
①Fe在周期表中位于第周期第族。
②FeSO4·7H2O的结构示意图如图所示,H2O与Fe2+、SO的作用类型分别是、。
A.离子键 B.配位键 C.氢键 D.金属键

③比较H2O分子和SO中键角的大小并解释原因:。
22. 某种食品添加剂由四种元素组成(结构如图),已知X、Y、Z、W为短周期主族元素,且原子序数依次增大,X与Z同主族,W与X原子的最外层电子数之和等于Y原子的最外层电子数,Y是地壳中含量最多的元素。
请回答下列问题:
(1)、基态Z原子的核外电子排布式为 , W元素最高价氧化物的水化物的化学式为。(2)、X、Y、Z、W原子半径由小到大的顺序为(用元素符号表示)。(3)、W元素以及同族相邻元素所形成的氢化物中,沸点由低到高的顺序是(填化学式),原因是:。(4)、元素Y可分别与元素X和Z形成原子个数比为1∶1的两种晶体,这两种晶体类型分别是晶体、晶体。23. 如表是元素周期表的一部分,其中的数字编号代表对应的元素。 (1)、下列支持或证实原子核外电子处于能量不同的能层和能级的是____。A、原子光谱 B、原子的逐级电离能数据 C、同位素现象 D、电子跃迁现象(2)、结合表格,下列有关说法错误的是____。A、元素周期系只有一个,而元素周期表可以多种多样 B、第二周期的基态原子中,只有②的核外未成对电子数为2 C、原子①的电子云如图所示:
(1)、下列支持或证实原子核外电子处于能量不同的能层和能级的是____。A、原子光谱 B、原子的逐级电离能数据 C、同位素现象 D、电子跃迁现象(2)、结合表格,下列有关说法错误的是____。A、元素周期系只有一个,而元素周期表可以多种多样 B、第二周期的基态原子中,只有②的核外未成对电子数为2 C、原子①的电子云如图所示: , 它表示离核越近电子出现的几率越大
D、“电子气理论”可以解释金属③具有良好的导电性和延展性
(3)、⑤的基态原子中能量最高的电子所在原子轨道的电子云轮廓图在空间有个伸展方向,形状为。(4)、元素②的最高价氧化物的电子式为 , 元素⑥的最高正价为。(5)、如表是一些气态原子失去核外不同电子所需的能量(kJ•mol-1):
, 它表示离核越近电子出现的几率越大
D、“电子气理论”可以解释金属③具有良好的导电性和延展性
(3)、⑤的基态原子中能量最高的电子所在原子轨道的电子云轮廓图在空间有个伸展方向,形状为。(4)、元素②的最高价氧化物的电子式为 , 元素⑥的最高正价为。(5)、如表是一些气态原子失去核外不同电子所需的能量(kJ•mol-1):Li
X
Y
失去第一个电子
519
502
580
失去第二个电子
7296
4570
1820
失去第三个电子
11799
6920
2750
失去第四个电子
9550
11600
①通过上述信息和表中的数据分析锂原子失去核外第二个电子时所需的能量远远大于失去第一个电子所需能量的原因是。
②表中Y可能为以上六种元素中的(填写数字编号)元素。
24. 超分子化学在识别、催化、传输等功能方面已迅速渗透到各学科领域。如图是一种由两个相同分子(a)组装形成的分子盒(b)。请回答: (1)、两分子(a)通过____结合成(b)。A、离子键 B、配位键 C、氢键 D、分子间作用力(2)、(a)分子中C原子的杂化方式为 , 基态Zn的价层电子轨道表示式为。(3)、原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋磁量子数。对于基态O原子,其核外电子自旋磁量子数的代数和为。25. Cu可形成多种配合物,一水硫酸四氨合铜晶体[Cu(NH3)4SO4·H2O]常用作杀虫剂,媒染剂等。常温下该物质可溶于水,难溶于乙醇,在空气中不稳定,受热时易发生分解。某化学兴趣小组制备[Cu(NH3)4]SO4·H2O晶体并测定其纯度。根据下列信息回答问题:(1)、[Cu(NH3)4]SO4中的中心离子为 , 若[Cu(NH3)4]2+具有对称的空间结构,且当其中的两个NH3被两个Cl-取代时,能到两种不同结构的产物,则[Cu(NH3)4]2+的空间结构为。(2)、将氨水逐滴加入硫酸铜溶液中,现象如图:
(1)、两分子(a)通过____结合成(b)。A、离子键 B、配位键 C、氢键 D、分子间作用力(2)、(a)分子中C原子的杂化方式为 , 基态Zn的价层电子轨道表示式为。(3)、原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋磁量子数。对于基态O原子,其核外电子自旋磁量子数的代数和为。25. Cu可形成多种配合物,一水硫酸四氨合铜晶体[Cu(NH3)4SO4·H2O]常用作杀虫剂,媒染剂等。常温下该物质可溶于水,难溶于乙醇,在空气中不稳定,受热时易发生分解。某化学兴趣小组制备[Cu(NH3)4]SO4·H2O晶体并测定其纯度。根据下列信息回答问题:(1)、[Cu(NH3)4]SO4中的中心离子为 , 若[Cu(NH3)4]2+具有对称的空间结构,且当其中的两个NH3被两个Cl-取代时,能到两种不同结构的产物,则[Cu(NH3)4]2+的空间结构为。(2)、将氨水逐滴加入硫酸铜溶液中,现象如图:
向硫酸铜溶液中加入适量氨水产生浅蓝色沉淀,已知其成分为Cu2(OH)2SO4 , 生成此沉淀的离子方程式为。继续滴加氨水,溶液变为深蓝色,由该过程可知(填“H2O”或“NH3”)与Cu2+形成的配位键更稳定。
(3)、向深蓝色溶液中加入乙醇,析出深蓝色的晶体[Cu(NH3)4]SO4·H2O,加乙醇析出深蓝色晶体的原因是;再经过过滤、洗涤、干燥可得到深蓝色晶体,以下最合适的洗涤液为。A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
(4)、产品纯度的测定。精确称取mg晶体溶于适量水,然后逐滴加入足量NaOH溶液,并将样品液中的氨全部蒸出,用V1mL0.5000mol/L的盐酸标准溶液完全吸收。吸收液用甲基橙作指示剂,用0.5000mol/LNaOH标准溶液滴定锥形瓶中过剩的盐酸,到终点时消耗V2mLNaOH溶液。样品中产品纯度的表达式为。26. 通过X射线衍射实验,结合计算可以获得晶体结构的多方面信息,请计算: (1)、化合物A是硫铁矿的主要成分,化合物A的晶胞为立方晶胞,结构如图所示,该晶胞中每个Fe2+周围紧邻且距离相等的Fe2+共有个;12g该化合物的晶体中含有个该晶胞结构单元(阿伏加德罗常数的值为NA)。(2)、砷化镓为第三代半导体材料,晶胞结构如图所示:
(1)、化合物A是硫铁矿的主要成分,化合物A的晶胞为立方晶胞,结构如图所示,该晶胞中每个Fe2+周围紧邻且距离相等的Fe2+共有个;12g该化合物的晶体中含有个该晶胞结构单元(阿伏加德罗常数的值为NA)。(2)、砷化镓为第三代半导体材料,晶胞结构如图所示:
①砷化镓的化学式为。
②已知砷化镓的晶胞参数为apm,则该晶体密度的计算表达式为g•cm-3(阿伏加德罗常数的值为NA);晶胞中砷原子和镓原子最近的核间距d为pm。
③晶胞的原子坐标参数表示晶胞内部各原子的相对位置,图中a、b处镓的原子坐标参数为(0,0,0)、(0, , )。则c处砷原子的坐标参数为。