山东省济宁市2022-2023学年高二下学期4月期中考试化学试题
试卷更新日期:2023-05-24 类型:期中考试
一、单选题
-
1. 下列说法错误的是( )A、能级都有3个相互垂直的原子轨道,且能量相等 B、所有金属元素都分布在d区和区 C、基态碳原子电子排布式违反了洪特规则 D、电子云轮廓图称为原子轨道,不同原子的能级能量不同2. 下列说法正确的是( )A、
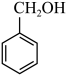 与
与 含有相同的官能团,互为同系物
B、
含有相同的官能团,互为同系物
B、 属于醛类,官能团为
C、
属于醛类,官能团为
C、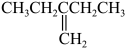 的名称为:2-乙基-1-丁烯
D、2-甲基-1-丁醇的键线式:
的名称为:2-乙基-1-丁烯
D、2-甲基-1-丁醇的键线式: 3. 目前,甘肃某医药公司与北京大学共同开发研制的国家一类抗癌新药乙烷硒啉(Ethaselen)进入临床研究,其结构如图。下列说法错误的是( )
3. 目前,甘肃某医药公司与北京大学共同开发研制的国家一类抗癌新药乙烷硒啉(Ethaselen)进入临床研究,其结构如图。下列说法错误的是( )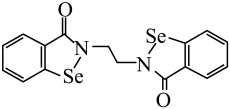 A、基态原子的核外电子排布式为 B、气态分子的键角小于的键角 C、该分子的一氯取代物有5种 D、分子中的碳原子采取杂化4. 对下列化学用语的理解正确的是( )A、空间填充模型
A、基态原子的核外电子排布式为 B、气态分子的键角小于的键角 C、该分子的一氯取代物有5种 D、分子中的碳原子采取杂化4. 对下列化学用语的理解正确的是( )A、空间填充模型 既可以表示甲烷分子,也可以表示四氯化碳分子
B、丙烯的结构简式:
C、的电子式为:
既可以表示甲烷分子,也可以表示四氯化碳分子
B、丙烯的结构简式:
C、的电子式为: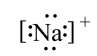 D、钛原子结构示意图为:
D、钛原子结构示意图为: 5. “冰墩墩”“雪容融”由PVC、PC、ABS和亚克力等环保材料制成。下列说法正确的是( )A、PVC(
5. “冰墩墩”“雪容融”由PVC、PC、ABS和亚克力等环保材料制成。下列说法正确的是( )A、PVC( )的相对分子质量为62.5
B、PC(
)的相对分子质量为62.5
B、PC(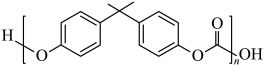 )是加聚反应生成的高聚物
C、苯乙烯是合成ABS的原料之一,其分子中的所有原子可能共面
D、亚克力(
)是加聚反应生成的高聚物
C、苯乙烯是合成ABS的原料之一,其分子中的所有原子可能共面
D、亚克力( )含有两种官能团
6. 三聚氰胺(
)含有两种官能团
6. 三聚氰胺( )是一种有机合成剂和分析剂,结构中含大π键。下列说法错误的是( ) A、晶体类型为分子晶体 B、1 mol该分子中存在15 mol σ键 C、分子中所有化学键均为极性键 D、六元环上的N原子提供孤对电子形成大π键7. 下列对有关事实的解释不正确的是( )
)是一种有机合成剂和分析剂,结构中含大π键。下列说法错误的是( ) A、晶体类型为分子晶体 B、1 mol该分子中存在15 mol σ键 C、分子中所有化学键均为极性键 D、六元环上的N原子提供孤对电子形成大π键7. 下列对有关事实的解释不正确的是( )选项
事实
解释
A
的熔点比干冰高
晶体是共价晶体,晶体是分子晶体
B
在中的溶解度:
为非极性分子,而为极性分子
C
用质谱仪检测气态乙酸时,谱图中出现质荷比(相对分子质量)为120的峰
两个乙酸分子通过范德华力形成了二聚体
D
离子液体有难挥发性
离子液体的粒子全都是带电荷的离子
A、A B、B C、C D、D8. 某化工厂的废液含有乙醇、苯酚、乙酸和二氯甲烷,该工厂设计回收方案如下:
下列说法错误的是
A、试剂a选择溶液比溶液更合适 B、回收物1、2分别是二氯甲烷、乙醇 C、试剂b为 , 试剂c为稀硫酸 D、操作Ⅰ、Ⅱ、Ⅲ均为蒸馏9. 下列各项中I、II两个反应不属于同一反应类型的是( )选项
反应I
反应II
A
CH3CH2OH→CH3COOCH2CH3
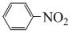
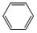 →
→
B
CH3CH2Cl→CH3CH2OH
CH3CH2OH→CH2=CH2
C
CH2=CH2→CH3CH2Cl
 →
→
D
CH3CH2OH→CH3CHO
CH3CHO→CH3COOH
A、A B、B C、C D、D10. 布洛芬具有消炎、镇痛、解热作用,但口服该药对胃、肠道有刺激性,可以对该分子进行如图所示的分子修饰。下列说法错误的是( )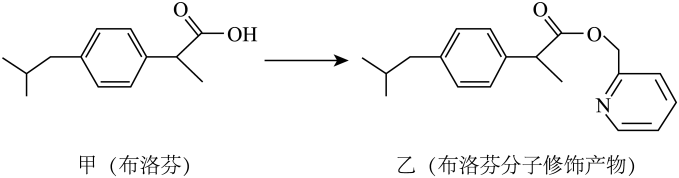 A、乙可以和强碱溶液反应,不能和强酸反应 B、甲、乙中手性碳原子数目相同 C、甲和乙都能使酸性溶液褪色 D、甲修饰成乙可降低对胃、肠道的刺激11. 2022年诺贝尔化学奖颁给了在“点击化学”领域做出贡献的科学家。一种“点击化学”试剂是由四种短周期主族元素组成,其中X、Z、W的原子序数依次递减,三者基态原子核外电子的空间运动状态数相同,Y的原子序数是Z的两倍,下列说法正确的是( )A、简单氢化物分子中的键角: B、电负性和第一电离能均有 C、同周期元素形成的简单氢化物中X稳定性最强 D、同周期主族元素基态原子未成对电子数少于Y的有2种12. 乙酸正丁酯是重要的化工原料。实验室将乙酸、正丁醇、浓硫酸加入圆底烧瓶中,加热条件下制备乙酸正丁酯的装置(加热和夹持装置已省略)和有关信息如下:
A、乙可以和强碱溶液反应,不能和强酸反应 B、甲、乙中手性碳原子数目相同 C、甲和乙都能使酸性溶液褪色 D、甲修饰成乙可降低对胃、肠道的刺激11. 2022年诺贝尔化学奖颁给了在“点击化学”领域做出贡献的科学家。一种“点击化学”试剂是由四种短周期主族元素组成,其中X、Z、W的原子序数依次递减,三者基态原子核外电子的空间运动状态数相同,Y的原子序数是Z的两倍,下列说法正确的是( )A、简单氢化物分子中的键角: B、电负性和第一电离能均有 C、同周期元素形成的简单氢化物中X稳定性最强 D、同周期主族元素基态原子未成对电子数少于Y的有2种12. 乙酸正丁酯是重要的化工原料。实验室将乙酸、正丁醇、浓硫酸加入圆底烧瓶中,加热条件下制备乙酸正丁酯的装置(加热和夹持装置已省略)和有关信息如下: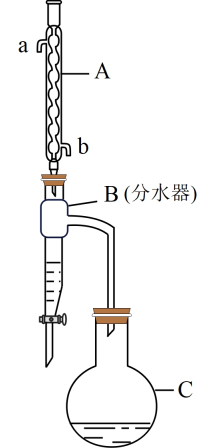
乙酸
正丁醇
乙酸正丁酯
熔点/℃
16.6
-89.5
-73.5
沸点/℃
117.9
117
126.0
密度(g/cm3)
1.1
0.80
0.88
下列说法不正确的是( )
A、实验开始时应先加热装置C,再由装置A的b口通入冷凝水 B、装置B的作用是不断分离出产生的水,使反应向正向移动,提高产率 C、当B中水层高度不再变化时,说明反应完全,这时可以停止加热 D、提纯乙酸正丁酯可采取水洗、氢氧化钠溶液洗、无水氯化钙干燥、过滤一系列操作13. 下列实验中,操作、现象及结论均正确的是( )选项
操作
现象
结论
A
将与溶液共热,冷却后,取出上层水溶液加入溶液
产生淡黄色沉淀
中含有溴原子
B
向的溶液中滴入2%的溶液4至6滴,得到新制的悬浊液,然后加入乙醛溶液 , 振荡后加热
产生砖红色沉淀
醛基具有还原性
C
将乙醇与浓硫酸共热至所得气体直接通入的溶液中
的溶液褪色
乙醇发生消去反应的产物为乙烯
D
将和反应后的气体通入苯酚钠溶液中
溶液变浑浊
碳酸的酸性比苯酚的酸性强
A、A B、B C、C D、D14. 冠醚是由多个二元醇分子之间脱水形成的环状化合物。18-冠-6可用作相转移催化剂,其与形成的螯合离子结构如图所示。下列说法错误的是( )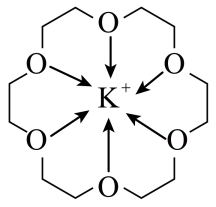 A、该鳌合离子中碳与氧原子具有相同的杂化类型 B、该螯合离子中所有非氢原子可以位于同一平面 C、该螯合离子中极性键与非极性键的个数比为7∶1 D、该螯合离子形成的晶体类型为离子晶体15. 铁镁合金储氢时分子在晶胞的棱心和体心位置,且最近的两个铁原子之间的距离为 , 晶胞结构如下图所示,下列说法错误的是( )
A、该鳌合离子中碳与氧原子具有相同的杂化类型 B、该螯合离子中所有非氢原子可以位于同一平面 C、该螯合离子中极性键与非极性键的个数比为7∶1 D、该螯合离子形成的晶体类型为离子晶体15. 铁镁合金储氢时分子在晶胞的棱心和体心位置,且最近的两个铁原子之间的距离为 , 晶胞结构如下图所示,下列说法错误的是( ) A、晶胞中铁原子的配位数为4 B、晶胞中原子的堆积方式和干冰晶体相同 C、该晶胞中距离最近的有6个 D、储氢后,该晶体的密度为
A、晶胞中铁原子的配位数为4 B、晶胞中原子的堆积方式和干冰晶体相同 C、该晶胞中距离最近的有6个 D、储氢后,该晶体的密度为二、非选择题
-
16. 元素周期表中前四周期元素R、W、X、Y、Z的原子序数依次增大,R基态原子中,电子占据的最高能层符号为L,最高能级上只有一个空的原子轨道;X单质是大气的主要成分之一;Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和;Z基态原子的最高能层只有一个电子,其他能层均已充满电子。回答下列问题:(1)、往Z的硫酸盐溶液中通入过量的 , 可生成。
①基态的价电子排布图是 , 该络合物阴离子的空间构型是。
②该化合物加热时首先失去的组分是(写化学式)。
③分子可视为分子中的一个氢原子被取代形成的另一种W的氢化物。能与硫酸反应生成 , 晶体类型为 , 的晶体内存在(填序号)。
a.离子键 b.配位键 c.共价键
(2)、一种Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。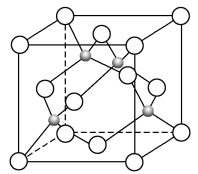
①该晶体的化学式为(用元素符号表示)。
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于(填“离子”或“共价”)化合物。
③难溶于水,易溶于氨水,原因是。
17. 按要求回答问题:(1)、对下列有机物进行命名。 (2)、分子结构中处于同一平面上的原子个数最多有个。(3)、中含有的官能团名称为。(4)、在饱和链状烷烃中,含有一个手性C原子且相对分子质量最小的烷烃有种结构。(5)、分子式为 , 已知其核磁共振氢谱表明只有一种化学环境的氢,则该有机物的结构简式为。(6)、写出由
(2)、分子结构中处于同一平面上的原子个数最多有个。(3)、中含有的官能团名称为。(4)、在饱和链状烷烃中,含有一个手性C原子且相对分子质量最小的烷烃有种结构。(5)、分子式为 , 已知其核磁共振氢谱表明只有一种化学环境的氢,则该有机物的结构简式为。(6)、写出由 在加热和催化剂作用下发生加聚反应生成有机玻璃的化学方程式。 18. 1,2-二氯乙烷是制备杀菌剂和植物生长调节剂的中间体,已知其沸点为 , 熔点为。下图为实验室中制备1,2-二氯乙烷的装置,无水乙醇的密度约为 , 其中加热和夹持装置已略去。
在加热和催化剂作用下发生加聚反应生成有机玻璃的化学方程式。 18. 1,2-二氯乙烷是制备杀菌剂和植物生长调节剂的中间体,已知其沸点为 , 熔点为。下图为实验室中制备1,2-二氯乙烷的装置,无水乙醇的密度约为 , 其中加热和夹持装置已略去。 (1)、装置A中还缺少的一种必要仪器是 , 使用冷凝管的目的是。(2)、装置A中发生主要反应的化学方程式为。(3)、装置B中玻璃管a的作用是。(4)、装置B中应加入的最佳试剂为____(填字母序号)。A、浓硫酸 B、饱和溶液 C、酸性溶液 D、溶液(5)、D中b、c两个导气管进入仪器的长度不同,其目的是。(6)、实验结束后收集得到1,2—二氯乙烷,则乙醇的利用率为%。19. H是胃炎药溴丙胺太林的合成中间体,其合成路线如图:
(1)、装置A中还缺少的一种必要仪器是 , 使用冷凝管的目的是。(2)、装置A中发生主要反应的化学方程式为。(3)、装置B中玻璃管a的作用是。(4)、装置B中应加入的最佳试剂为____(填字母序号)。A、浓硫酸 B、饱和溶液 C、酸性溶液 D、溶液(5)、D中b、c两个导气管进入仪器的长度不同,其目的是。(6)、实验结束后收集得到1,2—二氯乙烷,则乙醇的利用率为%。19. H是胃炎药溴丙胺太林的合成中间体,其合成路线如图:
已知:
 。回答下列问题:(1)、A的名称为;E的分子式为。(2)、D→E的反应类型为。(3)、F的一氯取代物有种。(4)、F→G反应的化学方程式为。(5)、B的同分异构中满足下列条件的有种(不考虑立体异构);
。回答下列问题:(1)、A的名称为;E的分子式为。(2)、D→E的反应类型为。(3)、F的一氯取代物有种。(4)、F→G反应的化学方程式为。(5)、B的同分异构中满足下列条件的有种(不考虑立体异构);①遇溶液显紫色 ②能发生银镜反应
(6)、的所有含苯环的同分异构体中,消耗的物质的量最多为。(7)、设计由邻二甲苯(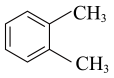 )为原料合成
)为原料合成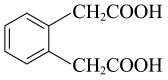 的路线(其他无机试剂任选):。 20. 我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、Ni、Cu等元素。回答下列问题:(1)、下列不同状态的硼中,失去一个电子需要吸收能量最多的是(填标号,下同),用光谱仪可捕捉到发射光谱的是。
的路线(其他无机试剂任选):。 20. 我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、Ni、Cu等元素。回答下列问题:(1)、下列不同状态的硼中,失去一个电子需要吸收能量最多的是(填标号,下同),用光谱仪可捕捉到发射光谱的是。A.
 B.
B.
C.
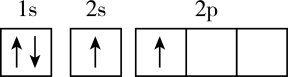
D.
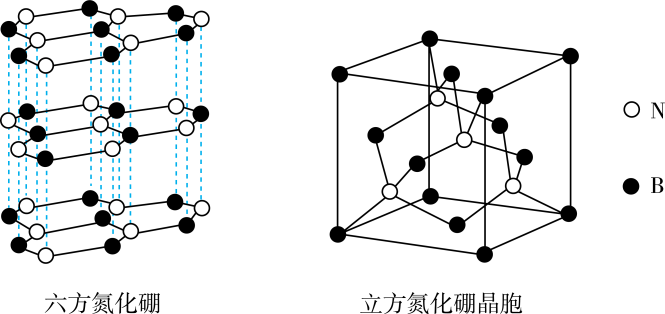
 (2)、铵盐大多不稳定。从结构的角度解释比更易分解的原因是。(3)、镍能形成多种配合物,其中是无色挥发性液体,是红黄色单斜晶体。中的配位原子是:;的熔点高于的原因是。(4)、氮化硼(BN)晶体存在如下图所示的两种结构,六方氮化硼的结构与石墨类似,可做润滑剂;立方氮化硼的结构与金刚石类似,可作研磨剂。六方氮化硼的晶体类型为;立方氮化硼晶胞的密度为 , 晶胞的边长为a cm。则阿伏加德罗常数的表达式为。
(2)、铵盐大多不稳定。从结构的角度解释比更易分解的原因是。(3)、镍能形成多种配合物,其中是无色挥发性液体,是红黄色单斜晶体。中的配位原子是:;的熔点高于的原因是。(4)、氮化硼(BN)晶体存在如下图所示的两种结构,六方氮化硼的结构与石墨类似,可做润滑剂;立方氮化硼的结构与金刚石类似,可作研磨剂。六方氮化硼的晶体类型为;立方氮化硼晶胞的密度为 , 晶胞的边长为a cm。则阿伏加德罗常数的表达式为。