湖北省荆州市监利市2022-2023学年高一下学期2月调考化学试题
试卷更新日期:2023-05-23 类型:月考试卷
一、单选题
-
1. 化学与人类历史、生产生活密切相关,下列有关说法不正确的是A、“新冠抗疫”中,用于消毒的84消毒液的有效成分为氯的含氧酸盐 B、指南针是我国的四大发明之一,制造指南针的磁性物质是 C、我国科学家首次在实验室利用合成出淀粉[],该过程涉及氧化还原反应 D、人类利用金属的历史顺序(铜→铁→铝)跟地壳中金属元素的含量有关2. 反应可用于消除和氮氧化物的污染,下列表示反应中相关微粒的化学用语正确的是A、中子数为8的氮原子: B、的结构式:N=N C、和互为同位素 D、的电子式:
 3. 下列化合物中,不能通过化合反应直接制取的是A、 B、 C、 D、NaOH4. 用NA表示阿伏加德罗常数的值,下列叙述正确的是A、1mol 作氧化剂时转移电子数一定为4NA B、常温、常压下,1.2g 晶体中含有的阳离子数为0.01NA C、相同质量的CO和含有的分子数目均为NA D、在与的反应中,固体质量每增重28g,转移电子数为2NA5. 液体铝钠合金(单质钠和单质铝熔合而成)可用于核反应堆内作载热介质,有关该合金说法不正确的是A、n g该合金投入足量的盐酸或足量的氢氧化钠溶液中,产生的氢气体积相同(标准状况) B、铝钠合金若投入一定量的水中可得到无色溶液,则物质的量关系为: C、铝钠合金投入足量氯化铜溶液中,肯定有氢氧化铜沉淀产生,也可能有铜析出 D、m g不同组成的铝钠合金投入足量的盐酸中,若放出的越多,则铝的质量分数越小6. 下列离子方程式正确的是A、氯气溶于水: B、铜片放入氯化铁溶液中: C、稀硫酸与溶液的反应: D、用稀硫酸除去某金属表面的杂质:7. 下列叙述正确的组合是
3. 下列化合物中,不能通过化合反应直接制取的是A、 B、 C、 D、NaOH4. 用NA表示阿伏加德罗常数的值,下列叙述正确的是A、1mol 作氧化剂时转移电子数一定为4NA B、常温、常压下,1.2g 晶体中含有的阳离子数为0.01NA C、相同质量的CO和含有的分子数目均为NA D、在与的反应中,固体质量每增重28g,转移电子数为2NA5. 液体铝钠合金(单质钠和单质铝熔合而成)可用于核反应堆内作载热介质,有关该合金说法不正确的是A、n g该合金投入足量的盐酸或足量的氢氧化钠溶液中,产生的氢气体积相同(标准状况) B、铝钠合金若投入一定量的水中可得到无色溶液,则物质的量关系为: C、铝钠合金投入足量氯化铜溶液中,肯定有氢氧化铜沉淀产生,也可能有铜析出 D、m g不同组成的铝钠合金投入足量的盐酸中,若放出的越多,则铝的质量分数越小6. 下列离子方程式正确的是A、氯气溶于水: B、铜片放入氯化铁溶液中: C、稀硫酸与溶液的反应: D、用稀硫酸除去某金属表面的杂质:7. 下列叙述正确的组合是①在空气中长时间放置少量金属钠,最终的产物是Na2CO3
②人们使用次氯酸盐代替氯水作为漂白剂,因为次氯酸盐的漂白性更强
③根据是否有丁达尔现象将分散系分为溶液、胶体和浊液
④在生产、生活中,铝合金是用量最大、用途最广的合金材料
⑤H2O的沸点比H2S的沸点高是因为H2O的分子间存在氢键
⑥由非金属元素形成的化合物一定是共价化合物
A、①⑤ B、②③ C、⑤⑥ D、②④8. 在澄清透明的溶液中,可以大量共存的离子组是A、、、、、 B、、、、、 C、、、、、 D、、、、9. 向含有一定物质的量的和的混合溶液中逐渐加入粉至过量,该溶液的质量随加入铁粉的质量的变化关系图为( )A、 B、
B、 C、
C、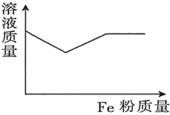 D、
D、 10. 一种高效电解质的结构如图所示,W、Y、X、Z、Q均为短周期元素,且原子序数依次增大,X与Q同族,Y和Z的原子序数之和与Q相等。下列说法正确的是( )
10. 一种高效电解质的结构如图所示,W、Y、X、Z、Q均为短周期元素,且原子序数依次增大,X与Q同族,Y和Z的原子序数之和与Q相等。下列说法正确的是( ) A、原子半径的顺序为Q>Y>X>Z>W B、简单氢化物沸点的顺序为Q>Z>X C、阴离子中所有原子均满足8电子稳定结构 D、化合物QX2、YX2均能与NaOH溶液反应11. 某碳酸钙和碳酸氢钙的混合物,滴加足量的稀盐酸反应,消耗的和生成的物质的量之比为6:5,则该混合物中碳酸钙和碳酸氢钙的物质的量之比是A、1:1 B、1:3 C、1:2 D、1:412. 下列实验装置能达到实验目的的是
A、原子半径的顺序为Q>Y>X>Z>W B、简单氢化物沸点的顺序为Q>Z>X C、阴离子中所有原子均满足8电子稳定结构 D、化合物QX2、YX2均能与NaOH溶液反应11. 某碳酸钙和碳酸氢钙的混合物,滴加足量的稀盐酸反应,消耗的和生成的物质的量之比为6:5,则该混合物中碳酸钙和碳酸氢钙的物质的量之比是A、1:1 B、1:3 C、1:2 D、1:412. 下列实验装置能达到实验目的的是 A、图A是制备胶体 B、图B是实验室制取并观察的颜色 C、图C是实验室制取 D、图D是除去中的HCl13. 我国化学家侯德榜研究出以饱和食盐水、CO2和 NH3(合成氨厂的氨气中常混有副产物CO2)为原料制备纯碱,其生产流程如下所示,下列说法不正确的是
A、图A是制备胶体 B、图B是实验室制取并观察的颜色 C、图C是实验室制取 D、图D是除去中的HCl13. 我国化学家侯德榜研究出以饱和食盐水、CO2和 NH3(合成氨厂的氨气中常混有副产物CO2)为原料制备纯碱,其生产流程如下所示,下列说法不正确的是 A、沉淀池中应先通入 NH3 , 再通入 CO2 B、流程中的 X 为 CO2 , Y 为 NH3 C、沉淀池中发生反应: D、操作 I 为过滤,母液中的一种副产品为 NH4Cl,可在农业上用作化肥14. 向200mL 溶液中逐渐通入 , 其中、随通入的变化如图所示,下列说法不正确的是
A、沉淀池中应先通入 NH3 , 再通入 CO2 B、流程中的 X 为 CO2 , Y 为 NH3 C、沉淀池中发生反应: D、操作 I 为过滤,母液中的一种副产品为 NH4Cl,可在农业上用作化肥14. 向200mL 溶液中逐渐通入 , 其中、随通入的变化如图所示,下列说法不正确的是 A、氧化性强弱: B、由图可知,该溶液的浓度为1 C、时,溶液中的离子浓度有: D、时,反应的离子方程式为:15. 向100mL 1.0mol/L的硫酸溶液中投入一定量的Fe、和CuO的混合物,充分反应后生成448mL标准状况下的气体,得不溶物0.03mol。向滤液中加入2mol/L的NaOH溶液,加至20mL时开始出现沉淀。忽略溶液的体积变化,下列说法不正确的A、不溶物全为Cu,物质的量为0.03mol B、混合物中氧原子的物质的量为0.06mol C、滤液中的阳离子有、、 D、滤液中的的物质的量浓度为0.8mol/L
A、氧化性强弱: B、由图可知,该溶液的浓度为1 C、时,溶液中的离子浓度有: D、时,反应的离子方程式为:15. 向100mL 1.0mol/L的硫酸溶液中投入一定量的Fe、和CuO的混合物,充分反应后生成448mL标准状况下的气体,得不溶物0.03mol。向滤液中加入2mol/L的NaOH溶液,加至20mL时开始出现沉淀。忽略溶液的体积变化,下列说法不正确的A、不溶物全为Cu,物质的量为0.03mol B、混合物中氧原子的物质的量为0.06mol C、滤液中的阳离子有、、 D、滤液中的的物质的量浓度为0.8mol/L二、非选择题
-
16. 有如下物质:①Na;②NaOH溶液;③固体;④;⑤酒精();⑥蒸馏水;⑦溶液;⑧晶体。(1)、以上物质中,属于电解质的是(填序号,右同),属于非电解质的是。(2)、将②与⑦进行混合,该过程中发生反应的离子方程式是。(3)、向氢氧化钡溶液中加入物质③的溶液至恰好沉淀完全,其离子方程式为。(4)、向100mL②溶液中通入一定量的④,然后向该溶液中逐滴加入2的盐酸,所加盐酸的体积与产生的体积(标准状况)关系如图所示:
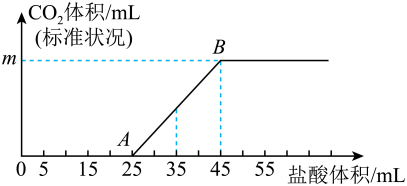
回答下列问题:
①0A段发生反应的离子方程式为。
②m=mL。
③原②溶液的物质的量浓度为。
(5)、将0.1mol⑤在足量氧气中充分燃烧,再将全部产物缓慢通过足量的固体,固体质量增加g。17. 高铁酸钾( , g/mol)是一种高效多功能的绿色消毒剂,在新冠疫情期间大显身手。【查阅资料】为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生。
(1)、I.湿法制备(夹持装置略)
装置A中所用浓盐酸浓度为11.6mol/L,现欲用其配制100mL,0.6mol/L的稀溶液。则需量取mL浓溶液,量取所用量筒的规格是(填“10mL”“25mL”或“50mL”)。若所配制的稀溶液浓度偏大,则可能的原因是(填字母)。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓溶液时,仰视液面
C.未经冷却,立即转移至容量瓶定容 D.定容时,仰视液面
(2)、A中发生反应的化学方程式是。(3)、下列试剂中,装置B的X溶液可以选用的是____(填字母)。A、饱和食盐水 B、浓盐酸 C、氢氧化钠溶液 D、饱和溶液(4)、C中得到紫色固体和溶液,生成的化学方程式是。(5)、II.干法制备高铁酸钾分两步进行第一步反应为: , 该反应氧化剂和还原剂的物质的量之比为;
第二步反应为:
(6)、实验室用100mL 2.00 溶液发生上述反应,产品经干燥后得到纯品35.0g,则的产率为(保留一位小数)。18. 刚玉在工业上有广泛的用途,其主要成分为氧化铝。利用铝灰(主要成分为 , 含少量杂质、FeO、)制备刚玉的工艺流程如下:
已知:是酸性氧化物,且不与水反应。
回答下列问题:
(1)、滤渣的主要成分是(填化学式);过滤时用到的玻璃仪器有漏斗、烧杯和。(2)、“氧化”操作的目的为 , 该过程中发生反应的离子方程式为。(3)、已知:生成氢氧化物沉淀的pH如下表所示。氢氧化物
开始沉淀时
3.4
6.3
1.5
完全沉淀时
4.7
8.3
2.8
用氨水“调节pH”,pH的范围是。
(4)、写出用氨水调节pH生成沉淀的离子方程式:。(5)、往中滴加NaOH溶液,可以看到沉淀溶解,写出反应的化学方程式:。19. 下表为元素周期表的一部分,回答下列问题。IA
0
1
①
IIA
IIIA
IVA
VA
VIA
VIIA
2
②
③
④
3
⑤
⑥
⑦
⑧
⑨
⑩
(1)、画出元素⑥的原子结构示意图:。(2)、关于⑩所在主族的单质及化合物的叙述错误的是____(填字母)。A、从上到下,单质颜色越来越深,熔、沸点越来越高 B、单质均可与水发生反应生成两种酸 C、单质均具有强氧化性,能将Fe氧化成 D、氢化物均易溶于水,且均为强酸(3)、①与⑤可以形成(填“共价”或“离子”)化合物,用电子式表示其形成过程为。(4)、④与⑨非金属性较强的是(填元素符号),请从原子结构的角度解释原因:。(5)、为了探究元素②、③、⑦的非金属性强弱,该兴趣小组又设计如下装置,实验所用到的物质有:稀、稀盐酸、碳酸钙、溶液、饱和溶液,已知不溶于水。据此回答以下问题。
分液漏斗内装入的试剂为(填物质名称),B中装入的试剂为(填物质名称),烧杯C中发生反应的离子方程式为。