河南省高中名校联考2022-2023学年高一3月调研考试化学试题
试卷更新日期:2023-05-23 类型:月考试卷
一、单选题
-
1. 下列河南博物院的展品中,由金属材料制成的是
展品




选项
A.贾湖骨笛
B.彩陶双连壶
C.编钟
D.四人头神兽画像石
A、A B、B C、C D、D2. 下列物质属于电解质的是A、液氯 B、硝酸钾 C、牛奶 D、氯化铝溶液3. 我国科研团队采用和(铪)熔合蒸发技术合成了新核素。下列说法错误的是A、、互为同位素 B、含有142个中子 C、化学性质不活泼 D、的核电荷数为1764. 下列转化中,需要加入氧化剂才能实现的是A、FeCl2→FeCl3 B、→CO2 C、I2→I- D、→Cr3+5. 下列有关试剂的保存方法不正确的是A、Na保存于煤油中 B、过氧化钠应密封保存 C、氯水保存于无色试剂瓶中 D、浓硫酸保存于铁质容器中6. 下列有关物质的性质与用途具有对应关系的是A、钠具有还原性,液态钠可用作核反应堆的传热介质 B、具有漂白性,可在呼吸面具中作为氧气的来源 C、HClO具有弱酸性,可用作棉、麻和纸张的漂白剂 D、具有氧化性,可用于蚀刻铜电路板7. 实验室需要460mL0.20mol∙L-1Na2CO3溶液,某同学配制过程如图所示。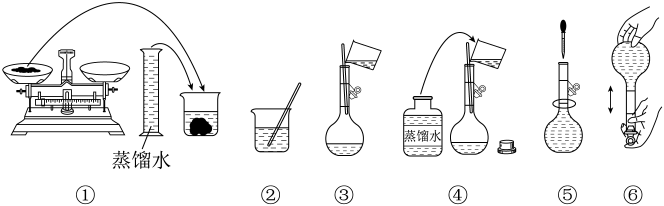
下列关于该实验的叙述错误的是
A、将药品放在称量纸上称取10.6gNa2CO3固体 B、Na2CO3固体在烧杯中完全溶解后,恢复至室温转移到容量瓶中定容 C、⑤中定容时俯视刻度线会导致溶液浓度偏低 D、容量瓶不宜长期贮存配制好的溶液8. 在给定条件下,下列物质间转化不能实现的是A、饱和NaCl(aq)NaHCO3(s)Na2CO3(s) B、NH3(g)NO(g)NO2(g) C、Fe(s)Fe3O4(s)FeO(s) D、FeS2(s)SO2(g)SO3(g)9. 下列对应离子方程式书写正确的是A、铜溶于稀硝酸:Cu+4HNO3=Cu2++2NO+2H2O+2NO2↑ B、向Al2O3中滴加NaOH溶液:Al2O3+2OH-=2AlO+H2O C、将少量Na2O2投入水中:Na2O2+H2O=2Na++2OH-+O2↑ D、向水中通入适量Cl2:Cl2+H2O2H++Cl-+ClO-10. 向100mLFe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示(忽略溶液体积的变化)。下列说法正确的是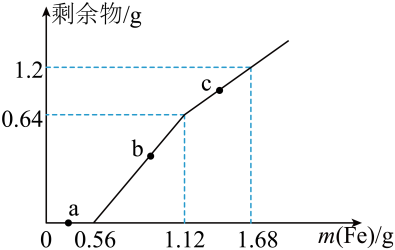 A、a点时溶液中阳离子只有Cu2+、Fe2+ B、b点时溶液中发生的反应为Fe+2Fe3+=3Fe2+ C、c点时溶液中溶质的物质的量浓度为0.4mol∙L-1 D、原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为2∶111. 下列实验或装置能达到实验目的的是
A、a点时溶液中阳离子只有Cu2+、Fe2+ B、b点时溶液中发生的反应为Fe+2Fe3+=3Fe2+ C、c点时溶液中溶质的物质的量浓度为0.4mol∙L-1 D、原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为2∶111. 下列实验或装置能达到实验目的的是A
B
C
D
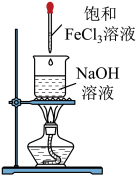
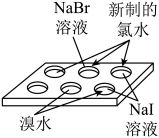

制备氢氧化铁胶体
比较卤素单质氧化性强弱
洗气除去SO2中的CO2
测浓硫酸的pH
A、A B、B C、C D、D12. 用NA表示阿伏加德罗常数的值。下列说法正确的是A、1.9gH3O+中含有的质子数为NA B、53.5gNH4Cl中含有的共价键数目为4NA C、1molCu与足量S充分反应,转移的电子数为NA D、标准状况下,22.4LCl2溶于足量水中得到HClO的数目为NA13. 某化学研究小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Ag+、Ca2+、CO、SO、Cl-中的若干种离子。该小组同学取部分水样进行实验。①向水样中先滴加足量硝酸钡溶液,产生白色沉淀;②再滴加足量稀盐酸,沉淀部分溶解;③最后滴加硝酸银溶液,又产生白色沉淀。下列说法正确的是A、经过实验可以确定一定不存在的离子有5种 B、经过实验可以确定一定存在的离子是K+、CO、SO、Cl- C、步骤②中发生反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O D、步骤③中发生反应的离子方程式为Ag++Cl-=AgCl↓14. 短周期主族元素W、Q、X、Y、Z的原子序数依次增大;灰黑色晶体Y的导电性介于导体和绝缘体之间,一种制备晶体Y的路线如图所示,通常状态下YW4呈气态且W的单质是最清洁能源。YQ2X2YYW4Y的单质
下列说法正确的是
A、常温下,W与Q形成的化合物为液态 B、X的最高价氧化对应的水化物是强酸 C、ZQ2可用于自来水消毒 D、YW4中仅含离子键15. 以MgCl2为原料可生产碱式碳酸镁[Mgx(OH)y(CO3)z·pH2O]。某研究性学习小组称取碱式碳酸镁4.66g,高温煅烧至恒重,得到2.00gMgO和标准状况下0.896LCO2。下列说法错误的是A、x、y、z存在电荷守恒关系2x=y+2z B、碱式碳酸镁具有阻燃作用的原因之一是高温下有CO2生成 C、碱式碳酸镁的化学式为Mg5(OH)2(CO3)4·4H2O D、由以上数据无法计算碱式碳酸镁的化学式二、非选择题
-
16. 氮、硫、硅等非金属元素在工农业生产中有重要应用。回答下列问题:(1)、二氧化硫、氮氧化物大量逸散到空气中,容易引发 , 能直接损伤农作物,加速建筑物的腐蚀。(2)、向蔗糖中加入浓硫酸会产生“黑面包”现象并有难闻气味,产生难闻气味说明浓硫酸在反应中(填“被氧化”或“被还原”)。(3)、将SO2通入品红溶液中,品红溶液褪色;将该溶液放置在酒精灯上加热,溶液又恢复成红色的原因为。(4)、实验室用加热亚硝酸钠和氯化铵的饱和溶液的方法制取氮气,写出该反应的化学方程式并用双线桥表示电子转移的方向和数目:。(5)、NO2不能用排水集气法收集的原因为(用化学方程式表示)。(6)、碳化硅俗称金刚砂,属于(填“有机高分子材料”或“无机非金属材料”)。17. 元素周期表是学习化学的重要工具。A~H为短周期主族元素,其原子半径一原子序数一最高正化合价(或最低负化合价)的关系如图所示。
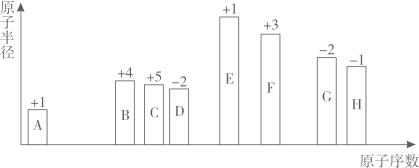
回答下列问题:
(1)、F原子的结构示意图为;写出质量数为35的H原子符号:。(2)、B、D形成的化合物BD2的空间结构为 , 其电子式为。(3)、A与H形成的化合物属于(填“离子”或“共价”)化合物;元素B、G、H的最高价氧化物的水化物中,酸性由大到小的是(用“>”连接化学式)。(4)、C、D、E的简单离子半径由大到小顺序为(填离子符号)。(5)、元素G的简单气态氢化物与GD2的水溶液反应的实验现象为。(6)、E、F最高价氧化物对应的水化物之间发生反应的离子方程式为。18. 化学为人类日常生活提供了很多便利,氯及其化合物在人类的生活中占有重要地位。回答下列问题:(1)、Ⅰ.如图是氯元素的“价类二维图”。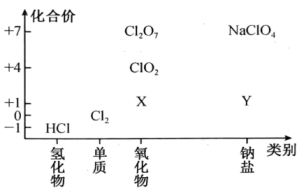
X的化学式为;Cl2O7为(填“酸性”“碱性”或“两性”)氧化物。
(2)、巴西奥运会期间,由于工作人员将以Y为有效成分的消毒液与双氧水混用,导致游泳池藻类快速生长,其反应的化学方程式为。(3)、下列物质常用于杀菌消毒,其中消毒原理与HClO相同的是____(填字母)。A、O3 B、酒精 C、熟石灰 D、KMnO4(4)、Ⅱ.某实验小组用如图装置制备Cl2 , 并验证Cl2的部分性质。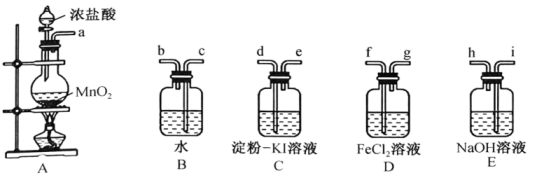
盛放浓盐酸的仪器名称为 , 写出制备氯气的化学方程式:。
(5)、根据装置C中淀粉-KI溶液变蓝可验证非金属性:Cl(填“>”“<”或“=”)I。(6)、装置D中的实验现象为 , 说明Cl2具有氧化性;实验中未被反应的Cl2用装置E吸收,g应连接(填“h”或“i”)口。(7)、该实验小组利用上述装置B中的新制氯水进行如图实验。操作
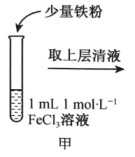
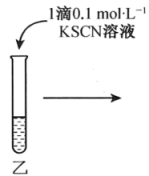
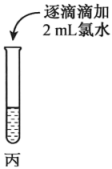
现象
溶液由棕黄色变为浅绿色
无明显现象
溶液变为红色,而后红色褪去
探究丙中的褪色原因,该实验小组同学提出两种假设:a.铁离子被氧化;b.SCN-被氧化。
①取两支试管分别加入褪色后的溶液,滴加0.1mol∙L-1的FeCl3溶液和KSCN溶液各1滴,观察到现象,得出结论:假设b成立。
②进一步预测SCN-可能被转化为 , 通过实验验证了该预测,写出实验操作及现象:。
19. 以含铝、铁烧渣(主要成分为Al2O3、Fe2O3 , 含少量FeO、SiO2)为原料制备聚合碱式硫酸铝铁{[FeaAlb(OH)x(SO4)y]n}或明矾[KAl(SO4)2·12H2O]的流程如图所示: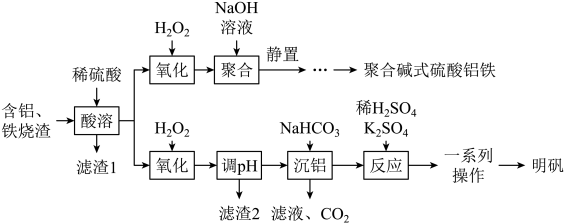
回答下列问题:
(1)、滤渣1的用途为(任写一种)。(2)、“酸溶”后溶液中含有的阳离子为。(3)、“氧化”时发生反应的离子方程式为。(4)、“调pH”的目的是。(5)、“沉铝”中加入NaHCO3的目的是将Al3+转化为Al(OH)3 , 写出该反应的离子方程式:。(6)、根据不同温度KAl(SO4)2·12H2O的溶解度(如表),“一系列操作”应包括蒸发浓缩、、过滤、洗涤、干燥等。温度/℃
0
10
20
30
40
60
80
90
KAl(SO4)2·12H2O/g
3.00
3.99
5.90
8.39
11.7
24.8
71.0
109