山西省名校2022-2023学年高二下学期联合考试化学试题
试卷更新日期:2023-05-23 类型:月考试卷
一、单选题
-
1. 化学与生活联系紧密。下列有关叙述错误的是A、废旧镍镉电池属于有害垃圾 B、CO2排放过多会导致温室效应 C、钢铁在潮湿环境中易发生电化学腐蚀 D、BaCO3可用作医疗上肠胃检查的“钡餐”2. 下列物质溶于水的电离方程式书写正确的是A、 B、 C、 D、3. 某电解池装置如图所示,电解质溶液为等浓度的、、混合溶液,则电解一段时间后(溶液有剩余),阴极可能得到的产物依次为
 A、Cu、 B、Cu、、Na C、、 D、、Cu4. 下列说法正确的是A、3s2表示3s能级有2个轨道 B、p能级的能量一定比s能级的能量高 C、在离核越近区域内运动的电子,能量越低 D、1个原子轨道里,最少要容纳2个电子5. 室温下,下列各组离子在指定溶液中能大量共存的是A、溶液:、、 B、溶液:、、 C、加入甲基橙后变红的溶液:、、 D、溶液:、、6. 根据实验测定,某容器中同时发生甲和乙两个反应:
A、Cu、 B、Cu、、Na C、、 D、、Cu4. 下列说法正确的是A、3s2表示3s能级有2个轨道 B、p能级的能量一定比s能级的能量高 C、在离核越近区域内运动的电子,能量越低 D、1个原子轨道里,最少要容纳2个电子5. 室温下,下列各组离子在指定溶液中能大量共存的是A、溶液:、、 B、溶液:、、 C、加入甲基橙后变红的溶液:、、 D、溶液:、、6. 根据实验测定,某容器中同时发生甲和乙两个反应:反应甲:
反应乙:
该容器中的反应达到平衡后,下列措施中一定能提高平衡体系中CH3OH的百分含量的是
A、降低温度 B、使用催化剂 C、扩大容器体积 D、在原料气中加入H2O(g)7. 氨的催化氧化反应为 , 下列说法正确的是A、非金属性:N>O>H B、稳定性: C、中所有原子均满足8电子结构 D、基态原子的未成对电子数:N>O>H8. T℃时,在某恒压密闭容器中充入2molSO2(g)、1molO2(g),发生反应 , 达到平衡时,O2(g)的物质的量分数为 , 下列说法可以说明该反应达到平衡的是A、容器内的压强不再发生变化时 B、容器内气体的密度不变时 C、SO3(g)的体积分数为40%时 D、SO2(g)的转化率为50%时9. 若X3+的价层电子排布式为3d3 , 则下列说法正确的是A、X为25号元素Mn B、基态X原子中的电子有14种空间运动状态 C、X是同周期中未成对电子数最多的元素 D、X在元素周期表中的位置为第四周期第ⅣB族10. 设为阿伏加德罗常数的值,下列说法正确的是A、室温下,的溶液中含有的数目为 B、1L溶液中含有的、数目之和为 C、室温下,的溶液中,由水电离出的数目为 D、电解精炼铜时,当阳极质量减轻64g时,导线中转移的电子数为11. 关于下列装置的叙述正确的是选项
A
B
C
D
装置




叙述
用牺牲阳极保护法防止铁管道被腐蚀
在铁极附近放置一片湿润的淀粉―KI试纸,试纸变蓝
铅蓄电池充电时,阴极的质量减小
电子从Fe电极流出
A、A B、B C、C D、D12. 合成氨反应是一种有效的工业固氮方法,解决了数亿人口生存问题。诺贝尔奖获得者埃特尔提出了合成氨反应吸附解离的机理,通过实验测得合成氨过程中能量(E)变化如图所示,其中吸附在催化剂表面的物种用“ad”表示。下列说法正确的是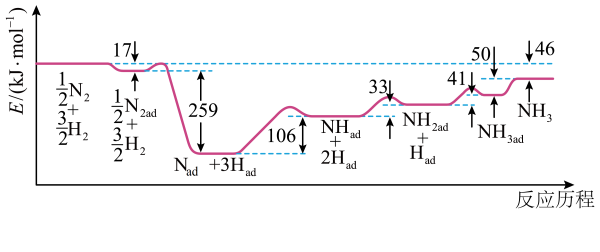 A、该反应中,反应物总能量比反应产物的总能量高 B、该反应历程中的决速步骤为 C、使用催化剂后,合成氨反应的和活化能均改变 D、工业上通常让合成氨反应在高温高压条件下进行来提高的平衡产率13. 根据相应的图像,下列相关说法正确的是
A、该反应中,反应物总能量比反应产物的总能量高 B、该反应历程中的决速步骤为 C、使用催化剂后,合成氨反应的和活化能均改变 D、工业上通常让合成氨反应在高温高压条件下进行来提高的平衡产率13. 根据相应的图像,下列相关说法正确的是 A、图甲:醋酸溶液加水稀释,醋酸的电离程度:p点大于q点 B、图乙:等体积、等pH的盐酸和氢氟酸溶液加水稀释,由水电离出的浓度:a点<b点 C、图丙: , 、、对应的平衡常数K的大小: D、图丁:的 ,14. 是一种极为活泼的卤素气体,在制冷、化学工业中有着广泛应用。可通过电解的无水HF溶液制备,该过程有两种气体生成。下列说法正确的是A、该反应生成了、 B、电解一段时间后,阴、阳两极生成的气体质量之比为1∶19 C、电解过程中转移1mol电子时,生成的气体体积为22.4L D、一段时间后,加入一定量的固体,可使电解液恢复到电解前的状态15. 硫化锌(ZnS)和硫化铅(PbS)常用于光导体、半导体工业,它们在水中的沉淀溶解平衡曲线如图所示。已知: , M为Zn或Pb,pM表示。下列说法正确的是
A、图甲:醋酸溶液加水稀释,醋酸的电离程度:p点大于q点 B、图乙:等体积、等pH的盐酸和氢氟酸溶液加水稀释,由水电离出的浓度:a点<b点 C、图丙: , 、、对应的平衡常数K的大小: D、图丁:的 ,14. 是一种极为活泼的卤素气体,在制冷、化学工业中有着广泛应用。可通过电解的无水HF溶液制备,该过程有两种气体生成。下列说法正确的是A、该反应生成了、 B、电解一段时间后,阴、阳两极生成的气体质量之比为1∶19 C、电解过程中转移1mol电子时,生成的气体体积为22.4L D、一段时间后,加入一定量的固体,可使电解液恢复到电解前的状态15. 硫化锌(ZnS)和硫化铅(PbS)常用于光导体、半导体工业,它们在水中的沉淀溶解平衡曲线如图所示。已知: , M为Zn或Pb,pM表示。下列说法正确的是 A、曲线Ⅱ代表PbS的沉淀溶解平衡曲线 B、n、q两点溶液中的:n<q C、图中m点和n点对应的关系为 D、向m点对应的悬浊液中加入少量固体,溶液组成由m沿mn曲线向n方向移动
A、曲线Ⅱ代表PbS的沉淀溶解平衡曲线 B、n、q两点溶液中的:n<q C、图中m点和n点对应的关系为 D、向m点对应的悬浊液中加入少量固体,溶液组成由m沿mn曲线向n方向移动二、非选择题
-
16. X、Y、Z、W、M是原子序数依次增大的5种短周期元素。非金属元素X的核外电子数等于其周期数;Y的基态原子最外层有3个未成对电子;Z元素的电负性是同周期中最大的;W元素原子核外s能级上的电子总数与p能级上的电子总数相等;基态M原子的3p轨道上有4个电子。请回答下列问题:(1)、写出各元素的元素符号:X , Y。(2)、Y、Z、W、M的简单离子半径由大到小的顺序为(填离子符号)。(3)、X、Y、Z、W的电负性由大到小的顺序为(填元素符号,下同)。(4)、Z与M相比第一电离能比较大的是 , 其基态原子的电子排布式为。(5)、X~M中某种元素的部分电离能(用、……表示,单位)数据如表:
I
……
电离能
738
1451
7733
10540
①由此可判断该元素是(填元素符号),其最高正价为。
②该元素的电离能越来越大的原因是。
17. 我国在应对气候变化的工作中取得显著成效,承诺2030年前实现“碳达峰”,2060年前实现“碳中和”,北京冬奥会更是首个实现“碳中和”的世界级体育盛会。因此,如何高效利用成为重要的研究课题。(1)、Ⅰ.光合作用[]植物光合作用中能量的转化形式为;已知植物通过光合作用每吸收1mol需要吸收的能量约为470kJ,若某植物通过光合作用大约吸收了kJ能量,则吸收的为g。
(2)、“人工树叶”电化学装置如图1所示(以稀硫酸为电解质溶液),该装置能将和转化为糖类(用表示)和。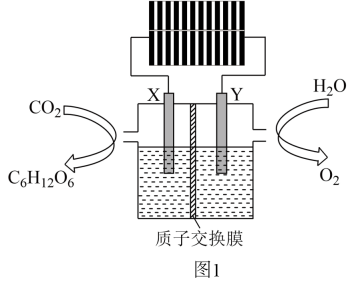
①该装置涉及的能量转换形式为。
②X为(填“阴极”或“阳极”),阳极上发生的电极反应为。
③室温下,该装置工作一段时间后,电解质溶液的pH(填“升高”、“降低”或“不变”)
(3)、Ⅱ.电化学方法可将有效地转化为 , 电化学装置如图2所示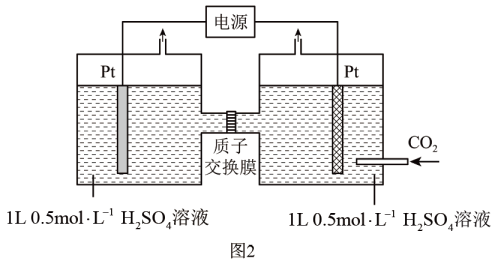
该装置工作时,阴极上发生的电极反应为。
(4)、已知该装置工作时,阴极上除有生成外,还可能有副产物生成降低电解效率。(电解效率=),测得阴极区内的 , 电解效率为75%,则阳极生成的气体在标准状况下的体积为L。(忽略电解前后溶液的体积变化)18. 硫代硫酸钠俗称“海波”,又名“大苏打”,溶液具有弱碱性和较强的还原性,是一种重要的化工产品。某化学兴趣小组利用如图装置制备硫代硫酸钠晶体(Na2S2O3∙5H2O)并测定其纯度。请回答下列问题:Ⅰ.【查阅资料】
①Na2S2O3∙5H2O是无色透明晶体,易溶于水。
②向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3。
Ⅱ.【制备产品】实验装置如图所示(夹持装置省略):
 (1)、制备 Na2S2O3∙5H2O:
(1)、制备 Na2S2O3∙5H2O:①仪器a的名称为。
②装置A中发生反应的离子方程式是 , 实验室内制备SO2时一般采用质量分数为70%的硫酸而不用98%的浓硫酸,原因是。
(2)、测定纯度:原理为。准确称取mg得到的产品,用适量蒸馏水溶解并配成250mL溶液,取25mL于锥形瓶中,加入几滴淀粉溶液,用0.1000mol∙L-1碘的标准溶液进行滴定。①用(填“酸式”或“碱式”)滴定管盛放碘的标准溶液,滴定至终点的现象是。
②滴定起始和滴定终点的液面位置如图所示,则消耗碘的标准溶液的体积V=mL,产品的纯度是(用含m、M的代数式表示)%。(设Na2S2O3∙5H2O的摩尔质量为M g∙mol-1)

③滴定前,仰视液面读数,滴定后俯视液面读数,则所测产品的纯度(填“偏高”、“偏低”或“无影响”)。
19. 选择性催化还原法(SCR)技术是目前国际上主流高效去除尾气中NOx起始终点的技术路线,主要用于还原尾气中的NOx。在一定温度范围内,催化剂将NOx分解成无害的氮气(N2)和水(H2O),同时,在SCR催化剂的末端涂覆ASC(氨氧化催化剂),将未反应完全的氨气氧化,防止氨气泄露。其反应原理及主要方程式如图所示:
SCR标准主反应:
SCR辅助反应:
ASC反应:
反应Ⅰ:
反应Ⅱ:
请回答下列问题:
(1)、由上述反应可知,SCR标准主反应的△H1=kJ∙mol-1 , 该反应在(填“高温”、“低温”或“任意温度”)条件下能自发进行。(2)、在密闭容器中进行SCR标准主反应时,氨氮比[]与温度均会影响该反应的脱硝效率(单位时间内脱除的NOx量与未经脱硝前烟气中所含NOx量的百分比),其关系如图所示:
①根据图像信息判断,脱硝的最佳条件是。
②氨氮比一定时,在400℃脱硝效率最大,其可能的原因是。
③当时,烟气中的NO含量反而增大,主要原因是。
(3)、T℃时,在2L恒容密闭容器中充入1molNO、1molNO2和2molNH3 , 仅发生SCR辅助反应: , 5min时反应达到平衡,测得N2的物质的量分数为 , 体系压强为。①在0~5min内, , NO的平衡转化率为。
②T℃时,该反应的压强平衡常数Kp=MPa(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。