甘肃省张掖市2022-2023学年高二下学期第一次全市联考化学试题
试卷更新日期:2023-05-23 类型:月考试卷
一、单选题
-
1. 化学与生产、生活密切相关。下列说法不正确的是A、锅炉水垢中含有的CaSO4可先用Na2CO3溶液处理,再用酸除去 B、工业电解精炼铜用粗铜作阴极,纯铜作阳极 C、泡沫灭火剂中的硫酸铝溶液与碳酸氢钠溶液混合后能发生双水解反应 D、打开汽水瓶盖时有大量气泡冒出,可用勒夏特列原理解释2. 下列说法或表示方法中正确的是A、等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多 B、氢气的燃烧热为285.8kJ·mol-1 , 则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8kJ·mol-1 C、Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0 D、已知中和热ΔH=-57.3kJ·mol-1 , 若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量要大于57.3kJ3. 下列化学用语表示正确的是( )A、在水中的电离方程式: B、在水中的水解方程式: C、表示燃烧热的热化学方程式: D、可逆反应的平衡常数:4. 利用如图所示装置测定盐酸与氢氧化钠溶液反应的中和热,下列说法正确的是
 A、向盐酸中加入氢氧化钠溶液时沿玻璃棒缓慢倒入 B、揭开杯盖,用玻璃棒搅拌,让溶液混合均匀 C、用环形铜丝搅拌棒代替环形玻璃搅拌棒,不影响实验结果 D、改用等浓度的氨水代替氢氧化钠溶液测出的△H偏大5. 下列关于原电池和电解池的叙述正确的是A、原电池中失去电子的电极为阴极 B、原电池的负极、电解池的阳极都发生氧化反应 C、原电池的两极一定是由活动性不同的两种金属组成 D、电解时电解池的阳极一定是阴离子放电6. 常温下,是一种红色液体,具有强氧化性,能除去空气中微量的。发生反应为。在刚性密闭容器中充入适量和(1)发生上述反应。下列说法正确的是A、其他条件不变,充入瞬间,正反应速率增大,逆反应速率减小 B、其他条件不变,充入“稀有气体”,正反应速率减小,逆反应速率增大 C、其他条件不变,再充入少量 , 正反应速率先增大,后减小 D、其他条件不变,升温(成加入催化剂),反应物活化分子百分率增大7. 在一定温度下发生反应: , 达平衡后,改变下列条件可使混合气体颜色加深的是A、使用催化剂 B、缩小容器的容积 C、降温 D、充入氮气8. 常温下,下列各组离子在指定溶液中一定能大量共存的是A、在 mol/L的溶液中:、、、 B、由水电离的mol/L溶液中:、、、 C、pH=1的溶液中:、、、 D、使甲基橙变黄的溶液中:、、、9. 下列说法不正确的是A、反应在低温下能自发进行,说明该反应的 B、非自发反应就是不可能发生的反应,自发反应就是能较快进行的反应 C、反应的限度越大,说明平衡时产物所占比例越高 D、若温度改变,则可逆反应的平衡常数一定改变10. 运用DFT计算研究HCOOH在不同催化剂(Pd和Rh)表面分解产生H2的部分反应历程如图所示,其中吸附在催化剂表面的物种用*表示。下列说法不正确的是
A、向盐酸中加入氢氧化钠溶液时沿玻璃棒缓慢倒入 B、揭开杯盖,用玻璃棒搅拌,让溶液混合均匀 C、用环形铜丝搅拌棒代替环形玻璃搅拌棒,不影响实验结果 D、改用等浓度的氨水代替氢氧化钠溶液测出的△H偏大5. 下列关于原电池和电解池的叙述正确的是A、原电池中失去电子的电极为阴极 B、原电池的负极、电解池的阳极都发生氧化反应 C、原电池的两极一定是由活动性不同的两种金属组成 D、电解时电解池的阳极一定是阴离子放电6. 常温下,是一种红色液体,具有强氧化性,能除去空气中微量的。发生反应为。在刚性密闭容器中充入适量和(1)发生上述反应。下列说法正确的是A、其他条件不变,充入瞬间,正反应速率增大,逆反应速率减小 B、其他条件不变,充入“稀有气体”,正反应速率减小,逆反应速率增大 C、其他条件不变,再充入少量 , 正反应速率先增大,后减小 D、其他条件不变,升温(成加入催化剂),反应物活化分子百分率增大7. 在一定温度下发生反应: , 达平衡后,改变下列条件可使混合气体颜色加深的是A、使用催化剂 B、缩小容器的容积 C、降温 D、充入氮气8. 常温下,下列各组离子在指定溶液中一定能大量共存的是A、在 mol/L的溶液中:、、、 B、由水电离的mol/L溶液中:、、、 C、pH=1的溶液中:、、、 D、使甲基橙变黄的溶液中:、、、9. 下列说法不正确的是A、反应在低温下能自发进行,说明该反应的 B、非自发反应就是不可能发生的反应,自发反应就是能较快进行的反应 C、反应的限度越大,说明平衡时产物所占比例越高 D、若温度改变,则可逆反应的平衡常数一定改变10. 运用DFT计算研究HCOOH在不同催化剂(Pd和Rh)表面分解产生H2的部分反应历程如图所示,其中吸附在催化剂表面的物种用*表示。下列说法不正确的是 A、HCOOH吸附在催化剂表面是一个吸热过程 B、HCOO*+H*═CO2+2H*是该历程的决速步骤 C、该反应过程中存在C-H键的断裂和C=O键的生成 D、Pd和Rh作催化剂时HCOOH分解产生H2的反应热相同11. 恒温恒容密闭容器中充入1 mol CO2和3 mol H2 , 一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得其中CO2和CH3OH(g)浓度随时间变化如图。下列说法错误的是
A、HCOOH吸附在催化剂表面是一个吸热过程 B、HCOO*+H*═CO2+2H*是该历程的决速步骤 C、该反应过程中存在C-H键的断裂和C=O键的生成 D、Pd和Rh作催化剂时HCOOH分解产生H2的反应热相同11. 恒温恒容密闭容器中充入1 mol CO2和3 mol H2 , 一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得其中CO2和CH3OH(g)浓度随时间变化如图。下列说法错误的是 A、该密闭容器的体积为1 L B、反应达平衡,氢气的转化率为75% C、反应达平衡,氢气平均反应速率0.075 mol/(L·min) D、CO2或H2O物质的量不再改变时反应达平衡12. 下列叙述与图象相符的是
A、该密闭容器的体积为1 L B、反应达平衡,氢气的转化率为75% C、反应达平衡,氢气平均反应速率0.075 mol/(L·min) D、CO2或H2O物质的量不再改变时反应达平衡12. 下列叙述与图象相符的是


 A、图①表示反应2SO2(g)+O2(g) 2SO3(g)达到平衡后在t0时刻充入了一定量的SO3 B、图②可满足反应2SO2(g)+O2(g) 2SO3(g) ΔH<0 C、图③表示反应aA(g)+bB(g) cC(g),在容器中充入1molA和1molB,经过相同时间容器中A的百分含量随温度的变化,可知反应ΔH>0 D、图④表示反应aA(g)+bB(g) cC(g)平衡时A的百分含量随压强的变化,可知E点v(逆)>v(正)13. 25˚C时,下列有关电解质溶液的说法正确的是A、0.1mol/L NaHCO3溶液中:c(Na+)=c()+c() B、将CH3COONa溶液从25˚C升温至60˚C,溶液中增大 C、常温下,将1mL 1×10-6mol/L盐酸稀释至1000mL,所得溶液的pH约为9 D、物质的量浓度相同的①NH4Cl溶液 ②NH4HCO3溶液,():①>②14. 下列图示与对应的叙述相符的是
A、图①表示反应2SO2(g)+O2(g) 2SO3(g)达到平衡后在t0时刻充入了一定量的SO3 B、图②可满足反应2SO2(g)+O2(g) 2SO3(g) ΔH<0 C、图③表示反应aA(g)+bB(g) cC(g),在容器中充入1molA和1molB,经过相同时间容器中A的百分含量随温度的变化,可知反应ΔH>0 D、图④表示反应aA(g)+bB(g) cC(g)平衡时A的百分含量随压强的变化,可知E点v(逆)>v(正)13. 25˚C时,下列有关电解质溶液的说法正确的是A、0.1mol/L NaHCO3溶液中:c(Na+)=c()+c() B、将CH3COONa溶液从25˚C升温至60˚C,溶液中增大 C、常温下,将1mL 1×10-6mol/L盐酸稀释至1000mL,所得溶液的pH约为9 D、物质的量浓度相同的①NH4Cl溶液 ②NH4HCO3溶液,():①>②14. 下列图示与对应的叙述相符的是 A、由图甲可知,a点的数值比b点的数值大 B、图乙表示不同温度下水溶液中和的浓度变化曲线,图中a点对应温度高于b点 C、图丙表示溶液滴定溶液的滴定曲线,M点水的电离程度最大 D、图丁表示向醋酸稀溶液中加水时溶液的导电性变化,图中p点醋酸的电离程度大于q点15. 实验中制得的与在高温条件下与煅烧可得 , 其常用作锂离子电池电极材料,如图为可充电电池的工作原理示意图,锂离子导体膜只允许通过。下列说法不正确的是
A、由图甲可知,a点的数值比b点的数值大 B、图乙表示不同温度下水溶液中和的浓度变化曲线,图中a点对应温度高于b点 C、图丙表示溶液滴定溶液的滴定曲线,M点水的电离程度最大 D、图丁表示向醋酸稀溶液中加水时溶液的导电性变化,图中p点醋酸的电离程度大于q点15. 实验中制得的与在高温条件下与煅烧可得 , 其常用作锂离子电池电极材料,如图为可充电电池的工作原理示意图,锂离子导体膜只允许通过。下列说法不正确的是 A、充电时,锂离子向钙电极方向移动 B、钙电极的电解质不可以替换成硫酸锂溶液 C、理论上,每消耗x mol Ca,可生成1mol D、放电时,电极上发生的嵌入,16. 常温下,向10mL0.10mol/LCuCl2溶液中滴加0.10mol/LNa2S溶液,滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示。下列说法不正确的是
A、充电时,锂离子向钙电极方向移动 B、钙电极的电解质不可以替换成硫酸锂溶液 C、理论上,每消耗x mol Ca,可生成1mol D、放电时,电极上发生的嵌入,16. 常温下,向10mL0.10mol/LCuCl2溶液中滴加0.10mol/LNa2S溶液,滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示。下列说法不正确的是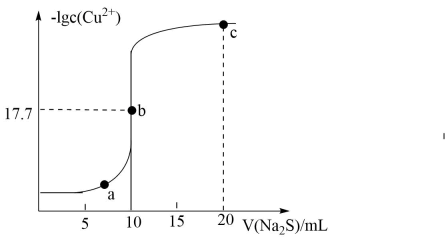 A、Ksp(CuS)=10-35.4 B、a点溶液中:c(S2-)•c(Cu2+)=Ksp(CuS) C、c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+) D、a、b、c三点溶液中,水的电离程度最大的是b点
A、Ksp(CuS)=10-35.4 B、a点溶液中:c(S2-)•c(Cu2+)=Ksp(CuS) C、c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+) D、a、b、c三点溶液中,水的电离程度最大的是b点二、非选择题
-
17. 实验室常利用甲醛法测定样品中氮的质量分数,其反应原理为:[滴定时,1 mol 与1 mol 相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500 g。
步骤II:将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III:移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)、根据步骤Ⅲ填空:①样品溶液用 (A.酸式滴定管B.碱式滴定管)来量取。
②碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
③锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)。
④滴定时边滴边摇动锥形瓶,眼睛应观察。
⑤滴定达到终点时,酚酞指示剂由色变成色。
(2)、滴定结果如下表所示:滴定次数
待测溶液的体积/mL
标准溶液的体积
滴定前刻度/mL
滴定后刻度/mL
1
25.00
1.02
21.03
2
25.00
2.00
21.99
3
25.00
0.20
20.20
若NaOH标准溶液的浓度为0.1010 mol•L , 则该样品中氮的质量分数为。(保留4位有效数字)
18. 2021年,中国科学院天津工业生物技术研究所马延和研究员带领团队,采用一种类似“搭积木”的方式,从头设计、构建了11步反应的非自然固碳与淀粉合成途径,在实验室中首次实现从二氧化碳到淀粉分子的全合成。其原理首先是利用化学催化剂将高浓度二氧化碳在高密度氢能作用下合成。(1)、已知:①该反应
②下列有利于提高平衡产率的是条件是。
A.高温、高压 B.低温、高压 C.高温、低压 D.低温、低压
(2)、时,条件下,向2L刚性容器中充入和 , 发生反应: , 测得不同时刻容器内压强变化如下表:时间/h
1
2
3
4
5
6
80
75
72
71
70
70
反应前1小时内的平均反应速率为 , 该温度下的平衡转化率为 , 平衡时的分压MPa。
(3)、在催化条件下,密闭容器内通入发生下列反应:反应Ⅰ:
反应Ⅱ:
①实验测得反应Ⅱ的平衡常数(记作)与温度(T)的关系如下图所示,则(填“>”或“<”)。

②实验测得温度对平衡体系中甲醚、甲醇的百分含量影响如下图所示,在范围内,醇的含量逐渐增大,而甲醚的百分含量逐渐减小的可能原因是:。
 19. 当今社会的主题之一:发展经济,节能减排。而燃料电池因其无污染,且原料来源广可再生被人们青睐,广泛应用于生产、生活、科学研究中,现有如下图所示装置,所有电极均为Pt,请按要求回答下列问题:
19. 当今社会的主题之一:发展经济,节能减排。而燃料电池因其无污染,且原料来源广可再生被人们青睐,广泛应用于生产、生活、科学研究中,现有如下图所示装置,所有电极均为Pt,请按要求回答下列问题: (1)、甲装置是(填“原电池”或“电解池”),写出a极的电极反应。(2)、乙池中c极的电极反应。(3)、当b极消耗标准状况下的O2112mL时,若乙中硫酸铜溶液的体积是200mL,假若电解前后溶液体积保持不变,此时乙池中的pH=。(4)、若CuSO4(aq)足够,电解一段时间后,要恢复到原来的状态,则可加入____。A、CuO B、Cu(OH)2 C、CuCO3 D、Cu2(OH)2CO3(5)、现用丙装置电解硫酸钾溶液制取氢气、氧气、硫酸和氢氧化钾,其中M、N为离子交换膜,只允许某些离子通过,则A出口导出的溶液溶质为(写化学式),M为离子交换膜(填“阴”或“阳”)。20. 请按要求填空:(1)、若pH=3的强酸HA与pH=11的弱碱MOH等体积混合,则所得溶液显。(2)、把FeCl3溶液蒸干,灼烧,最后得到的固体产物是。(3)、将NaHCO3溶液与AlCl3溶液混合的离子方程式:。(4)、现将溶液和溶液等体积混合,得到缓冲溶液。若HA为 , 该溶液显酸性,则溶液中所有的离子按浓度由大到小排列的顺序是。(5)、常温下,向溶液中逐滴加入溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
(1)、甲装置是(填“原电池”或“电解池”),写出a极的电极反应。(2)、乙池中c极的电极反应。(3)、当b极消耗标准状况下的O2112mL时,若乙中硫酸铜溶液的体积是200mL,假若电解前后溶液体积保持不变,此时乙池中的pH=。(4)、若CuSO4(aq)足够,电解一段时间后,要恢复到原来的状态,则可加入____。A、CuO B、Cu(OH)2 C、CuCO3 D、Cu2(OH)2CO3(5)、现用丙装置电解硫酸钾溶液制取氢气、氧气、硫酸和氢氧化钾,其中M、N为离子交换膜,只允许某些离子通过,则A出口导出的溶液溶质为(写化学式),M为离子交换膜(填“阴”或“阳”)。20. 请按要求填空:(1)、若pH=3的强酸HA与pH=11的弱碱MOH等体积混合,则所得溶液显。(2)、把FeCl3溶液蒸干,灼烧,最后得到的固体产物是。(3)、将NaHCO3溶液与AlCl3溶液混合的离子方程式:。(4)、现将溶液和溶液等体积混合,得到缓冲溶液。若HA为 , 该溶液显酸性,则溶液中所有的离子按浓度由大到小排列的顺序是。(5)、常温下,向溶液中逐滴加入溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
①常温下一定浓度的MCl稀溶液的pH(填“>”“<”或“=”)7,用离子方程式表示其原因。
②K点对应的溶液中存在一个物料守恒为。