湖北省部分普通高中联盟2022-2023学年高二下学期期中联考化学试题
试卷更新日期:2023-05-15 类型:期中考试
一、单选题
-
1. 氢氟酸是芯片加工的重要试剂,可通过反应制取。下列说法正确的是( )A、基态原子的电子排布式为 B、的电子式为
 C、中子数为15的P可以表示为
D、的电离方程式为
2. 有反应P4+16H2O+10CuSO4=10Cu+4H3PO4+10H2SO4。下列说法正确的是( )A、第一电离能大小:I1(P)<I1(S) B、电负性大小:χ(O)< χ(S) C、离子半径大小:r(P3-)>r(S2-) D、酸性强弱:H3PO4>H2SO43. NA为阿伏加德罗常数的值。下列说法错误的是( )A、23gCH3CH2OH中sp3杂化的原子数为NA B、0.5molXeF4中氙的价层电子对数为3NA C、1mol[Cu(H2O)4]2+中配位键的个数为4NA D、标准状况下,11.2LCO和H2的混合气体中分子数为0.5NA4. 下列物质的分子中既有σ键,又有π键的是( )
C、中子数为15的P可以表示为
D、的电离方程式为
2. 有反应P4+16H2O+10CuSO4=10Cu+4H3PO4+10H2SO4。下列说法正确的是( )A、第一电离能大小:I1(P)<I1(S) B、电负性大小:χ(O)< χ(S) C、离子半径大小:r(P3-)>r(S2-) D、酸性强弱:H3PO4>H2SO43. NA为阿伏加德罗常数的值。下列说法错误的是( )A、23gCH3CH2OH中sp3杂化的原子数为NA B、0.5molXeF4中氙的价层电子对数为3NA C、1mol[Cu(H2O)4]2+中配位键的个数为4NA D、标准状况下,11.2LCO和H2的混合气体中分子数为0.5NA4. 下列物质的分子中既有σ键,又有π键的是( )①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
A、①②③ B、③⑤⑥ C、①③⑥ D、③④⑤⑥5. 下列分子或离子的中心原子为杂化,且杂化轨道容纳1对孤电子对的是( )A、、、 B、、、 C、、、 D、、、6. 下列说法正确的是( )A、CO2分子中σ键和π键的数目之比为 B、SO2和CS2均为V形分子 C、NCl3分子中的键角为 D、SiF4和的中心原子均为sp3杂化7. 为阿伏加德罗常数的值。下列说法错误的是( )A、分子中,S的价层电子对数是 B、常温下,中含有氢键的数目为 C、分子中含有的共价键数目为 D、晶体中,阴阳离子数目之和是8. 下列关于氢键的说法正确的是( )A、由于氢键的作用,、、的沸点反常,且沸点高低顺序为 B、氢键只能存在于分子间,不能存在于分子内 C、水在1000℃以上才会部分分解是因为水中含有大量的氢键 D、邻羟基苯甲醛的沸点低于对羟基苯甲醛的原因是前者不存在氢键9. 某晶体的晶胞如图所示,这种晶体中A、B、C三种粒子数目之比是( ) A、3∶9∶4 B、1∶4∶2 C、2∶9∶4 D、3∶8∶410. 有关晶体的结构如下图所示,下列说法错误的是( )
A、3∶9∶4 B、1∶4∶2 C、2∶9∶4 D、3∶8∶410. 有关晶体的结构如下图所示,下列说法错误的是( ) A、的晶胞结构如图所示,镍原子的配位数为12 B、在晶体中,每个晶胞平均占有4个 C、在金刚石晶体中,碳原子与碳碳键个数之比为 D、由E原子和F原子构成的气态团簇分子的分子式为或11. 下列关于物质的结构或性质以及解释均正确的是( )
A、的晶胞结构如图所示,镍原子的配位数为12 B、在晶体中,每个晶胞平均占有4个 C、在金刚石晶体中,碳原子与碳碳键个数之比为 D、由E原子和F原子构成的气态团簇分子的分子式为或11. 下列关于物质的结构或性质以及解释均正确的是( )选项
物质的结构或性质
解释
A
键角:NH3>BF3
NH3中N的孤电子对数比BF3中B的孤电子对数多
B
酸性:CH3COOH>CH3CH2COOH
烃基(R-)越长推电子效应越大,使羧基中羟基的极性越小,羧酸的酸性越弱
C
熔点:碳化硅>金刚石
C-Si键能大于C-C键能
D
稳定性:H2O>H2S
水分子间存在氢键
A、A B、B C、C D、D12. 某立方卤化物可用于制作光电材料,其晶胞结构如图所示。下列说法错误的是( ) A、的配位数为6 B、与距离最近的是 C、该物质的化学式为 D、若换为 , 则晶胞棱长将改变13. 下列晶体性质的比较中正确的是( )A、熔点:SiI4>SiBr4>SiCl4 B、沸点:NH3>H2O>HF C、硬度:白磷>冰>二氧化硅 D、熔点:单质硫>磷>晶体硅14. 某立方晶系的锑钾(Sb—K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构图,图b表示晶胞的一部分。下列说法正确的是( )
A、的配位数为6 B、与距离最近的是 C、该物质的化学式为 D、若换为 , 则晶胞棱长将改变13. 下列晶体性质的比较中正确的是( )A、熔点:SiI4>SiBr4>SiCl4 B、沸点:NH3>H2O>HF C、硬度:白磷>冰>二氧化硅 D、熔点:单质硫>磷>晶体硅14. 某立方晶系的锑钾(Sb—K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构图,图b表示晶胞的一部分。下列说法正确的是( )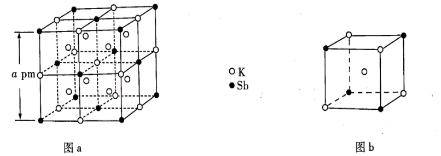 A、该晶胞的体积为a3×10-36cm-3 B、K和Sb原子数之比为3∶1 C、与Sb最邻近的K原子数为4 D、K和Sb之间的最短距离为 apm15. 某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种短周期元素的原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列叙述错误的是( )
A、该晶胞的体积为a3×10-36cm-3 B、K和Sb原子数之比为3∶1 C、与Sb最邻近的K原子数为4 D、K和Sb之间的最短距离为 apm15. 某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种短周期元素的原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列叙述错误的是( ) A、简单氢化物的沸点:X>Y B、该化合物阴、阳离子中均有配位键 C、第一电离能:Y>Z>X>W D、该化合物中Z元素的杂化方式为sp3
A、简单氢化物的沸点:X>Y B、该化合物阴、阳离子中均有配位键 C、第一电离能:Y>Z>X>W D、该化合物中Z元素的杂化方式为sp3二、填空题
-
16. Ti、Na、Mg、C、N、O、Fe等元素的研究一直在进行中,其单质及化合物在诸多领域都有广泛的应用。回答下列问题:(1)、钠在火焰上灼烧的黄光是一种______(填字母)。A、吸收光谱 B、发射光谱(2)、下列Mg原子的核外电子排布式中,能量最高的是(填序号)。
a.1s22s22p43s13p3p3p b.1s22s22p33s23p3p3p
c.1s22s22p63s13p d.1s22s22p63s2
(3)、Ti原子位于元素周期表中的区,其价电子排布式为。与Ti同周期的过渡元素中,未成对电子数最多的基态原子的外围电子的轨道表示式。(4)、Fe3+与Fe2+的离子半径大小关系为Fe3+Fe2+(填“大于”或“小于”)。(5)、下列各组多电子原子的能级能量比较不正确的是______。①2p=3p ②4s>2s ③4p>4f ④ 4d>3d
A、①④ B、①③ C、③④ D、②③三、结构与性质
-
17. 已知氮元素可以形成多种化合物.回答以下问题:(1)、氮原子的最外层的轨道表示式是;氮元素有多种化合价,列举一例含2种氮元素化合价的化合物(化学式)。(2)、肼N2H4分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。NH3的空间构型是;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是(写化学式)。(3)、肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)→3N2(g)+4H2O(g) △H=-1038.7kJ•mol-1 , 若该反应中有4molN-H键断裂,则生成的气体有mol,其中转移电子数目为。(4)、肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在(填标号)。
a.离子键 b.共价键 c.金属键 d.范德华力
18. S元素是动植物生长所必需的元素,在生活中应用广泛。(1)、基态S原子的价电子排布式为。(2)、N2O、H2S、H2Se的键角由大到小的顺序为(填化学式)。(3)、已知无机含氧酸分子中非羟基氧数目越多,一般酸性越强,试从结构的角度解释H2SO4的酸性比H2SO3强的原因。(4)、PbS晶胞如图所示,已知晶胞中S2-与Pb2+最近的距离为anm,设阿伏加德罗常数的值为NA , 则晶体密度为g•cm-3。 (5)、铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。
(5)、铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。
晶体中每个铁原子周围距离最近的镁原子有个,原子坐标参数可以表示晶胞内部原子的相对位置,其中原子坐标参数A为(0,0,0),B为( , , ),C为( , , 0),则D点坐标参数为。
四、实验题
-
19. 肼(N2H4) 是一种重要的工业产品,实验室用NH3与Cl2合成肼(N2H4) 并探究肼的性质。实验装置如图所示:

相关物质的性质如下:
性状
熔点/℃
沸点/℃
性质
N2H4
无色液体
1.4
113
与水混溶、强还原性
N2H6SO4
无色晶体
254
/
微溶于冷水,易溶于热水
回答下列问题:
(1)、装置A试管中的试剂为(填化学式)。仪器a的名称是。(2)、N2H4是分子(填“极性”或“非极性”)。(3)、装置B中制备肼的离子方程式为 , 该装置中通入NH3必须过量的原因是。(4)、上述装置存在一处缺陷,会导致肼的产率降低,改进方法是。(5)、①探究N2H4的性质。取装置B中溶液,加入适量稀硫酸振荡,置于冰水浴冷却,试管底部得到无色晶体。肼是一种二元弱碱,肼与硫酸反应除能生成N2H6SO4外,还可能生成的盐为。(填化学式)。②测定肼的质量分数。取装置B中的溶液3.2g,调节溶液pH为6.5左右,加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用c mol·L-1的碘溶液滴定(杂质不参与反应),滴定过程中有无色、无味、无毒气体产生。滴定终点平均消耗标准溶液20.00mL,产品中肼的质量分数为%。
-