浙教版科学八下期末难题汇总
试卷更新日期:2023-05-14 类型:期末考试
一、单选题
-
1. 如图所示,L是电磁铁,在L正上方用弹簧悬挂一条形磁铁,设电源电压不变,闭合电键S待电磁铁稳定后,当滑动变阻器R的滑片由上向下缓缓地滑动过程中,弹簧的长度将( )
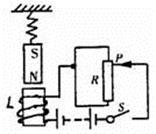 A、先变短后变长 B、先变长后变短 C、变短 D、变长2. mol是表示物质量的一种单位,1mol的Na、Mg、Al三种金属的质量分别为23克、24克、27克。室温时,向146克溶质质量分数为10%的盐酸溶液中分别加入两种金属M、N,先加入0.1mol的金属M,反应完毕后再加入0.2mol的金属N,则下列四组所加入的两种金属,放出气体总量最多的一组是( )
A、先变短后变长 B、先变长后变短 C、变短 D、变长2. mol是表示物质量的一种单位,1mol的Na、Mg、Al三种金属的质量分别为23克、24克、27克。室温时,向146克溶质质量分数为10%的盐酸溶液中分别加入两种金属M、N,先加入0.1mol的金属M,反应完毕后再加入0.2mol的金属N,则下列四组所加入的两种金属,放出气体总量最多的一组是( )选项
A
B
C
D
M
Na
Na
Al
Mg
N
Al
Mg
Na
Na
A、A B、B C、C D、D3. 一定条件下,在一密闭容器内发生某化学反应,并测得反应前后各物质的质量如图所示。下列说法正确的是( )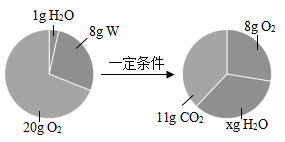 A、x的值为9 B、该反应中氧气与水的质量变化之比为6:5 C、W由碳、氢两种元素组成 D、W中碳、氢元素质量比为3:14. 由Na2SO4和CaSO4组成的混合物中,测知氧元素的质量分数为46%.若再计算混合物中的下列各项:①硫元素的质量分数 ②钠元素的质量分数 ③CaSO4的质量分数 ④Na2SO4和CaSO4的质量比 ⑤CaSO4的质量,以下判断正确的是( )A、都能确定 B、都不能确定 C、只有①能确定 D、只有⑤不能确定5. 已知FeSO4、Fe2(SO4)3混合物中铁元素的质量分数为a%,则硫元素的质量分数为( )A、1-a% B、 C、 D、无法计算6. 目前农村正在推广“测土配方施肥”技术,农技员对某土地检测后给出了施肥配方,该土壤施加NH4NO3 , K2CO3;若测定该混合化肥中氮元素的质量分数为28%,则固体混合物中K2CO3的质量分数为( )A、85% B、20% C、25% D、80%7. 下列说法中正确的是( )A、有足量的 Fe、S、C、H2 四种物质,分别在氧气中完全燃烧,若消耗等质量的氧气, 则消耗质量最少的是 Fe B、在 CO、CO2、N2 中碳元素的质量分数是 24%,则 N2 的质量分数可能是 11% C、在某种氮的氧化物中,若氮元素与氧元素的质量比为 7:4,该氧化物的化学式为NO D、一氧化碳和二氧化碳组成的混合气体中,碳、氧原子的个数比可能是 2:38. 有两种元素X和Y,它们化合成两种化合物A和B,化合物A中X所占质量分数为75%,化合物B中X占80%。已知A的化学式为XY4 , 则B的化学式为( )A、XY2 B、XY3 C、X2Y3 D、X3Y29. 有三种元素X、Y、Z,已知X和Y原子核外电子层数相同,Y和Z原子最外层电子数相同,又知三种元素原子最外层电子总数之和为14,而质子数之和为28,则三种元素有可能是( )A、C、N、P B、N、O、S C、N、P、F D、Na、O、S10.
A、x的值为9 B、该反应中氧气与水的质量变化之比为6:5 C、W由碳、氢两种元素组成 D、W中碳、氢元素质量比为3:14. 由Na2SO4和CaSO4组成的混合物中,测知氧元素的质量分数为46%.若再计算混合物中的下列各项:①硫元素的质量分数 ②钠元素的质量分数 ③CaSO4的质量分数 ④Na2SO4和CaSO4的质量比 ⑤CaSO4的质量,以下判断正确的是( )A、都能确定 B、都不能确定 C、只有①能确定 D、只有⑤不能确定5. 已知FeSO4、Fe2(SO4)3混合物中铁元素的质量分数为a%,则硫元素的质量分数为( )A、1-a% B、 C、 D、无法计算6. 目前农村正在推广“测土配方施肥”技术,农技员对某土地检测后给出了施肥配方,该土壤施加NH4NO3 , K2CO3;若测定该混合化肥中氮元素的质量分数为28%,则固体混合物中K2CO3的质量分数为( )A、85% B、20% C、25% D、80%7. 下列说法中正确的是( )A、有足量的 Fe、S、C、H2 四种物质,分别在氧气中完全燃烧,若消耗等质量的氧气, 则消耗质量最少的是 Fe B、在 CO、CO2、N2 中碳元素的质量分数是 24%,则 N2 的质量分数可能是 11% C、在某种氮的氧化物中,若氮元素与氧元素的质量比为 7:4,该氧化物的化学式为NO D、一氧化碳和二氧化碳组成的混合气体中,碳、氧原子的个数比可能是 2:38. 有两种元素X和Y,它们化合成两种化合物A和B,化合物A中X所占质量分数为75%,化合物B中X占80%。已知A的化学式为XY4 , 则B的化学式为( )A、XY2 B、XY3 C、X2Y3 D、X3Y29. 有三种元素X、Y、Z,已知X和Y原子核外电子层数相同,Y和Z原子最外层电子数相同,又知三种元素原子最外层电子总数之和为14,而质子数之和为28,则三种元素有可能是( )A、C、N、P B、N、O、S C、N、P、F D、Na、O、S10.若地磁场在某区域的磁场强弱和方向处处相同,小明在该区域某处竖直拿着闭合的矩形导电线圈面向南方,如图,则能使线圈中产生感应电流的操作是( )
 A、南北移动线圈 B、将线圈转至水平 C、东西移动线圈 D、上下移动线圈11. 下列化合物在氧气中燃烧,生成CO2和H2O的质量比为22∶9的是( )A、CH4 B、C6H12O6 C、C2H5OH D、C2H612. 图甲是发电机原理的示意图,图乙中的“○”表示图在磁场中分别转动到1-4位置时,运动方向已用箭头标出,图甲中的导线ab,当它下列说法正确的是( )
A、南北移动线圈 B、将线圈转至水平 C、东西移动线圈 D、上下移动线圈11. 下列化合物在氧气中燃烧,生成CO2和H2O的质量比为22∶9的是( )A、CH4 B、C6H12O6 C、C2H5OH D、C2H612. 图甲是发电机原理的示意图,图乙中的“○”表示图在磁场中分别转动到1-4位置时,运动方向已用箭头标出,图甲中的导线ab,当它下列说法正确的是( )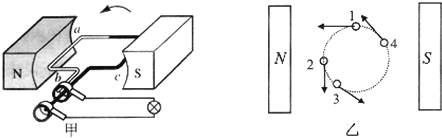 A、在位置1时,电路中不会产生感应电流 B、图甲的电路中没有电源 C、在位置3时,电路中不会产生感应电流 D、发电机产生的电流方向不变13. 邵总有一发光棒,闭合开关,众小灯齐发光;一段时间后,其中一小灯熄灭,如图所示。关于该小灯熄灭的原因以及众小灯的电路连接方式,下列猜想中合理的是( )
A、在位置1时,电路中不会产生感应电流 B、图甲的电路中没有电源 C、在位置3时,电路中不会产生感应电流 D、发电机产生的电流方向不变13. 邵总有一发光棒,闭合开关,众小灯齐发光;一段时间后,其中一小灯熄灭,如图所示。关于该小灯熄灭的原因以及众小灯的电路连接方式,下列猜想中合理的是( ) A、若该小灯处断路,众小灯并联;若该小灯处短路,众小灯串联 B、若该小灯处断路,众小灯并联;若该小灯处短路,众小灯并联 C、若该小灯处断路,众小灯串联;若该小灯处短路,众小灯串联 D、若该小灯处断路,众小灯串联:若该小灯处短路,众小灯并联14. 甲、乙、丙和丁四个图分别表示有关量的变化规律。下列有关描述中,正确的是( )
A、若该小灯处断路,众小灯并联;若该小灯处短路,众小灯串联 B、若该小灯处断路,众小灯并联;若该小灯处短路,众小灯并联 C、若该小灯处断路,众小灯串联;若该小灯处短路,众小灯串联 D、若该小灯处断路,众小灯串联:若该小灯处短路,众小灯并联14. 甲、乙、丙和丁四个图分别表示有关量的变化规律。下列有关描述中,正确的是( )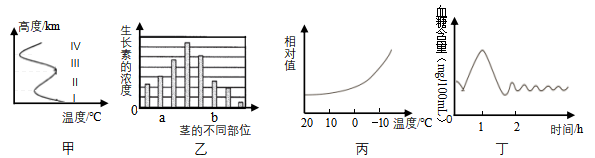 A、甲图中,Ⅰ是对流层,大气温度随高度的升高而升高 B、乙图中,若a处是茎的向光侧,则b处一定是茎的背光侧 C、丙图中,曲线表示从温暖的室内到寒冷的户外时,皮肤血流量的变化 D、丁图中,饭后1﹣2小时内血液中胰岛素的含量升高
A、甲图中,Ⅰ是对流层,大气温度随高度的升高而升高 B、乙图中,若a处是茎的向光侧,则b处一定是茎的背光侧 C、丙图中,曲线表示从温暖的室内到寒冷的户外时,皮肤血流量的变化 D、丁图中,饭后1﹣2小时内血液中胰岛素的含量升高二、填空题
-
15.(1)、下列是各类烷烃的化学式:甲烷CH4 ,乙烷C2H6 ,丙烷C3H8。一种烷烃的一个分子中含有44个氢原子,则其含有个碳原子。(2)、已知镁条在空气中燃烧,不仅生成氧化镁 , 还有少量镁与氮气化合生成氮化镁(Mg3N2)。
若有24g镁在空气中完全燃烧,则所得产物的总质量m40g (填:“>”、“=”或“<”)。
16. 回答下列问题。(1)、下表是元素周期表的一部分,请回答有关问题: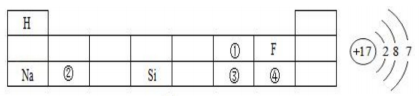
右图表示左表中(填表中序号)的原子结构示意图;得电子后形成的离子符号为;①处元素和②处元素形成常见化合物的化学式为;
(2)、X、Y两种元素的相对原子质量之比为7∶2,X与Y形成的化合物中,X、Y两种元素的质量之比为21∶8,则该化合物的化学式可表示为。若X、Y两种元素的相对原子质量之比为2∶1,由这两种元素形成的化合物中,X、Y的质量之比为2∶3,其中X的化合价为+a。则在该化合物中Y的化合价为。17.(1)、X、Y两种元素组成的化合物甲和乙,甲的化学式为X2Y3 , 其中Y元素的质量分数为50%,乙中X元素的质量分数为60%,则乙的化学式为;(2)、元素X的原子失去1个电子,元素Y的原子得到2个电子后,所形成的离子所带电子数均与氖原子相同,由X、Y两元素的离子形成的化合物的相对分子质量为;(3)、相同质量的H2O2和D2O(D即2H)中氢元素的质量比为。(4)、某样品可能由铁、氧化亚铁、氧化铁和四氧化三铁中的一种或几种组成,现测得该样品中铁元素与氧元素的质量比是21:8;若该样品由两种物质混合而成,则一定不含;若该样品由三种物质混合而成,则一定含有。18. 金属单质A和非金属单质B可生成化合物A2B,反应的化学方程式为2A+B=A2B.某校一课外小组的甲、乙、丙三个学生分别在实验室内做该实验,充分反应时,所用A和B的质量a和b各不相同,但总质量相等,都是8.0g.有关实验数据记录如下.试求丙学生实验中a:b的值可能是多少?
A的用量
B的用量
A2B的质量
甲
7.0 g
1.0 g
5.0 g
乙
4.0 g
4.0 g
5.0 g
丙
a g
b g
3.0 g
19.如图所示,AB和CD是两根固定且平行的水平金属导轨,符号×表示垂直于纸面指向纸面里的磁场的磁感线.现将铜棒EF和GH垂直放在滑轨上,当拉动GH使其向左移动时,发现EF也向左移动,说明铜棒里(选填“有”或“无”)电流产生,EF受到的是磁场力的作用.当拉动GH使其向右移动时,EF应向(选填“左”或“右”)移动,理由是:;此过程中能量的转化是:。
 20. 嫦娥四号月球探测器登上月球背面,成为世界首个着落在月球背面的探测器。此后,嫦娥四号通过“鹊桥”中继星向世界展现了首张月背的完整风貌。其实看似荒凉的月球矿产资源极为丰富。以铁为例,仅月面表层5厘米厚的沙土就含有上亿吨铁。(1)、科学研究发现,月球上富含铁的同位素:Fe﹣57(一个原子内质子数与中子数之和为57)和Fe﹣54,已知铁元素为26号元素,则下列相关说法错误的是_________。A、Fe﹣57和Fe﹣54原子核外电子数相同,中子数不同 B、Fe﹣57和Fe﹣54在元素周期表中占同一个位置 C、Fe﹣57和Fe﹣54均属于铁元素,所以相对原子质量相同(2)、地球上的铁主要以氧化物形式存在,在Fe2O3、Fe3O4两种化合物中,与等质量铁元素相结合的氧元素的质量比为;某赤铁矿(主要成分为Fe2O3 , 且其它成分不含铁)探明含铁量为10.5%,则Fe2O3含量为(以百分数的形式表示)。21.
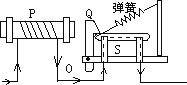
20. 嫦娥四号月球探测器登上月球背面,成为世界首个着落在月球背面的探测器。此后,嫦娥四号通过“鹊桥”中继星向世界展现了首张月背的完整风貌。其实看似荒凉的月球矿产资源极为丰富。以铁为例,仅月面表层5厘米厚的沙土就含有上亿吨铁。(1)、科学研究发现,月球上富含铁的同位素:Fe﹣57(一个原子内质子数与中子数之和为57)和Fe﹣54,已知铁元素为26号元素,则下列相关说法错误的是_________。A、Fe﹣57和Fe﹣54原子核外电子数相同,中子数不同 B、Fe﹣57和Fe﹣54在元素周期表中占同一个位置 C、Fe﹣57和Fe﹣54均属于铁元素,所以相对原子质量相同(2)、地球上的铁主要以氧化物形式存在,在Fe2O3、Fe3O4两种化合物中,与等质量铁元素相结合的氧元素的质量比为;某赤铁矿(主要成分为Fe2O3 , 且其它成分不含铁)探明含铁量为10.5%,则Fe2O3含量为(以百分数的形式表示)。21.新建的居民住宅大多安装了自动空气开关.其原理如图所示,当电路由于电流过大时,电磁铁P的磁性将变(选填“强”或“弱”),吸引衔铁Q的力变大,使衔铁转动,闸刀在弹力作用下自动开启,切断电路,起到保险作用.某周末,文强同学在家开着空调看电视,妈妈打开电饭锅做饭时,家里的自动空气开关“跳闸”.则此时“跳闸”的原因最可能是 .
三、实验探究题
-
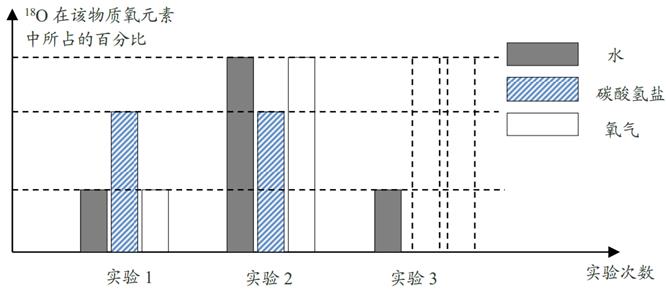
22. 只含铜和氧两种元素的固体样品18g,测得铜元素的质量为16g。已知铜的氧化物有CuO和Cu2O。请通过分析或计算回答下列问题:(1)、该样品的组成情况有。(写出所有可能的组成);(2)、若固体样品由两种物质组成,则质量偏少的那种物质在样品中的质量分数为。(用分数表示)23. 光合作用产生的氧来自二氧化碳还是水?鲁宾和卡门在实验中利用了同位素对这个问题进行了研究。他们首先选择一种碳酸氢盐,制备出含有不同比例18O的该种物质,即18O在该物质氧元素中所占比例不同。同样方法,制备出含有不同比例18O的水,然后配成三种质量分数相同的碳酸氢盐溶液。碳酸氢盐溶解在水中能生成二氧化碳并保持水中的二氧化碳浓度不变,同时不会产生水。将小球藻放入这三种溶液并用阳光进行照射。分析产生氧气中18O的比例,得出结论:光合作用产生的氧来自水。(1)、18O和16O属于同位素原子,它们的原子结构中 相同。A、质子数 B、中子数 C、电子数 D、核电荷数(2)、根据实验结论,在虚线框内补充第三次实验碳酸氢盐和氧气中18O百分比的条形图。
 (3)、鲁宾和卡门是通过测量生成氧气的密度确定氧气中18O的含量。如果有一种氧气,18O占50%,即18O和16O的个数比为1:1。根据以下资料计算,在标准状况下该种氧气的密度为kg/m3。(保留两位小数)
(3)、鲁宾和卡门是通过测量生成氧气的密度确定氧气中18O的含量。如果有一种氧气,18O占50%,即18O和16O的个数比为1:1。根据以下资料计算,在标准状况下该种氧气的密度为kg/m3。(保留两位小数)资料:I.在相同的温度和压强下,相同体积的气体具有相同的分子数。
II.18O的相对原子量为 18,16O的相对原子量为 16。
III.自然界的氧气在标准状况下的密度为1.43 kg/m3 , 16O 占所有氧原子的比例可近似看作 100%。
24. 丹麦科学家奥斯特发现电流的周围存在磁场(图1),法国科学家安培发现两根平行导线通电后有如图2所示的现象(图中实线、虚线分别表示通电前、后的情况)。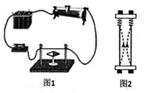 (1)、如图1,通电前静止的小磁针南北指向。现要在小磁针上方拉一根直导线,使通电时小磁针会发生明显的偏转,直导线所指的方向应为(选填“东西方向”、“南北方向”或“任意方向")。(2)、图2的实验表明平行通电导线之间有力的作用,若此时改变其中一根导线的电流方向,会产生的实验现象是。(3)、安培发现平行通电导线之间相互作用力F的大小可能跟两根导线中的电流I1 , I2 , 导线之间的距离r有关,有关实验数据如下:
(1)、如图1,通电前静止的小磁针南北指向。现要在小磁针上方拉一根直导线,使通电时小磁针会发生明显的偏转,直导线所指的方向应为(选填“东西方向”、“南北方向”或“任意方向")。(2)、图2的实验表明平行通电导线之间有力的作用,若此时改变其中一根导线的电流方向,会产生的实验现象是。(3)、安培发现平行通电导线之间相互作用力F的大小可能跟两根导线中的电流I1 , I2 , 导线之间的距离r有关,有关实验数据如下:实验次数
I1/A
I2/A
r/m
F/N
1
0.2
0.2
0.1
1.0×10-7
2
0.1
0.2
0.1
0.5×10-7
3
0.2
0.2
0.05
2.0×10-7
4
0.2
0.4
0.1
2.0×10-7
分析表格实验数据,可获得的结论是。
四、解答题
-
25. 已知在C2H4、C2H4O和C2H4O6组成的混合物中,经分析发现含氧元素的质量分数为M%,则混合物中氢元素的质量分数是多少?面对这类的题目,我们可以对抽象的问题进行理想化处理。我们把此混合物放入一容器,那么在此容器中便存在大量构成这三种物质的分子:a个C2H4分子,b个C2H4O分子,c个C2H4O6分子。现在我们需取出三个分子,随机的结果有:
①一个C2H4分子,一个C2H4O分子,一个C2H4O6分子;
②一个C2H4分子,二个C2H4O分子;
③一个C2H4O分子,二个C2H4O6分子……
(1)、我们来看这三种情况,我们发现,无论怎么组合(填两种元素名 称)的原子个数比为一定值,且这两种元素所占总物质的质量分数可表示为 , 且碳元素的质量分数可表示为。(2)、拓展:已知在NaHS、MgSO4和NaHSO3组成的混合物中,含硫40%,则氧元素的质量分数为。26. 铝镁合金因密度小、强度高、刚性好等特点,在人类生活中应用广泛。某兴趣小组的同学对编号为①、②的两种铝镁合金样品进行了如下实验。已知:镁能与酸反应,但不能与碱溶液反应;铝既能与酸反应,又能与氢氧化钠等碱溶液反应,化学方程式为: 2Al+2NaOH+2H2O = 2NaAlO2+3H2↑,NaAlO2溶液与二氧化碳反应能产生氢氧化铝沉淀,后者经过滤、洗涤、灼烧后生成相应氧化物。
实验序号
1
2
3
合金质量/mg
510
765
918
气体质量/mg
50
60
60
(1)、取质量为9a克的样品①和过量的氢氧化钠溶液反应,然后过滤;再向滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,所得固体的质量为8a克。求样品①中铝的质量分数。(保留到0.01)(2)、取不同质量的样品②分别和30 g相同浓度的盐酸反应,所取合金质量与产生气体质量如右表所示:求:① 盐酸中溶质的质量分数。
②合金中铝镁的质量比。
27. 维 C 泡腾片是一种常见的补充维生素 C 的保健品。某品牌维 C 泡腾片(以下称“本品”)的主要成分如图 1 所示。 (1)、维 C 泡腾片水溶液酸碱性的测定:将本品一片投入蒸馏水中,有气泡产生,反应原理为:H3C6H5O7+3NaHCO3=Na3C6H5O7+3CO2↑+3(填化学式)。(2)、阅读本品的营养成分表:每100g维C泡腾片含钠5.75g。已知本品其他成分不含钠元素,则本品中碳酸氢钠的质量分数为。(3)、维C泡腾片中碳酸氢钠质量分数的测定:称量相关实验用品质量,将本品一片投入蒸馏水中,待不再产生气体后,称量锥形瓶及瓶内所有物质的总质量。装置如图2所示。相关数据如表:
(1)、维 C 泡腾片水溶液酸碱性的测定:将本品一片投入蒸馏水中,有气泡产生,反应原理为:H3C6H5O7+3NaHCO3=Na3C6H5O7+3CO2↑+3(填化学式)。(2)、阅读本品的营养成分表:每100g维C泡腾片含钠5.75g。已知本品其他成分不含钠元素,则本品中碳酸氢钠的质量分数为。(3)、维C泡腾片中碳酸氢钠质量分数的测定:称量相关实验用品质量,将本品一片投入蒸馏水中,待不再产生气体后,称量锥形瓶及瓶内所有物质的总质量。装置如图2所示。相关数据如表:物品
反应前
反应后
锥形瓶
蒸馏水
维 C 泡腾片
锥形瓶及瓶内所有物质
质量/g
71.75
50.00
4.00
125.09
①根据以上数据计算本品中碳酸氢钠的质量分数?
②实验测定结果与题(2)计算结果相比有明显偏差,其可能原因是________。
28. 科学家研究确认,一些油炸食品含有致癌物质丙烯酰胺(C3H5ON)。问:(1)、1 个丙烯酰胺分子由个原子构成;(2)、丙烯酰胺中碳、氢元素的质量比为;(3)、丙烯酰胺中氮元素的质量分数为(计算结果精确到 0.1%);(4)、多少克尿素[CO(NH2)2]与21.3克丙烯酰胺的含氮量相当?29. 现代炼铁的主要方法是高炉炼铁,从炉顶装入铁矿石、焦炭、石灰石,从位于炉子下部的进风口吹入经预热的空气,经发生系列反应后最终得到生铁(如图所示)。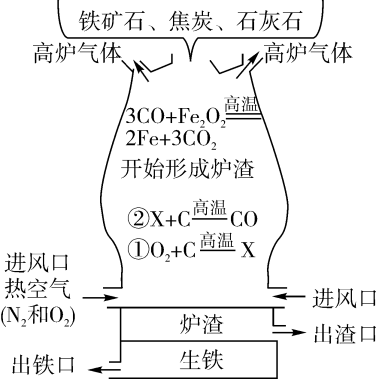 (1)、从出铁口得到的为生铁,含 2%~4.5%的碳,在物质分类上其属于。(2)、用赤铁矿(Fe2O3)为原料炼铁需要还原剂CO,其来源是以焦炭为原料,经①与②两个化学变化过程,请写出反应②的化学方程式。(3)、某大型高炉年产生铁4×106吨(设生铁的含铁质量分数为98%,在冶炼过程中铁的损耗不计),则需要含氧化铁质量分数为70%的赤铁矿石多少万吨?
(1)、从出铁口得到的为生铁,含 2%~4.5%的碳,在物质分类上其属于。(2)、用赤铁矿(Fe2O3)为原料炼铁需要还原剂CO,其来源是以焦炭为原料,经①与②两个化学变化过程,请写出反应②的化学方程式。(3)、某大型高炉年产生铁4×106吨(设生铁的含铁质量分数为98%,在冶炼过程中铁的损耗不计),则需要含氧化铁质量分数为70%的赤铁矿石多少万吨?五、综合说理题
-
30. 为了提高温室大棚中种植蔬菜的产量,菜农们有以下的经验分享。
经验一:选用无色的棚膜,增加透光性。
经验二:往菜地的土壤里掺入一定比例的沙子增加土壤透气性。
经验三:在棚内植物上端50厘米处悬挂吊袋式二氧化碳气肥(如图)。
经验四:采用滴灌代替传统浇灌,可使棚内空气的湿度降低。
结合上述信息,综合运用所学知识对以上的经验能提高蔬菜产量做出解释。