四川省泸州市泸县2022-2023学年高二下学期期中考试
试卷更新日期:2023-05-12 类型:期中考试
一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中只有一项符合题目要求
-
1. 化学与生活、社会密切相关,下列说法正确的是A、晶体硅常用做光导纤维的主要材料 B、近年来已发布“空气质量日报”中,将CO2、SO2、NO2和可吸入颗粒物等列入了首要污染物 C、煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 D、SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等2. 设NA为阿伏加德罗常数的值,下列说法正确的是A、60gSiO2晶体中含Si-O键数目为2NA B、足量Fe与1molCl2完全反应,转移的电子数目为2NA C、1L 0.1mol·L-1的Na2CO3溶液中和离子数目之和为0.1NA D、1L 0.1mol/LNa2CO3溶液中,阴离子数目小于0.1NA3. 由短周期前10号元素组成的物质T和X,有如图所示的转化,X不稳定,易分解。下列有关说法正确的是
 A、T分子中所有原子均在同一平面上 B、等物质的量的T、X分子中含有π键的数目均为NA C、X分子中含有的σ键个数是T分子中含有的σ键个数的2倍 D、T分子中只含有极性键,X分子中既含有极性键又含有非极性键4. 被称为“软电池”的纸质电池,其总反应为:Zn+2MnO2+H2O=ZnO+2MnOOH。下列说法正确的是
A、T分子中所有原子均在同一平面上 B、等物质的量的T、X分子中含有π键的数目均为NA C、X分子中含有的σ键个数是T分子中含有的σ键个数的2倍 D、T分子中只含有极性键,X分子中既含有极性键又含有非极性键4. 被称为“软电池”的纸质电池,其总反应为:Zn+2MnO2+H2O=ZnO+2MnOOH。下列说法正确的是 A、该电池中 Zn 作正极 B、MnO2电极上发生氧化反应 C、该电池工作时电流由 Zn 经导线流向 MnO2 D、当 6.5gZn 完全溶解时,流经电路的电子数目为 0.2NA5. 聚维酮碘的水溶液是一种常用的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图(图中虚线表示氢键)。下列说法错误的是
A、该电池中 Zn 作正极 B、MnO2电极上发生氧化反应 C、该电池工作时电流由 Zn 经导线流向 MnO2 D、当 6.5gZn 完全溶解时,流经电路的电子数目为 0.2NA5. 聚维酮碘的水溶液是一种常用的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图(图中虚线表示氢键)。下列说法错误的是 A、聚维酮中C、N原子均采取sp3杂化 B、聚维酮的单体是
A、聚维酮中C、N原子均采取sp3杂化 B、聚维酮的单体是 C、聚维酮分子由2m个单体聚合而成
D、聚维酮能发生水解反应
6. X、Y、Z、M为四种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成分子;Y与M形成的气态化合物在标准状况下的密度为。下列说法正确的是( )A、原子半径比较:Z>Y>X>M B、元素的氧化物对应的水化物的酸性比较:Z>Y>X C、由Y、Z、M三种元素可形成一种常见的离子化合物 D、气态氢化物的稳定性:X>Y>Z7. 向含MgCl2和CuCl2的溶液中逐滴加入0.1mol/L的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2=3V1 , 下列说法正确的是
C、聚维酮分子由2m个单体聚合而成
D、聚维酮能发生水解反应
6. X、Y、Z、M为四种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成分子;Y与M形成的气态化合物在标准状况下的密度为。下列说法正确的是( )A、原子半径比较:Z>Y>X>M B、元素的氧化物对应的水化物的酸性比较:Z>Y>X C、由Y、Z、M三种元素可形成一种常见的离子化合物 D、气态氢化物的稳定性:X>Y>Z7. 向含MgCl2和CuCl2的溶液中逐滴加入0.1mol/L的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2=3V1 , 下列说法正确的是 A、原溶液中MgCl2和CuCl2的物质的量浓度之比为3:1 B、该实验不能证明Cu(OH)2的Ksp比Mg(OH)2的Ksp小 C、若向Mg(OH)2悬浊液中滴入CuCl2溶液,一定会有Cu(OH)2生成 D、水的电离程度:A>B>C
A、原溶液中MgCl2和CuCl2的物质的量浓度之比为3:1 B、该实验不能证明Cu(OH)2的Ksp比Mg(OH)2的Ksp小 C、若向Mg(OH)2悬浊液中滴入CuCl2溶液,一定会有Cu(OH)2生成 D、水的电离程度:A>B>C二、非选择题:本题共4小题,共58分。
-
8. 神舟十四号载人宇宙飞船胜利升空,并完成与天和核心舱的对接,中国空间站即将建成。合成材料在宇宙飞船和宇航服等方面得到广泛应用,回答下列问题:(1)、合成材料品种很多,其中被称为“三大合成材料”的是、和合成橡胶。(2)、飞船上的柔性材料常用聚氯乙烯塑料。聚氯乙烯可利用乙烯和氯气作原料制备,其流程是乙烯→→乙炔→→聚氯乙烯。(填有机物名称)(3)、制作宇航服的材料聚酯纤维(聚对苯二甲酸乙二酯纤维)商品名叫涤纶,其单体的结构简式分别为和。(4)、酚醛树脂
 可做宇宙飞船外壳的烧蚀材料,其原料是苯酚和甲醛。写出下列反应的化学方程式:
可做宇宙飞船外壳的烧蚀材料,其原料是苯酚和甲醛。写出下列反应的化学方程式:
①苯酚稀溶液中逐滴加入饱和溴水产生白色沉淀;
②甲醛与苯酚在催化剂作用下制备酚醛树脂。
9. 二甲醚简称DME,是一种基础化工原料,可用于燃料电池及制取低碳烯烃等,Kagan提出的一步法制取二甲醚的反应为:ΔH。下图为刚性容器中,CO2初始浓度相同,进料浓度比c(H2)∶c(CO2)分别等于3和5时CO2平衡转化率随温度变化的关系: (1)、ΔH0(填“>”或“<”)。进料浓度比c(H2)∶c(CO2)=5的曲线为点所在曲线(填“A”或“B”),B、C两点用CH3OCH3表示的平均反应速率(B) (C)(填“>”、“<”或“=”)。(2)、在一定条件下,若将CO2改为等物质的量的CO和CO2的混合气,则充入的CO与H2O发生反应:将导致CH3OCH3的产率增大,原因是。(3)、在一定体积的刚性容器中保持温度不变,保持c(H2)∶c(CO2)进料浓度比不变,进一步提高CO2的平衡转化率的方法是、。(4)、在绝热恒容密闭容器中充入一定量的NO和NH3 , 在一定条件下发生反应:6NO(g)+4NH3(g) 5N2(g)+6H2O(g)
(1)、ΔH0(填“>”或“<”)。进料浓度比c(H2)∶c(CO2)=5的曲线为点所在曲线(填“A”或“B”),B、C两点用CH3OCH3表示的平均反应速率(B) (C)(填“>”、“<”或“=”)。(2)、在一定条件下,若将CO2改为等物质的量的CO和CO2的混合气,则充入的CO与H2O发生反应:将导致CH3OCH3的产率增大,原因是。(3)、在一定体积的刚性容器中保持温度不变,保持c(H2)∶c(CO2)进料浓度比不变,进一步提高CO2的平衡转化率的方法是、。(4)、在绝热恒容密闭容器中充入一定量的NO和NH3 , 在一定条件下发生反应:6NO(g)+4NH3(g) 5N2(g)+6H2O(g)不能说明该反应已达到平衡状态标志的是(填标号)。
a.体系温度不变
b.反应速率5v(NH3)消耗 =4v(N2)消耗
c.容器内压强不再随时间而发生变化
d.容器内N2的物质的量分数不再随时间而发生变化
e.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
(5)、一定温度下,在2 L恒容密闭容器内发生反应2NO2(g) N2O4(g),n(NO2)随时间的变化如表:时间/s
0
1
2
3
4
5
n(NO2) /mol
0.040
0.020
0.010
0.005
0.005
0.005
根据表中可以看出,随着反应进行,反应速率逐渐减小,其原因是。该温度下,反应2NO2(g) N2O4(g)的平衡常数K=L·mol-1。
(6)、对于反应2NO2(g) N2O4(g),用平衡时各组分压强关系表达的平衡常数。在一定条件下NO2与N2O4的消耗速率与自身压强间存在关系:v消耗(NO2)=k1·p2(NO2),v消耗(N2O4)=k2·p(N2O4)。其中k1、k2是与反应及温度有关的常数。相应的消耗速率跟压强的关系如图所示:
一定温度下,k1、k2与平衡常数KP的关系是k1=。在图标出的点中,指出能表示反应达到平衡状态的点并说明理由。
10. 以硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如图: (1)、“酸溶”中加快溶解的方法为(任意写出一种)。(2)、“还原”过程中的离子方程式为。(3)、写出“滤渣”中主要成分的化学式。(4)、①“沉铁”过程中生成Fe(OH)2的化学方程式为。
(1)、“酸溶”中加快溶解的方法为(任意写出一种)。(2)、“还原”过程中的离子方程式为。(3)、写出“滤渣”中主要成分的化学式。(4)、①“沉铁”过程中生成Fe(OH)2的化学方程式为。②若用CaCO3“沉铁”,则生成FeCO3沉淀。当反应完成时,溶液中=。[已知Ksp(CaCO3)=2.8×10-9 , Ksp(FeCO3)=2×10-11]
(5)、“氧化”时,用NaNO2浓溶液代替空气氧化Fe(OH)2浆液,能缩短氧化时间,但缺点是。(6)、焦炭还原硫酸渣炼铁能充分利用铁资源,在1225℃、=1.2时,焙烧时间与金属产率的关系如图,时间超过15min金属产率下降的原因是。 11. 铼被誉为21世纪的超级金属,被广泛应用于航空航天领域,一种由铼渣(主要成分:ReS2)提取铼的工艺流程图如图:
11. 铼被誉为21世纪的超级金属,被广泛应用于航空航天领域,一种由铼渣(主要成分:ReS2)提取铼的工艺流程图如图: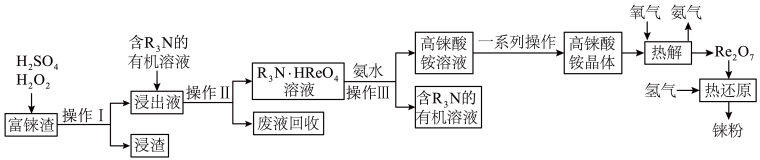 (1)、已知铼的价电子排布与锰相似,写出75Re的价电子排布式为。(2)、第一步酸浸过程中ReS2转化为两种强酸,其中一种为高铼酸(化学式:HReO4),请写出反应的离子方程式: , 根据图1所示,浸出过程中应将铼渣粉碎至目左右,根据图2所示,操作II过程中萃取液流速应选择6~8BV/h。
(1)、已知铼的价电子排布与锰相似,写出75Re的价电子排布式为。(2)、第一步酸浸过程中ReS2转化为两种强酸,其中一种为高铼酸(化学式:HReO4),请写出反应的离子方程式: , 根据图1所示,浸出过程中应将铼渣粉碎至目左右,根据图2所示,操作II过程中萃取液流速应选择6~8BV/h。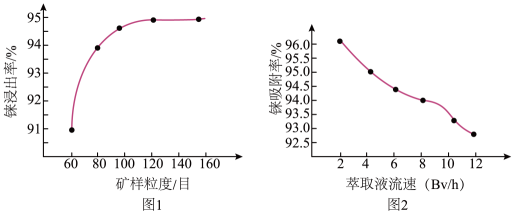 (3)、已知高铼酸铵微溶于冷水,易溶于热水。提纯粗高铼酸铵固体的方法是。(4)、写出由高铼酸铵热分解得到Re2O7的化学方程式:。(5)、实际生产过程中,使用氢气还原Re2O7时,氢气的用量始终要大于理论计算值,其原因是。(6)、整个工艺中可循环利用的物质有硫酸、氨气以及。(7)、已知铼的晶胞如图3所示,晶胞的参数如图4所示(a、c的单位为A,1A=10-10m),则金属铼的密度表达式为g•cm-3(用NA表示阿伏加德罗常数的值,M表示Re的摩尔质量)
(3)、已知高铼酸铵微溶于冷水,易溶于热水。提纯粗高铼酸铵固体的方法是。(4)、写出由高铼酸铵热分解得到Re2O7的化学方程式:。(5)、实际生产过程中,使用氢气还原Re2O7时,氢气的用量始终要大于理论计算值,其原因是。(6)、整个工艺中可循环利用的物质有硫酸、氨气以及。(7)、已知铼的晶胞如图3所示,晶胞的参数如图4所示(a、c的单位为A,1A=10-10m),则金属铼的密度表达式为g•cm-3(用NA表示阿伏加德罗常数的值,M表示Re的摩尔质量)