宁夏银川市西夏区2022-2023学年高一下学期5月期中考试
试卷更新日期:2023-05-12 类型:期中考试
一、单选题(本大题共24小题,每小题2分,共计48分)
-
1. 在刚刚过去的2022年,我国的科技发展成果举世瞩目。下列说法不正确的是( )A、2022年冬奥会中,国家速滑馆“冰丝带”采用CO2跨临界制冰,比氟利昂更环保 B、2022年我国风电、光伏发电量突破一万亿千瓦时,光伏发电符合绿色发展理念 C、2022年我国锂离子电池产量同比增长超130%,锂离子电池属于二次电池 D、2022年中国空间站全面建成,空间站所使用太阳能电池的主要成分为SiO22. 下列说法正确的是( )A、CO2、NO2或SO2都会导致酸雨的形成 B、工业制普通玻璃和生产陶瓷所使用原料相同 C、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 D、活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同3. 自然界的氮循环包括以下过程。下列说法中正确的是( )
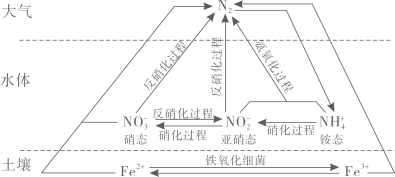 A、图中反硝化过程和氨氧化过程属于氮的固定 B、硝化过程中,含氮物质均发生还原反应 C、在氨氧化过程中,亚硝态氮元素与铵态氮元素理论物质的量之比为3:4 D、土壤中的和Fe3+的存在有利于从与其接触的水体中除去氮元素4. 下列化学用语表述不正确的是( )A、氯离子的结构示意图:
A、图中反硝化过程和氨氧化过程属于氮的固定 B、硝化过程中,含氮物质均发生还原反应 C、在氨氧化过程中,亚硝态氮元素与铵态氮元素理论物质的量之比为3:4 D、土壤中的和Fe3+的存在有利于从与其接触的水体中除去氮元素4. 下列化学用语表述不正确的是( )A、氯离子的结构示意图: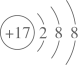 B、丙烷的分子式:C3H6
C、乙烷的球棍模型:
B、丙烷的分子式:C3H6
C、乙烷的球棍模型: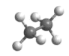 D、氯化钙的电子式:
D、氯化钙的电子式: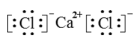 5. 利用下列实验装置能达到实验目的的是( )
5. 利用下列实验装置能达到实验目的的是( )


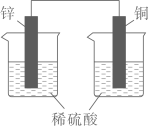
A.检验氨气极易溶于水
B.制取并干燥氨气
C.制取并收集二氧化硫
D.将化学能转化为电能
A、A B、B C、C D、D6. 在给定条件下,下列选项中所示的物质间转化均能实现的是( )A、N2(g) NO(g) NaNO2(aq) B、SO2BaSO3BaSO4 C、N2(g)NH3(g)NaHCO3(s) D、SiO2H2SiO3Na2SiO37. 具有以下碳骨架的烃,不属于烷烃的是( )A、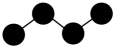 B、
B、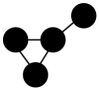 C、
C、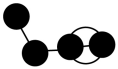 D、
D、 8. 利用太阳光在新型复合催化剂表面实现高效分解水,其主要过程如图所示:
8. 利用太阳光在新型复合催化剂表面实现高效分解水,其主要过程如图所示:
则下列说法错误的是( )
A、过程中实现了光能转化为化学能 B、氢能资源丰富,属于可再生能源 C、过程Ⅰ吸收能量,过程Ⅱ释放能量 D、2H2O2H2↑+O2↑反应的能量变化如图所示: 9. 如图是研究二氧化硫性质的微型实验装置。现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气。下列说法中错误的是( )
9. 如图是研究二氧化硫性质的微型实验装置。现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气。下列说法中错误的是( ) A、紫色石蕊溶液变蓝色 B、品红溶液褪色 C、溴水颜色褪去 D、含酚酞的NaOH溶液红色变浅或褪色10. 硅是构成无机非金属材料的一种主要元素,下列有关硅及其化合物的叙述正确的是( )A、焦炭还原石英砂可以制得粗硅:SiO2+CSi(粗硅)+CO2↑ B、SiO2既能和氢氧化钠溶液反应,又和氢氟酸反应,故SiO2是两性氧化物 C、碱液能用玻璃瓶盛放,但不能用玻璃塞 D、硅酸盐C中硅、氧原子之间以离子键形成硅氧四面体结构11. 根据下列实验事实得出的相应结论正确的是( )
A、紫色石蕊溶液变蓝色 B、品红溶液褪色 C、溴水颜色褪去 D、含酚酞的NaOH溶液红色变浅或褪色10. 硅是构成无机非金属材料的一种主要元素,下列有关硅及其化合物的叙述正确的是( )A、焦炭还原石英砂可以制得粗硅:SiO2+CSi(粗硅)+CO2↑ B、SiO2既能和氢氧化钠溶液反应,又和氢氟酸反应,故SiO2是两性氧化物 C、碱液能用玻璃瓶盛放,但不能用玻璃塞 D、硅酸盐C中硅、氧原子之间以离子键形成硅氧四面体结构11. 根据下列实验事实得出的相应结论正确的是( )选项
实验事实
结论
A
NH3 的水溶液可以导电
NH3是电解质
B
SO2通入硝酸钡溶液出现白色沉淀
BaSO3不溶于强酸
C
浓硝酸久置发黄
硝酸不稳定
D
浓硫酸能使蓝色胆矾晶体变成白色
浓硫酸具有脱水性
A、A B、B C、C D、D12. 分析下图可知( )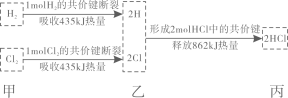 A、分解为与时放出热量 B、断开中化学键时吸收热量 C、甲、乙、丙中物质所具有的总能量大小关系为丙>乙>甲 D、和2的总能量小于的能量13. 把在空气中久置的铝片5.0g投入盛有50mL0.1mol/L盐酸的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系可用如图所示的坐标曲线来表示,下列推论不正确的是( )
A、分解为与时放出热量 B、断开中化学键时吸收热量 C、甲、乙、丙中物质所具有的总能量大小关系为丙>乙>甲 D、和2的总能量小于的能量13. 把在空气中久置的铝片5.0g投入盛有50mL0.1mol/L盐酸的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系可用如图所示的坐标曲线来表示,下列推论不正确的是( ) A、O→a不产生氢气是因为表面的氧化物隔离了铝和稀盐酸 B、b→c段产生氢气的速率增加较快的主要原因之一是温度升高 C、t = c时,反应处于平衡状态 D、t > c时,产生氢气的速率降低的主要原因是溶液中H+浓度下降14. 根据实验操作和和现象得出的结论不正确的是( )
A、O→a不产生氢气是因为表面的氧化物隔离了铝和稀盐酸 B、b→c段产生氢气的速率增加较快的主要原因之一是温度升高 C、t = c时,反应处于平衡状态 D、t > c时,产生氢气的速率降低的主要原因是溶液中H+浓度下降14. 根据实验操作和和现象得出的结论不正确的是( )选项
实验操作和和现象
结论
A
某溶液中加入浓NaOH溶液,微热,试管口放置湿润的红色石蕊试纸,石蕊试纸变蓝
溶液中含NH
B
将两支分别蘸有浓氨水和浓盐酸的玻璃棒接近,中间出现白烟现象
浓氨水和浓盐酸都具有挥发性
C
除去粗盐中Ca2+、Mg2+、的实验中,过滤后,向滤液中滴加盐酸,用玻璃棒搅拌,直到没有气泡冒出,并用pH试纸检验,使滤液呈中性或微酸性
盐酸已滴加至完全反应的标准
D
某溶液中滴加BaCl2溶液,出现白色沉淀,再加足量稀HCl,沉淀不溶解
溶液中含有
A、A B、B C、C D、D15. 关于烷烃性质的叙述中,不正确的是( )A、烷烃同系物的熔沸点随分子内碳原子数的增多逐渐升高,常温下的状态由气态递变到液态,再递变到固态 B、烷烃同系物的密度随分子内碳原子数的增多而逐渐增大,从比水轻递变到比水重 C、烷烃跟卤素单质在光照下能发生取代反应 D、烷烃同系物都不能使溴水、酸性KMnO4溶液褪色16. 下列说法正确的是( )A、 的名称为异丁烷
B、CH3CH2CH2CH2CH3和
的名称为异丁烷
B、CH3CH2CH2CH2CH3和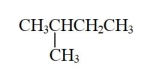 互为同素异形体
C、
互为同素异形体
C、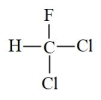 和
和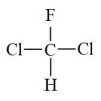 为同一物质
D、CH3CH2OH和CH3OCH3互为同系物
17. 如图所示,有关化学反应和能量变化的说法正确的是( )
为同一物质
D、CH3CH2OH和CH3OCH3互为同系物
17. 如图所示,有关化学反应和能量变化的说法正确的是( )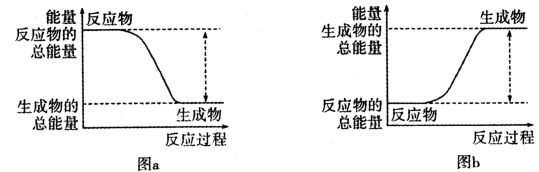 A、图a表示的是吸热反应的能量变化 B、图b中反应物比生成物稳定 C、图a可以表示氯化铵固体与氢氧化钡晶体反应的能量变化 D、图a中的反应不需要加热就一定能发生,图b中的反应一定需要加热才能发生18. 如图所示原电池装置中,溶液为稀硫酸,电子流向如图所示。下列说法正确的是( )
A、图a表示的是吸热反应的能量变化 B、图b中反应物比生成物稳定 C、图a可以表示氯化铵固体与氢氧化钡晶体反应的能量变化 D、图a中的反应不需要加热就一定能发生,图b中的反应一定需要加热才能发生18. 如图所示原电池装置中,溶液为稀硫酸,电子流向如图所示。下列说法正确的是( )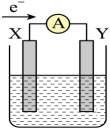 A、电子流动方向为:X电极→导线→Y电极→溶液→X电极 B、X电极上发生氧化反应,Y电极上发生还原反应 C、若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn D、氢气产生在X电极上,移向Y电极19. 化学电源在生活中有广泛的应用,各种电池的示意图如下,下列有关说法正确的是( )
A、电子流动方向为:X电极→导线→Y电极→溶液→X电极 B、X电极上发生氧化反应,Y电极上发生还原反应 C、若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn D、氢气产生在X电极上,移向Y电极19. 化学电源在生活中有广泛的应用,各种电池的示意图如下,下列有关说法正确的是( )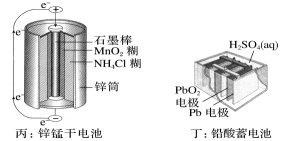
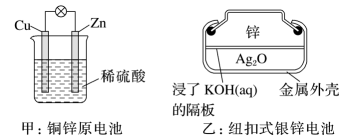 A、甲:电流由锌片经导线流向铜片 B、乙:负极的电极反应式为Zn-2e-=Zn2+ C、丙:锌筒作负极,发生氧化反应,使用一段时间锌筒会变薄 D、丁:使用一段时间后电解质溶液的酸性增强,导电能力增大20. 下列措施中,能够明显增大原反应化学反应速率的是( )A、在工业合成氨时,恒容条件下增加氮气的量 B、在利用Zn与H2SO4制取H2时,将稀硫酸改为浓硫酸 C、在稀硫酸与NaOH溶液反应时,增大压强 D、在Na与水反应时,增大水的用量21. 在某容器中发生反应 , 下列情况下能判断反应一定达到平衡状态的是( )A、容器内混合气体摩尔质量不再改变 B、容器内的压强不再改变 C、容器内各气体浓度相等时 D、断开键的同时断裂2mol H-O键22. 在不同条件下,分别测得反应 2SO2(g) + O2(g) ⇌ 2SO3(g)的速率如下,其中化学反应速率最快的是( )A、v(SO2) = 4 mol•L-1•min-1 B、v(O2) = 2 mol•L-1•min-1 C、v(SO3) = 1.5 mol•L-1•s-1 D、v(SO2) = 1 mol•L-1•s-123. 向容积为2.0 L的密闭容器中通入一定量的N2O4(无色气体)和NO2的混合气体,发生反应:N2O42NO2(g),反应吸热,体系中各物质的物质的量随时间的变化如图所示。下列有关说法正确的是( )
A、甲:电流由锌片经导线流向铜片 B、乙:负极的电极反应式为Zn-2e-=Zn2+ C、丙:锌筒作负极,发生氧化反应,使用一段时间锌筒会变薄 D、丁:使用一段时间后电解质溶液的酸性增强,导电能力增大20. 下列措施中,能够明显增大原反应化学反应速率的是( )A、在工业合成氨时,恒容条件下增加氮气的量 B、在利用Zn与H2SO4制取H2时,将稀硫酸改为浓硫酸 C、在稀硫酸与NaOH溶液反应时,增大压强 D、在Na与水反应时,增大水的用量21. 在某容器中发生反应 , 下列情况下能判断反应一定达到平衡状态的是( )A、容器内混合气体摩尔质量不再改变 B、容器内的压强不再改变 C、容器内各气体浓度相等时 D、断开键的同时断裂2mol H-O键22. 在不同条件下,分别测得反应 2SO2(g) + O2(g) ⇌ 2SO3(g)的速率如下,其中化学反应速率最快的是( )A、v(SO2) = 4 mol•L-1•min-1 B、v(O2) = 2 mol•L-1•min-1 C、v(SO3) = 1.5 mol•L-1•s-1 D、v(SO2) = 1 mol•L-1•s-123. 向容积为2.0 L的密闭容器中通入一定量的N2O4(无色气体)和NO2的混合气体,发生反应:N2O42NO2(g),反应吸热,体系中各物质的物质的量随时间的变化如图所示。下列有关说法正确的是( )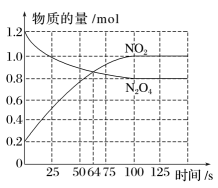 A、64 s时,反应达到化学平衡状态 B、到达化学平衡前,混合气体的颜色逐渐变深 C、若该容器与外界无热传递,则反应达到平衡前容器内气体的温度逐渐升高 D、前100 s内,用NO2浓度的变化表示的化学反应速率是0.008 mol·L-1·s-124. 用等浓度和等体积的盐酸与足量的石灰石反应,测量反应过程中产生的体积。实验I用的是块状的石灰石,实验II用的是粉末状石灰石。下列哪个图像能正确表示实验结果( )A、
A、64 s时,反应达到化学平衡状态 B、到达化学平衡前,混合气体的颜色逐渐变深 C、若该容器与外界无热传递,则反应达到平衡前容器内气体的温度逐渐升高 D、前100 s内,用NO2浓度的变化表示的化学反应速率是0.008 mol·L-1·s-124. 用等浓度和等体积的盐酸与足量的石灰石反应,测量反应过程中产生的体积。实验I用的是块状的石灰石,实验II用的是粉末状石灰石。下列哪个图像能正确表示实验结果( )A、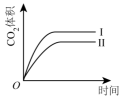 B、
B、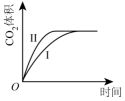 C、
C、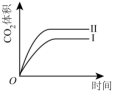 D、
D、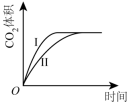
二、二、非选择题(本大题共4小题,共计52分)
-
25. 图1是自然界中硫元素的存在示意图,图2是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题:

 (1)、图2中N对应图1中物质的化学式为 , Y与金属铜反应所得产物的化学式为。(2)、X与Z反应中氧化剂与还原剂的物质的量之比为。(3)、碳和M的浓溶液反应生成Z的化学方程式为。(4)、为验证(3)中生成的气体产物,化学兴趣小组的同学们在教师指导下设计并进行如图实验:
(1)、图2中N对应图1中物质的化学式为 , Y与金属铜反应所得产物的化学式为。(2)、X与Z反应中氧化剂与还原剂的物质的量之比为。(3)、碳和M的浓溶液反应生成Z的化学方程式为。(4)、为验证(3)中生成的气体产物,化学兴趣小组的同学们在教师指导下设计并进行如图实验:
请将能得出对应结论的实验现象填入表中。
验证气体
实验现象
实验结论
SO2
有SO2产生
CO2
有CO2产生
(5)、从物质分类角度分析判断,下列物质不属于酸性氧化物的是__________(填字母)。A、SO2 B、SO3 C、SiO2 D、NO2(6)、Na2SO3溶液易变质,实验室检验Na2SO3溶液是否变质的基本操作是。26. 某化学兴趣小组为了制取氨气并探究其性质,按下列装置(部分夹持装置已略去)进行实验。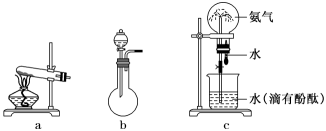
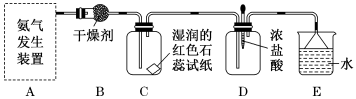 (1)、若氨气的发生装置选择a,则其化学反应方程式为;(2)、若氨气的发生装置选择b,则所用的试剂为和;(3)、B装置中的干燥剂可选用;实验中观察到C装置中的现象是;(4)、当实验进行一段时间后,挤压D装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是 , E中倒扣漏斗的作用是;(5)、用c装置做氨气喷泉实验可以说明氨气具有的性质是:;(6)、氨气(NH3)是一种重要的化工原料,其中约80%用来生产各种氮肥。其中利用NH3生产NH4NO3的主要转化途径如下(转化所需试剂及条件已略去):
(1)、若氨气的发生装置选择a,则其化学反应方程式为;(2)、若氨气的发生装置选择b,则所用的试剂为和;(3)、B装置中的干燥剂可选用;实验中观察到C装置中的现象是;(4)、当实验进行一段时间后,挤压D装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是 , E中倒扣漏斗的作用是;(5)、用c装置做氨气喷泉实验可以说明氨气具有的性质是:;(6)、氨气(NH3)是一种重要的化工原料,其中约80%用来生产各种氮肥。其中利用NH3生产NH4NO3的主要转化途径如下(转化所需试剂及条件已略去):①的化学方程为。
②的化学方程式为。
③列举两种不同类别的将HNO3转化为NH4NO3的化合物M:、。
27.(1)、I.硝酸钠在工农业生产中有着广泛的用途。现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如图所示。
沉淀A的主要成分是、(填化学式)。
(2)、③中反应的离子方程式是。(3)、溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是 , 为了除去杂质,可向溶液3中加入适量的。(4)、II.能源是现代社会发展的三大支柱之一,化学在提高能源的利用率和开发新能源中起到了重要的作用。电能是现代社会中应用最广泛的二次能源。下列装置中能够实现化学能转化为电能的是(填字母)。
 (5)、该装置正极材料为(填电极的化学式),发生了反应(氧化或还原)。(6)、若装置中转移了0.2mol电子,负极减少的质量是。(7)、用CH4和O2组合形成的质子交换膜燃料电池的结构如图:
(5)、该装置正极材料为(填电极的化学式),发生了反应(氧化或还原)。(6)、若装置中转移了0.2mol电子,负极减少的质量是。(7)、用CH4和O2组合形成的质子交换膜燃料电池的结构如图:
①电极d是(填“正极”或“负极”);
②若线路中转移2 mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为L。
28. 已知断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B的键能。下表列出了一些化学键的键能(E):化学键
H—H
O=O
O—H
E/(kJ·mol-1)
436
x
463
(1)、反应H2(g)+O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=。(2)、工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g),反应过程中的能量变化情况如图所示。
曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。
①计算当反应生成1.5molCH3OH(g)时,能量变化值是kJ。
②推测反应CH3OH(g)⇌CO(g)+2H2(g)是(填“吸热”或“放热”)反应。
(3)、为发展低碳经济,还有科学家提出可以用氧化锆锌作催化剂,将CO2转化为重要有机原料CH3OH,该反应的化学方程式为。在容积为2 L的恒温密闭容器中,充入1 mol CO2和3 mol H2 , 一段时间内CO2和CH3OH的物质的量随时间的变化如表所示。时间
0 min
3 min
6 min
9 min
12 min
n(CH3OH)
0 mol
0.50 mol
0.65 mol
0.75 mol
0.75 mol
n(CO2)
1 mol
0.50 mol
0.35 mol
a
0.25 mol
①上表中,a为mol。
②由表可知,3~6 min内,v(CO2)=mol·L-1·min-1。
③对于上述反应,下列叙述正确的是。
A.当各气体的浓度不再改变时,该反应一定已达平衡状态。
B.当该反应达到平衡后,。
C.由表可知,3 min时CH3OH的生成速率大于12 min时CH3OH的分解速率。