海南省白沙县2023届高三水平调研测试化学试题
试卷更新日期:2023-05-11 类型:高考模拟
一、选择题
-
1. “纳米材料”是粒子直径为几纳米至几十纳米的材料,纳米碳就是其中一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )
①是溶液②是胶体③能产生丁达尔效应④能透过滤纸⑤不能透过滤纸⑥静置后会析出黑色沉淀
A、①④⑤ B、②③④ C、②③⑤ D、①③④⑥2. 可消除酸性电镀废水中时 , 反应的离子方程式为。下列说法正确的是( )A、为极性分子 B、的电子式: C、氯原子的结构示意图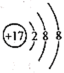 D、1个分子中含有2个π键
3. 下列有关化学用语表示正确的是( )A、过氧化钠的化学式:NaO B、钠离子的结构示意图:
D、1个分子中含有2个π键
3. 下列有关化学用语表示正确的是( )A、过氧化钠的化学式:NaO B、钠离子的结构示意图: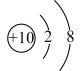 C、次氯酸钠(NaClO)中Cl元素的化合价:+1
D、NaClO的电离方程式:NaClO=Na++Cl++O2-
4. 部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
C、次氯酸钠(NaClO)中Cl元素的化合价:+1
D、NaClO的电离方程式:NaClO=Na++Cl++O2-
4. 部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( ) A、在水溶液中,a可与e反应生成b B、e只能被还原 C、可将e的溶液加入NaOH溶液中制得d(OH)3胶体 D、可存在b→c→d→e→b的循环转化关系5. 下列电离方程式正确的是( )A、 B、 C、 D、6. 在同温同压下的两个容积相同的容器中,一个盛有HCl气,另一个盛有H2和Cl2气,两容器内的气体一定具有相同的( )A、原子数 B、密度 C、质量 D、摩尔质量7. 下列各组离子在溶液中能大量共存,加入氢氧化钠溶液有沉淀生成,加入盐酸有气体生成的一组离子是( )A、、Na+ 、Ba2+、 B、K+、Mg2+ 、Cl- 、 C、、 、、Na+ D、、Cl- 、 、K+8. 下列操作可能使所配Na2CO3溶液浓度偏大的是( )A、烧杯和玻璃棒未洗涤 B、称量前Na2CO3·10H2O固体已失去部分结晶水 C、加水时超过刻度线,用胶头滴管吸出多余的液体 D、上下颠倒摇匀后溶液液面低于刻度线,补充加水至刻度线9. 向含有NH4+、Mg2+、Fe2+和Al3+的溶液中加入足量Na2O2微热并搅拌后,再加入过量稀盐酸,溶液中大量减少的离子是( )A、NH4+ B、Fe2+ C、Mg2+ D、Al3+10. NA表示阿伏加德罗常数,下列有关物质结构说法正确的是( )A、NaH的电子式为:
A、在水溶液中,a可与e反应生成b B、e只能被还原 C、可将e的溶液加入NaOH溶液中制得d(OH)3胶体 D、可存在b→c→d→e→b的循环转化关系5. 下列电离方程式正确的是( )A、 B、 C、 D、6. 在同温同压下的两个容积相同的容器中,一个盛有HCl气,另一个盛有H2和Cl2气,两容器内的气体一定具有相同的( )A、原子数 B、密度 C、质量 D、摩尔质量7. 下列各组离子在溶液中能大量共存,加入氢氧化钠溶液有沉淀生成,加入盐酸有气体生成的一组离子是( )A、、Na+ 、Ba2+、 B、K+、Mg2+ 、Cl- 、 C、、 、、Na+ D、、Cl- 、 、K+8. 下列操作可能使所配Na2CO3溶液浓度偏大的是( )A、烧杯和玻璃棒未洗涤 B、称量前Na2CO3·10H2O固体已失去部分结晶水 C、加水时超过刻度线,用胶头滴管吸出多余的液体 D、上下颠倒摇匀后溶液液面低于刻度线,补充加水至刻度线9. 向含有NH4+、Mg2+、Fe2+和Al3+的溶液中加入足量Na2O2微热并搅拌后,再加入过量稀盐酸,溶液中大量减少的离子是( )A、NH4+ B、Fe2+ C、Mg2+ D、Al3+10. NA表示阿伏加德罗常数,下列有关物质结构说法正确的是( )A、NaH的电子式为: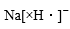 B、78克Na2O2晶体中所含阴阳离子总数为3NA
C、CCl4和PCl5分子中所有原子的最外层都达到了8电子稳定结构
D、浓硫酸溶于水电离出H+和SO并放出大量的热,所以浓硫酸溶于水属于放热反应
11. 氧元素的非金属性比氯元素的非金属性强,下列说法中,能支持该结论的是( )A、相同条件下,氯气与铁反应生成氯化铁,氧气与铁反应生成四氧化三铁 B、氧元素与氯元素形成的化合物中,氧元素显负化合价,氯元素显正化合价 C、氧原子最外层电子数比氯原子最外层电子数少 D、氧原子的半径比氯原子的半径小12. 下列根据实验操作和现象所得出的结论正确的是( )
B、78克Na2O2晶体中所含阴阳离子总数为3NA
C、CCl4和PCl5分子中所有原子的最外层都达到了8电子稳定结构
D、浓硫酸溶于水电离出H+和SO并放出大量的热,所以浓硫酸溶于水属于放热反应
11. 氧元素的非金属性比氯元素的非金属性强,下列说法中,能支持该结论的是( )A、相同条件下,氯气与铁反应生成氯化铁,氧气与铁反应生成四氧化三铁 B、氧元素与氯元素形成的化合物中,氧元素显负化合价,氯元素显正化合价 C、氧原子最外层电子数比氯原子最外层电子数少 D、氧原子的半径比氯原子的半径小12. 下列根据实验操作和现象所得出的结论正确的是( )选项
实验操作
实验现象
结论
A
将NaOH溶液逐滴滴加到溶液中至过量
先产生白色胶状沉淀,后沉淀溶解
是两性氢氧化物
B
测定等浓度的和的溶液的pH
前者pH比后者大
非金属性:S>C
C
向2.0mL浓度均为的KCl、KI混合溶液中滴加1~2滴溶液,振荡
沉淀呈黄色
D
分别向两支盛有醋酸和饱和硼酸溶液的试管中滴加等浓度溶液
前者产生无色气泡,后者无明显现象
酸性:醋酸>碳酸>硼酸
A、A B、B C、C D、D13. 二氧化氯(ClO2)是一种黄绿色易溶于水的气体,是一种安全无毒的绿色消毒剂,常用于饮用水消毒。下列有关ClO2制备与杀菌的说法不合理的是( )A、NaClO2在酸性条件下歧化生成ClO2和NaCl,则n(氧化剂)∶n(还原剂)=4∶1 B、ClO2在强碱性环境中使用失效,可能的原因是2ClO2+2OH-=++H2O C、可用饱和食盐水除去ClO2中的NH3 D、ClO2的消毒效率(单位质量的氧化剂得到的电子数)是Cl2的2.63倍14. 设NA为阿伏加德常数的值,下列说法正确的是( )A、1 mol Na2O2固体中含离子总数为4NA B、标准状况下,22.4 L氨水含有NA个NH3分子 C、丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA D、室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA二、非选择题
-
15. 下表是元素周期表的一部分,按要求回答下列问题:
族周期
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
1
①
2
②
③
④
⑤
3
⑥
⑦
⑧
⑨
(1)、⑦的原子结构示意图为 , ⑨的单质的电子式为。(2)、②③④三种元素对应的简单氢化物中最稳定的是(填化学式,下同)。上述九种元素中,最高价氧化物的水化物酸性最强的化合物的化学式是。(3)、③、④、⑥、⑦的简单离子半径由大到小的顺序是(用离子符号表示)。(4)、根据“对角线规则”,Be与Al具有相似的化学性质,请写出与⑥的最高价氧化物的水化物反应的化学方程式。(生成的盐中阴阳离子个数比为1∶2)。16. 锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患.(1)、某锅炉水垢的主要成分有、、、 , 用酸洗法可除去该水垢,其基本原理如图1所示.
酸洗时,为使水垢尽可能溶解,不宜选用的是 填标号 .
A.稀硫酸 盐酸 硝酸 醋酸
不溶物用碳酸钠溶液浸泡时,反应的离子方程式是 .
洗出液中的会腐蚀铁质管道,反应的离子方程式是 ,因此,常在洗出液中加入具有强还原性的溶液,反应中的与的物质的量之比为1:2,转化为 填离子符号 .
柠檬酸用表示可用作酸洗剂,溶液中、、、的含量与pH的关系如图2所示.图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是 调节柠檬酸溶液的 , 有利于除去水垢中的氧化铁.时,溶液中上述4种微粒含量最多的是 .
 (2)、利用下图所示装置对锅炉水含、、进行预处理,可有效防止锅炉水垢的形成. 电解过程中,、在 填“a”或“b”极附近形成沉淀.17. 过氧化氢是一种常用的绿色试剂,某学习小组针对性质进行如下实验。(1)、I.验证的还原性
(2)、利用下图所示装置对锅炉水含、、进行预处理,可有效防止锅炉水垢的形成. 电解过程中,、在 填“a”或“b”极附近形成沉淀.17. 过氧化氢是一种常用的绿色试剂,某学习小组针对性质进行如下实验。(1)、I.验证的还原性查阅资料:溶液与氯水发生反应时表现还原性。
制取氯水

①仪器X的名称是 , 生成的化学方程式为 。
②饱和食盐水的作用是 。
(2)、取5mL上述新制饱和氯水于试管中,向其中加入溶液至过量,产生大量气泡该气体可使余烬复燃 , 还观察到溶液颜色发生的变化是 。(3)、Ⅱ.探究、对分解的影响选用溶液和溶液,探究、对分解的影响。记录数据如下:

实验序号
添加试剂及用量
完全分解所需时间
1
溶液
2
溶液
实验结果显示 , 可得出的结论是:填化学式更有利于分解。
(4)、甲同学查阅资料得知:能加速分解,对分解无影响。为排除干扰,该同学进行实验:向两份溶液中分别加入amL浓度均为 的 填化学式溶液和 填化学式溶液。内,发现均几乎不分解。甲同学认为:在无存在的情况下,、对催化分解无影响。18. 咖啡酸乙酯具有抗炎作用且有治疗自身免疫性疾病的潜力,其合成路线如图所示: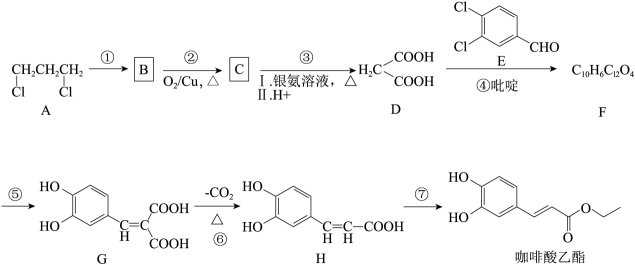
已知:R-CHO+
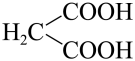
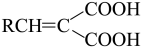 (1)、E中官能团的名称是;反应②所属反应类型是 。(2)、反应①的化学方程式。(3)、F的结构简式 。(4)、芳香族化合物M是H的同分异构体,1 mol M与足量碳酸氢钠溶液反应生成2 mol CO2 , M的结构共有种。(5)、设计由苯甲醇(
(1)、E中官能团的名称是;反应②所属反应类型是 。(2)、反应①的化学方程式。(3)、F的结构简式 。(4)、芳香族化合物M是H的同分异构体,1 mol M与足量碳酸氢钠溶液反应生成2 mol CO2 , M的结构共有种。(5)、设计由苯甲醇( )和丙二酸(
)和丙二酸( )为原料合成苯丙烯酸(
)为原料合成苯丙烯酸( )的路线流程图(其它无机试剂任选)。 19. 乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。(1)、CaC2中与互为等电子体,的电子式可表示为; 1mol 中含有的π键数目为。(2)、将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为。(3)、乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是;分子中处于同一直线上的原子数目最多为。(4)、CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),则该晶胞中的碳原子个数为。 CaC2晶体中含有的中哑铃形的存在,使晶胞沿一个方向拉长。CaC2 晶体中1个Ca2+周围距离最近的数目为。
)的路线流程图(其它无机试剂任选)。 19. 乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。(1)、CaC2中与互为等电子体,的电子式可表示为; 1mol 中含有的π键数目为。(2)、将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为。(3)、乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是;分子中处于同一直线上的原子数目最多为。(4)、CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),则该晶胞中的碳原子个数为。 CaC2晶体中含有的中哑铃形的存在,使晶胞沿一个方向拉长。CaC2 晶体中1个Ca2+周围距离最近的数目为。