高中化学(人教2019)选择性必修二期末知识点复习9 配合物与超分子
试卷更新日期:2023-05-10 类型:复习试卷
一、单选题
-
1. 硫酸镍溶于氨水形成蓝色溶液,下列说法错误的是A、原子3d能级上的未成对电子数为1 B、产提供孤电子对的成键原子是N C、中与之间形成配位键 D、中阴离子的立体构型是正四面体形2. 下列分子或离子中不能作为配合物的配体的是A、 B、 C、H2O D、NO3. 向盛有硫酸铜溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法中,正确的是( )A、反应后溶液中没有沉淀,所以反应前后溶液中Cu2+的浓度不变 B、沉淀溶解后的深蓝色溶液含有配离子[Cu(NH3)4]2+ C、在[Cu(NH3)4]2+中,Cu2+给出孤对电子 D、向反应后的溶液中加入乙醇,溶液没有变化,因为[Cu(NH3)4]2+不与乙醇反应4. 往溶液中加入过量的 , 直到生成的沉淀恰好溶解为止,得到深蓝色溶液,再加入后,析出深蓝色晶体。下列分析错误的是( )A、析出的深蓝色晶体化学式为 B、加的作用是减小“溶剂”的极性,降低溶质的溶解度 C、加入氨水的过程中的浓度不断减小 D、中配体和中心离子的杂化轨道类型一定都是杂化5. 离子液体可在室温下以和为原料合成DMC,具体流程如下(其中化合物①的1号C上没有H原子),下列说法错误的是( )
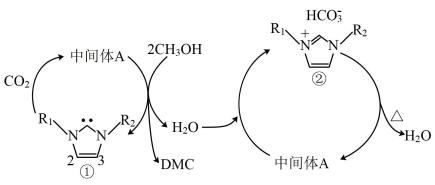 A、化合物①可作为配体与某些金属离子形成配合物 B、①→A是加成反应,则A的结构可能为
A、化合物①可作为配体与某些金属离子形成配合物 B、①→A是加成反应,则A的结构可能为 C、在上述流程中,中间体A还起到了吸水作用
D、根据流程可知,DMC的结构为
C、在上述流程中,中间体A还起到了吸水作用
D、根据流程可知,DMC的结构为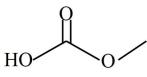 6. K3[Fe(CN)6]俗称赤血盐、赤血盐钾,化学上常用于检验亚铁离子。下列关于K3[Fe(CN)6]的说法错误的是( )A、该化合物中的Fe为+3价 B、1molK3[Fe(CN)6]中含有的σ键数目为6NA C、配体是CN- , 配位数为6 D、铁离子提供空轨道7. 关于化学式[TiCl(H2O)5]Cl2·H2O的配合物的下列说法中正确的是( )A、配位体是Cl-和H2O,配位数是8 B、中心离子是Ti4+ , 配离子是[TiCl(H2O)5]2+ C、内界和外界中的Cl-的数目比是1:2 D、在1mol该配合物中加入足量AgNO3溶液,可以得到3molAgCl沉淀8. 甘氨酸铜是一种配合物,能溶于水,常用于医药、电镀,其结构如图所示。下列关于甘氨酸铜的说法错误的是( )
6. K3[Fe(CN)6]俗称赤血盐、赤血盐钾,化学上常用于检验亚铁离子。下列关于K3[Fe(CN)6]的说法错误的是( )A、该化合物中的Fe为+3价 B、1molK3[Fe(CN)6]中含有的σ键数目为6NA C、配体是CN- , 配位数为6 D、铁离子提供空轨道7. 关于化学式[TiCl(H2O)5]Cl2·H2O的配合物的下列说法中正确的是( )A、配位体是Cl-和H2O,配位数是8 B、中心离子是Ti4+ , 配离子是[TiCl(H2O)5]2+ C、内界和外界中的Cl-的数目比是1:2 D、在1mol该配合物中加入足量AgNO3溶液,可以得到3molAgCl沉淀8. 甘氨酸铜是一种配合物,能溶于水,常用于医药、电镀,其结构如图所示。下列关于甘氨酸铜的说法错误的是( ) A、该配合物呈电中性 B、Cu的化合价为+2 C、配位数为2 D、提供电子对的原子为N、O9. Zn(OH)2溶于氨水可生成可溶性配合物[Zn(NH3)4](OH)2 , 下列说注正确的是( )A、根据上述信息可推导出氢氧化锌为两性氢氧化物 B、该配合物中只有离子键和配位键 C、形成该配合物的离子方程式为:Zn(OH)2+4NH3=[Zn(NH3)4]2++2OH- D、该配合离子中由NH3提供空轨道,Zn2+提供电子对10. 配合物种类繁多,在分析化学、工业生产以及生物学中有广泛应用。已知某配合物的化学式为 , 下列有关说法正确的是( )A、配体是和 , 配位数是9 B、该配合物中提供孤电子对的是中心离子 C、该配合物中存在离子键、配位键和极性键 D、向其溶液中加入足量溶液,所有都能转化为沉淀11. 已知配合物[Cr(NH3)4Cl2]Cl易溶于水,下列说法正确的是( )A、配位数为6,配位原子为N、Cl B、1mol该配合物在水中可电离出3molCl- C、配合物中Cr为+1价 D、配离子中含有离子键、配位键、普通共价键12. 用相同浓度的和溶液进行实验:
A、该配合物呈电中性 B、Cu的化合价为+2 C、配位数为2 D、提供电子对的原子为N、O9. Zn(OH)2溶于氨水可生成可溶性配合物[Zn(NH3)4](OH)2 , 下列说注正确的是( )A、根据上述信息可推导出氢氧化锌为两性氢氧化物 B、该配合物中只有离子键和配位键 C、形成该配合物的离子方程式为:Zn(OH)2+4NH3=[Zn(NH3)4]2++2OH- D、该配合离子中由NH3提供空轨道,Zn2+提供电子对10. 配合物种类繁多,在分析化学、工业生产以及生物学中有广泛应用。已知某配合物的化学式为 , 下列有关说法正确的是( )A、配体是和 , 配位数是9 B、该配合物中提供孤电子对的是中心离子 C、该配合物中存在离子键、配位键和极性键 D、向其溶液中加入足量溶液,所有都能转化为沉淀11. 已知配合物[Cr(NH3)4Cl2]Cl易溶于水,下列说法正确的是( )A、配位数为6,配位原子为N、Cl B、1mol该配合物在水中可电离出3molCl- C、配合物中Cr为+1价 D、配离子中含有离子键、配位键、普通共价键12. 用相同浓度的和溶液进行实验:

下列说法错误的是( )
A、相同浓度的和溶液中,的浓度不同 B、提供空轨道,提供孤电子对,两者以配位键结合成 C、溶液2不显红色,说明与的结合力强于与的结合力 D、由对比实验可知,用溶液检验溶液中的比用KSCN溶液更好13. 下列对有关事实的解释正确的是( )事实
解释
A
石墨晶体中横向与纵向的导电性不同
晶体性质表现自范性
B
CH4与NH3分子的空间构型不同
二者中心原子杂化轨道类型不同
C
H2O的热稳定性比H2S强
H2O分子间形成氢键,而H2S分子间没有形成氢键
D
向盛有硫酸铜蓝色溶液的试管里加入过量氨水,得到深蓝色溶液
NH3与Cu2+间的配位键比H2O与Cu2+间的配位键强
A、A B、B C、C D、D14. 下列说法中,正确的是( )A、从空间角度看,2s轨道比1s轨道大,其空间包含了1s轨道 B、第一电离能的大小可以作为判断元素金属性强弱的依据 C、原子的电子层数越多,原子半径越大 D、硫化氢和水分子结构相似,硫化氢晶体中的配位数与冰中水分子的配位数相同二、多选题
-
15. 溶于水后加氨水先生成沉淀,再加氨水,因生成使沉淀溶解,此时向溶液中通入空气,得到的产物中有一种的组成可以用表示,其中Co的配位数是6,把分离出的溶于水后立即加溶液,有AgCl沉淀析出。经测定,每只生成2molAgCl。下列说法错误的是( )A、表示成配合物结构形式为 B、通入空气后得到的溶液中含有 C、上述反应不涉及氧化还原反应 D、中提供孤电子对,提供空轨道
三、综合题
-
16. 回答下列问题:(1)、固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构。(2)、基态Zn的价层电子排布式 , 金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为。(3)、NH3的中心原子的杂化方式为 , NH3中H-N-H键角PH3中H-P-H键角(填“大于”、“小于”或“等于”)。(4)、立方ZnS晶体结构如下图所示,其晶胞边长为a pm,密度为g/cm3 , A位S2-离子与B位置Zn2+离子之间的距离为pm(列式表示)。
 17. 在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的离子反应方程式:。回答下列问题:(1)、写出基态的核外电子排布式:。(2)、配离子中心原子的配位数为 , 配位原子为。(3)、经测定发现,固体由和两种离子组成,的空间构型为;与互为等电子体的分子有(写出一种)。(4)、石墨可作润滑剂,其主要原因是。(5)、一种金铜合金晶体具有面心立方最密堆积结构,其晶胞如图A所示。
17. 在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的离子反应方程式:。回答下列问题:(1)、写出基态的核外电子排布式:。(2)、配离子中心原子的配位数为 , 配位原子为。(3)、经测定发现,固体由和两种离子组成,的空间构型为;与互为等电子体的分子有(写出一种)。(4)、石墨可作润滑剂,其主要原因是。(5)、一种金铜合金晶体具有面心立方最密堆积结构,其晶胞如图A所示。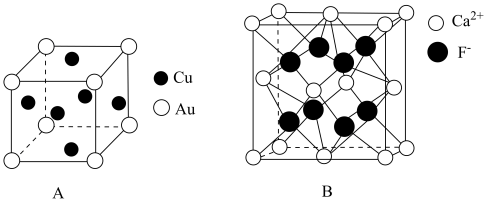
①该晶体中金属原子之间的作用力为。
②该晶体具有储氢功能,氢原子可进入到由Cu原子和Au原子构成的四面体空隙中,若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与(如图B)的结构相似,该晶体储氢后的化学式为。
③已知该合金密度为 , 铜的原子半径为127.8pm,阿伏加德罗常数值为NA , 则Au原子半径r(Au)= =pm(列出计算式)。
18. 铁元素被称为“人类第一元素”,铁及其化合物具有广泛的应用,回答下列问题。(1)、铁在元素周期表第四周期族,属于区元素,基态铁原子M层电子的排布式为。(2)、铁形成的常见离子有和 , 易被氧化为 , 请利用核外电子排布的相关原理解释其原因:。(3)、检验是否被氧化为的方法之一是取待测液,加入溶液,观察是否有红色的生成。①中的配位数为。
②配体中心C原子的杂化方式为:。
③O、N、S三种元素的电负性由大到小的顺序为。
(4)、铁酸钇是一种典型的单相多铁性材料,其正交晶胞结构如图a所示,沿z轴与x轴的投影图分别如图b和图c所示。
①该晶体中原子个数比为:。
②若晶胞参数分别为a、b、c , 阿伏加德罗常数的值为 , 则晶体的密度为(列出计算表达式)。
19. 元素周期表中第四周期元素形成的化合物性质丰富,回答下列问题:(1)、复兴号高铁车体材质用到、等元素。的一种配合物化学式为 , 下列说法正确的是____(填字母标号)。A、与原子配位时,提供孤电子对的是C原子 B、原子的配位数为6 C、中C原子的杂化类型为 D、中键与键数目之比为5∶2(2)、能形成化合物 , 在该化合物中不含____(填字母标号)。A、键 B、键 C、配位键 D、离子键 E、极性键 F、非极性键(3)、中的键角比的键角(填“大”或“小”)原因是。(4)、在催化作用下,呋喃( )可与氨反应,转化为吡咯(
)可与氨反应,转化为吡咯( )。二者熔、沸点关系为:呋喃吡咯(填“高于”或“低于”),原因是。 (5)、的晶胞结构如图甲所示,其中离子坐标参数A为 , B为 , 则C的离子坐标参数为。一定温度下,晶体可以自发地分散并形成“单分子层”,可以认为作密置单层排列,填充其中(如图乙),已知的半径为 , 设阿伏加德罗常数值为 , 每平方米面积上具有该晶体的质量为g(用含a、的代数式表示)。
)。二者熔、沸点关系为:呋喃吡咯(填“高于”或“低于”),原因是。 (5)、的晶胞结构如图甲所示,其中离子坐标参数A为 , B为 , 则C的离子坐标参数为。一定温度下,晶体可以自发地分散并形成“单分子层”,可以认为作密置单层排列,填充其中(如图乙),已知的半径为 , 设阿伏加德罗常数值为 , 每平方米面积上具有该晶体的质量为g(用含a、的代数式表示)。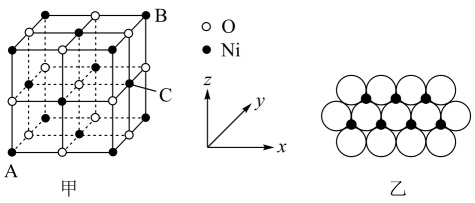 20. 氮族元素是指元素周期表中VA族的所有元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)等元素,在农药、化肥等领域有广泛应用。回答下列问题:(1)、基态Bi的价电子排布图为。(2)、中和中键角较大的是。(3)、氮元素的常见含氧酸根为 , 其空间构型为。(4)、和可形成配离子 , 该配离子中各元素的第一电离能由小到大的顺序为(用元素符号表示)。21. 磷及其化合物在工业生产中起着重要的作用。(1)、基态磷原子价电子的轨道表示式为。(2)、磷有多种同素异形体。
20. 氮族元素是指元素周期表中VA族的所有元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)等元素,在农药、化肥等领域有广泛应用。回答下列问题:(1)、基态Bi的价电子排布图为。(2)、中和中键角较大的是。(3)、氮元素的常见含氧酸根为 , 其空间构型为。(4)、和可形成配离子 , 该配离子中各元素的第一电离能由小到大的顺序为(用元素符号表示)。21. 磷及其化合物在工业生产中起着重要的作用。(1)、基态磷原子价电子的轨道表示式为。(2)、磷有多种同素异形体。①白磷()是分子晶体,易溶于 , 难溶于水,说明白磷和都是分子(填“极性”或“非极性”)。
②黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体是与石墨类似的层状结构,如图所示。
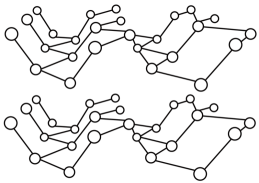
下列有关黑磷晶体的说法正确的是(填字母序号)
A.黑磷晶体中层与层之间的作用力是分子间作用力
B.黑磷晶体中磷原子杂化方式为杂化
C.黑磷晶体是混合型晶体
D.黑磷晶体的每一层中磷原子都在同一平面上
(3)、是一种白色晶体,熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子(该晶体的晶胞如图所示),写出熔融时的电离方程式。 (4)、与水会形成黄色的配离子 , 为避免颜色干扰,常在含溶液中加入形成无色的。由此推测与形成的配离子更稳定的配体是 , 该配体的空间构型是。(5)、贵金属磷化物(化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图所示。已知晶胞参数为 , 晶体中与P距离最近的Rh的数目为 , 晶体的密度为(列出计算式)。
(4)、与水会形成黄色的配离子 , 为避免颜色干扰,常在含溶液中加入形成无色的。由此推测与形成的配离子更稳定的配体是 , 该配体的空间构型是。(5)、贵金属磷化物(化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图所示。已知晶胞参数为 , 晶体中与P距离最近的Rh的数目为 , 晶体的密度为(列出计算式)。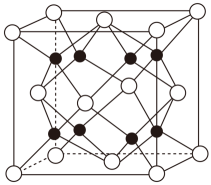 22. 铜及其化合物应用广泛。请回答下列问题:(1)、铜的晶胞结构如图,铜原子的配位数为 , 一个金属铜晶胞中所含的铜原子数为;基态铜原子的价电子排布式为。
22. 铜及其化合物应用广泛。请回答下列问题:(1)、铜的晶胞结构如图,铜原子的配位数为 , 一个金属铜晶胞中所含的铜原子数为;基态铜原子的价电子排布式为。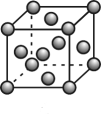 (2)、硫酸铜晶体俗称蓝矾、胆矾,具有催吐、解毒作用,同时也是一种重要的化工原料,具有十分广泛的作用。的空间构型为 , 其中心原子的杂化类型是。(3)、不溶于水,但可溶于浓氨水,反应的化学方程式为:。
(2)、硫酸铜晶体俗称蓝矾、胆矾,具有催吐、解毒作用,同时也是一种重要的化工原料,具有十分广泛的作用。的空间构型为 , 其中心原子的杂化类型是。(3)、不溶于水,但可溶于浓氨水,反应的化学方程式为:。①氨水中的微粒存在的化学键有(填标号)。
A.极性键 B.非极性键 C.氢键 D.键 E.键
②中配体是 , 所含元素中电负性最大的非金属元素是 (填元素符号)。
③中含mol 键。
(4)、的熔点比高的原因是。23. K、Cu、Si、H、C、N等元素单质的熔点高低的顺序如图所示,其中c、d均是热和电的良导体。
回答下列问题:
(1)、图中d单质对应元素基态原子的电子排布式为。(2)、单质a、f对应的元素以原子个数比1∶1形成的分子(相同条件下对的相对密度为13)中所含键和键的个数比为 , 其中f原子的杂化轨道类型为。(3)、a与b的元素形成的10电子中性分子X的空间构型为;将X溶于水后的溶液滴入到d的硫酸盐溶液中至过量,得到配合物的化学式为 , 其中d离子的配位数为。(4)、e、f单质对应元素的简单气态氢化物的热稳定性(用相应的化学式表示)> , 原因是。(5)、c与氧元素和碘元素形成的一种晶体是一种性能良好的光学材料,其晶胞为立方体,棱长为0.446nm,晶胞中c原子、氧原子和碘原子分别处于顶点、面心和体心位置,如图所示。该晶体的化学式为 , 与c原子紧邻的氧原子有个。该晶体中c原子与氧原子间的最短距离为nm。 24. 不锈钢是不锈耐酸钢的简称,不锈钢的种类目前有100多种,主要组成元素是铁、碳、铬、镍、铜等,不锈钢在国民生产生活和国防建设中有着广泛应用。回答下列问题:(1)、基态Cr原子的价层电子排布式为。第二电离能(填“大于”或“小于”)。(2)、氟与氯同主族,的熔点为1100℃,熔化时能导电;的熔点为83℃,易溶于水和乙醇。的熔点比高得多,这是因为。(3)、向盛有少量蒸馏水的试管里滴加2滴溶液,然后再滴加两滴KSCN溶液,未观察到溶液变红。回答下列问题:
24. 不锈钢是不锈耐酸钢的简称,不锈钢的种类目前有100多种,主要组成元素是铁、碳、铬、镍、铜等,不锈钢在国民生产生活和国防建设中有着广泛应用。回答下列问题:(1)、基态Cr原子的价层电子排布式为。第二电离能(填“大于”或“小于”)。(2)、氟与氯同主族,的熔点为1100℃,熔化时能导电;的熔点为83℃,易溶于水和乙醇。的熔点比高得多,这是因为。(3)、向盛有少量蒸馏水的试管里滴加2滴溶液,然后再滴加两滴KSCN溶液,未观察到溶液变红。回答下列问题:①在水中可以电离出配离子 , 该配离子中的配体是 , 该配离子中含有的键与键的数目之比是。
②依据观察到的实验现象说明和的性质不同,原因是。
(4)、铜的硫化物有CuS和两种,它们的晶胞具有相同的俯视图(如图2所示),晶胞中的位置(如图1所示),铜离子位于所构成的四面体中心,已知CuS和的晶胞参数分别为apm和bpm,阿伏加德罗常数的值为。
①CuS晶体中,铜离子与硫离子间的最短距离为pm。
②晶体的密度为(列出计算式即可)。
25. 第四周期的过渡元素许多金属能形成配合物,请回答下列问题:(1)、Mn的核外价电子排布式为。(2)、向溶液中滴入(乙二胺四乙酸)(配体为价阴离子)试剂(调节一定的pH)可得配合物A,其配离子结构如图所示,(M代表Zn)则一个与个原子之间形成的配位键,图中配体的化学式为。 (3)、配合物的熔点为 , 沸点为。可用于制备纯铁。的结构如图所示。下列关于的说法正确的是____(填字母)。
(3)、配合物的熔点为 , 沸点为。可用于制备纯铁。的结构如图所示。下列关于的说法正确的是____(填字母)。 A、C的电负性小于O B、是非极性分子,CO是极性分子 C、中Fe原子以杂化方式与CO成键 D、反应中没有新化学键生成(4)、已知NiO的晶体结构(如图所示), , 的离子半径分别为69pm和14pm,已知邻近同种离子不相切,异种离子相切,则图中(填“可以”或“不可以”)看作8个晶胞堆积而成,NiO晶体的密度是(列出计算式即可)。
A、C的电负性小于O B、是非极性分子,CO是极性分子 C、中Fe原子以杂化方式与CO成键 D、反应中没有新化学键生成(4)、已知NiO的晶体结构(如图所示), , 的离子半径分别为69pm和14pm,已知邻近同种离子不相切,异种离子相切,则图中(填“可以”或“不可以”)看作8个晶胞堆积而成,NiO晶体的密度是(列出计算式即可)。 26. 材料是人类赖以生存和发展的重要物质基础。请回答下列问题;(1)、下列金属材料的性质能用电子气理论解释的是____(填序号)A、易腐蚀 B、易导电 C、易导热 D、有延展性(2)、工业上采用氰化法提炼金的同时生成[Zn(CN)4]2- , [Zn(CN)4]2-中配位原子是C,[Zn(CN)4]2-的结构式为;其中含有的σ键与π键的数目之比为。(3)、立方氮化硼是一种超硬、耐磨、耐高温的新型材料,在机械加工行业有着广泛的应用,结构与金刚石相似,晶胞如图所示。
26. 材料是人类赖以生存和发展的重要物质基础。请回答下列问题;(1)、下列金属材料的性质能用电子气理论解释的是____(填序号)A、易腐蚀 B、易导电 C、易导热 D、有延展性(2)、工业上采用氰化法提炼金的同时生成[Zn(CN)4]2- , [Zn(CN)4]2-中配位原子是C,[Zn(CN)4]2-的结构式为;其中含有的σ键与π键的数目之比为。(3)、立方氮化硼是一种超硬、耐磨、耐高温的新型材料,在机械加工行业有着广泛的应用,结构与金刚石相似,晶胞如图所示。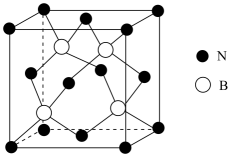
①立方氮化硼熔点比金刚石低,原因是。
②一个N原子周围紧邻的N原子有个。
③晶体中含有配位键,提供空轨道的原子是原子。
④若晶胞参数为α nm,设阿伏加德罗常数的值为NA , 则晶体的密度为g/cm3(用含α、NA的表达式表示)。
-