高中化学(人教2019)选择性必修二期末知识点复习7 分子晶体与共价晶体
试卷更新日期:2023-05-10 类型:复习试卷
一、单选题
-
1. 冰的晶胞结构如图所示。下列相关说法错误的是
 A、硫化氢晶体结构和冰相似 B、冰晶体中,相邻的水分子均以氢键结合 C、晶胞中Z方向上的两个氧原子最短距离为d,则冰晶胞中的氢键键长为d D、冰晶体中分子间氢键存在方向性、饱和性,晶体有较大空隙,因此密度比液态水小2. 二茂铁的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醛等有机溶剂。下列说法错误的是A、二茂铁属于分子晶体 B、在二茂铁中,与之间形成的化学键类型是离子键 C、1mol环戊二烯中含有σ键数目为 D、已知环戊二烯的结构式为
A、硫化氢晶体结构和冰相似 B、冰晶体中,相邻的水分子均以氢键结合 C、晶胞中Z方向上的两个氧原子最短距离为d,则冰晶胞中的氢键键长为d D、冰晶体中分子间氢键存在方向性、饱和性,晶体有较大空隙,因此密度比液态水小2. 二茂铁的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醛等有机溶剂。下列说法错误的是A、二茂铁属于分子晶体 B、在二茂铁中,与之间形成的化学键类型是离子键 C、1mol环戊二烯中含有σ键数目为 D、已知环戊二烯的结构式为 , 则其中仅有1个碳原子采取杂化
3. 下列物质中,属于含有非极性共价键的分子晶体的是A、Si B、HCl C、N2 D、NH4Cl4. 下列物质不属于分子晶体的是( )A、冰 B、二氧化硅 C、碘 D、固态的氩5. 科学家成功将转化为类似结构的共价晶体,下列说法正确的是( )A、共价晶体易升华 B、共价晶体硬度小于 C、共价晶体中C原子的杂化方式为sp D、由分子晶体转化为共价晶体是化学变化6. 干冰(固态二氧化碳)在-78℃时可直接升华为气体,其晶胞结构如图所示。下列说法错误的是( )
, 则其中仅有1个碳原子采取杂化
3. 下列物质中,属于含有非极性共价键的分子晶体的是A、Si B、HCl C、N2 D、NH4Cl4. 下列物质不属于分子晶体的是( )A、冰 B、二氧化硅 C、碘 D、固态的氩5. 科学家成功将转化为类似结构的共价晶体,下列说法正确的是( )A、共价晶体易升华 B、共价晶体硬度小于 C、共价晶体中C原子的杂化方式为sp D、由分子晶体转化为共价晶体是化学变化6. 干冰(固态二氧化碳)在-78℃时可直接升华为气体,其晶胞结构如图所示。下列说法错误的是( ) A、干冰晶体是共价晶体 B、每个晶胞中含有4个分子 C、每个分子周围有12个紧邻的分子 D、干冰升华时需克服分子间作用力7. 干冰(固态二氧化碳)在-78℃时可直接升华为气体,其晶胞结构如下图所示。下列说法错误的是( )
A、干冰晶体是共价晶体 B、每个晶胞中含有4个分子 C、每个分子周围有12个紧邻的分子 D、干冰升华时需克服分子间作用力7. 干冰(固态二氧化碳)在-78℃时可直接升华为气体,其晶胞结构如下图所示。下列说法错误的是( ) A、二氧化碳晶体是共价晶体 B、每个晶胞中含有4个分子 C、分子的空间结构为直线形 D、干冰升华时需克服分子间作用力8. 下列说法错误的是( )A、冰刚好融化成水时,破坏的是范德华力和氢键,空隙减小 B、碳化硅、石英和足球烯均为空间网状结构的共价晶体 C、干冰晶体中一个二氧化碳分子周围有12个紧邻分子 D、金刚石晶体中碳原子数与碳碳单键之比为1∶29. 下列物质属于分子晶体的是( )
A、二氧化碳晶体是共价晶体 B、每个晶胞中含有4个分子 C、分子的空间结构为直线形 D、干冰升华时需克服分子间作用力8. 下列说法错误的是( )A、冰刚好融化成水时,破坏的是范德华力和氢键,空隙减小 B、碳化硅、石英和足球烯均为空间网状结构的共价晶体 C、干冰晶体中一个二氧化碳分子周围有12个紧邻分子 D、金刚石晶体中碳原子数与碳碳单键之比为1∶29. 下列物质属于分子晶体的是( )①冰 ②二氧化硅 ③碘 ④铜 ⑤固态的氩
A、仅①③ B、仅②③⑤ C、仅③⑤ D、仅①③⑤10. 我国科学家合成了富集11B的非碳导热材料立方氮化硼晶体,晶胞结构如图。下列说法错误的是( ) A、氮化硼晶体有较高的熔、沸点 B、该晶体具有良好的导电性 C、该晶胞中含有4个B原子,4个N原子 D、N原子周围等距且最近的N原子数为1211. 金刚石具有硬度大、熔点高等特点,大量用于制造钻头金属切割刀具等。其结构如图所示,下列判断正确的是( )
A、氮化硼晶体有较高的熔、沸点 B、该晶体具有良好的导电性 C、该晶胞中含有4个B原子,4个N原子 D、N原子周围等距且最近的N原子数为1211. 金刚石具有硬度大、熔点高等特点,大量用于制造钻头金属切割刀具等。其结构如图所示,下列判断正确的是( ) A、金刚石中C-C键的键角均为109°28',所以金刚石和CH4的晶体类型相同 B、金刚石的熔点高与C-C键的键能无关 C、金刚石中碳原子个数与C-C键键数之比为1:2 D、金刚石的熔点高,所以在打孔过程中不需要进行浇水冷却12. 已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均已单键结合,下列关于晶体说法正确的是( )A、C3N4晶体是分子晶体 B、C3N4晶体中,C-N键的键长比金刚石中C-C键的键长要长 C、C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子 D、C3N4晶体中微粒间通过离子键结合13. 下列说法正确的是( )A、干冰和石英晶体中的化学键类型相同,熔化时需克服的微粒间作用力类型也相同 B、同一原子中2p、3p、4p能级的轨道数依次增多 C、CO2和CS2每个原子的最外层都具有8电子稳定结构 D、某晶体固态时不导电,水溶液能导电,该晶体不可能是分子晶体14. 石墨晶体的层状结构如图所示。下列说法正确的是( )
A、金刚石中C-C键的键角均为109°28',所以金刚石和CH4的晶体类型相同 B、金刚石的熔点高与C-C键的键能无关 C、金刚石中碳原子个数与C-C键键数之比为1:2 D、金刚石的熔点高,所以在打孔过程中不需要进行浇水冷却12. 已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均已单键结合,下列关于晶体说法正确的是( )A、C3N4晶体是分子晶体 B、C3N4晶体中,C-N键的键长比金刚石中C-C键的键长要长 C、C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子 D、C3N4晶体中微粒间通过离子键结合13. 下列说法正确的是( )A、干冰和石英晶体中的化学键类型相同,熔化时需克服的微粒间作用力类型也相同 B、同一原子中2p、3p、4p能级的轨道数依次增多 C、CO2和CS2每个原子的最外层都具有8电子稳定结构 D、某晶体固态时不导电,水溶液能导电,该晶体不可能是分子晶体14. 石墨晶体的层状结构如图所示。下列说法正确的是( ) A、石墨晶体只有分子晶体和原子晶体的特征 B、石墨中碳原子数和C-C个数之比为1:2 C、每个六元环完全占有的碳原子数是3 D、石墨中的C原子均为杂化15. 冰晶胞中水分子的空间排列方式与金刚石晶胞类似。下列有关冰晶胞说法正确的是( )
A、石墨晶体只有分子晶体和原子晶体的特征 B、石墨中碳原子数和C-C个数之比为1:2 C、每个六元环完全占有的碳原子数是3 D、石墨中的C原子均为杂化15. 冰晶胞中水分子的空间排列方式与金刚石晶胞类似。下列有关冰晶胞说法正确的是( ) A、冰分子间的氢键具有方向性和饱和性,是σ键 B、每个冰晶胞平均含有4个水分子 C、实验测得冰中氢键的作用力为18.5 kJ/mol,而冰的熔化热为5.0 kJ/mol,这说明冰熔化成水,氢键部分被破坏 D、晶体冰与金刚石晶体硬度都很大,且都是原子晶体16. 下列说法正确的是( )A、CaCl2晶体中存在共价键 B、H2SO4溶于水能电离出H+和SO42- , 所以硫酸是离子化合物 C、SiO2属于原子晶体,熔化破坏共价键和分子间作用力 D、I2是分子晶体,加热升华过程中只需克服分子间作用力17. 氮化硅(Si3N4)是一种新型的耐高温耐磨材料,氮化硅属于( )A、离子晶体 B、分子晶体 C、金属晶体 D、原子晶体18. 2021年5月15日,我国探测车“祝融号”成功登陆火星。其核心元器件封装用的是超轻的铝硅合金,下列说法错误的是( )A、Si的电负性大于Al B、和都属于分子晶体 C、Al和Si都位于元素周期表的同一个周期,金属和非金属交界处 D、由于硅原子最外层4个电子,相对稳定,在自然界中有单质硅存在19. 下列叙述正确的是( )A、液晶是由分子较大、分子形状呈长形或碟形的物质形成的晶体 B、制造光导纤维的主要材料是高纯度硅,属于共价晶体 C、共价晶体中,共价键的键能越大,熔、沸点越高 D、硫化氢晶体和冰晶体升华时克服的作用力相同20. 科学家成功地制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为空间网状的无限伸展结构。下列对该晶体叙述正确的是( )A、该晶体物理性质与干冰相似 B、该物质的化学式为 C、晶体中C原子数与C-O化学键数之比为1:2 D、晶体的空间最小环由12个原子构成21. 自从第一次合成稀有气体元素的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。图甲为XeF4的结构示意图,图乙为XeF2晶体的晶胞结构图。下列有关说法错误的是( )
A、冰分子间的氢键具有方向性和饱和性,是σ键 B、每个冰晶胞平均含有4个水分子 C、实验测得冰中氢键的作用力为18.5 kJ/mol,而冰的熔化热为5.0 kJ/mol,这说明冰熔化成水,氢键部分被破坏 D、晶体冰与金刚石晶体硬度都很大,且都是原子晶体16. 下列说法正确的是( )A、CaCl2晶体中存在共价键 B、H2SO4溶于水能电离出H+和SO42- , 所以硫酸是离子化合物 C、SiO2属于原子晶体,熔化破坏共价键和分子间作用力 D、I2是分子晶体,加热升华过程中只需克服分子间作用力17. 氮化硅(Si3N4)是一种新型的耐高温耐磨材料,氮化硅属于( )A、离子晶体 B、分子晶体 C、金属晶体 D、原子晶体18. 2021年5月15日,我国探测车“祝融号”成功登陆火星。其核心元器件封装用的是超轻的铝硅合金,下列说法错误的是( )A、Si的电负性大于Al B、和都属于分子晶体 C、Al和Si都位于元素周期表的同一个周期,金属和非金属交界处 D、由于硅原子最外层4个电子,相对稳定,在自然界中有单质硅存在19. 下列叙述正确的是( )A、液晶是由分子较大、分子形状呈长形或碟形的物质形成的晶体 B、制造光导纤维的主要材料是高纯度硅,属于共价晶体 C、共价晶体中,共价键的键能越大,熔、沸点越高 D、硫化氢晶体和冰晶体升华时克服的作用力相同20. 科学家成功地制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为空间网状的无限伸展结构。下列对该晶体叙述正确的是( )A、该晶体物理性质与干冰相似 B、该物质的化学式为 C、晶体中C原子数与C-O化学键数之比为1:2 D、晶体的空间最小环由12个原子构成21. 自从第一次合成稀有气体元素的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。图甲为XeF4的结构示意图,图乙为XeF2晶体的晶胞结构图。下列有关说法错误的是( ) A、XeF4是由极性键构成的非极性分子 B、XeF2晶体属于分子晶体 C、一个XeF2晶胞中实际拥有4个XeF2 D、XeF2晶体中距离最近的两个XeF2之间的距离为 (a为晶胞边长)22. 氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时所克服粒子间作用力与氮化硼熔化时克服粒子间作用力的类型都相同的是( )A、硝酸钠和金刚石 B、晶体硅和水晶 C、冰和干冰 D、苯和萘
A、XeF4是由极性键构成的非极性分子 B、XeF2晶体属于分子晶体 C、一个XeF2晶胞中实际拥有4个XeF2 D、XeF2晶体中距离最近的两个XeF2之间的距离为 (a为晶胞边长)22. 氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时所克服粒子间作用力与氮化硼熔化时克服粒子间作用力的类型都相同的是( )A、硝酸钠和金刚石 B、晶体硅和水晶 C、冰和干冰 D、苯和萘二、多选题
-
23. SiCl4可发生水解反应,机理如下所示。下列说法错误的是( )
 A、CCl4与SiCl4均是正四面体结构,稳定性SiCl4大于CCl4 B、CCl4与SiCl4均属于分子晶体,CCl4不能按照上述机理发生水解反应 C、SiCl4与H2O的中心原子均采取sp3杂化,键角:SiCl4大于H2O D、基态Si原子核外有8种能量不同的电子
A、CCl4与SiCl4均是正四面体结构,稳定性SiCl4大于CCl4 B、CCl4与SiCl4均属于分子晶体,CCl4不能按照上述机理发生水解反应 C、SiCl4与H2O的中心原子均采取sp3杂化,键角:SiCl4大于H2O D、基态Si原子核外有8种能量不同的电子三、综合题
-
24. 我国科学家研发的全球首套“液态阳光”项目使双碳目标更近一步。该项目通过太阳能发电电解水制氢,再将加氢合成。(1)、太阳能电池板的主要材料为单晶硅。
①单晶硅属于晶体。
②单晶硅的熔点低于金刚石的,原因是。
(2)、在催化剂作用下,与反应得到。①分子的空间结构为。
②和分子中键数目之比为。
③比在水中的溶解度大,这是因为。
(3)、催化剂可实现高选择性加氢合成 , 其晶胞结构如图所示。
①B代表(填“”或“”),理由是。
②晶胞的棱长分别为、、 , 其晶体密度为(列算式)。已知: , 为阿伏加德罗常数的值
25. 铁是最常见的金属元素,含铁化合物具有重要的应用。回答下列问题:(1)、基态Fe原子核外未成对电子数为。(2)、Fe(CO)5为黄色粘稠状液体,熔点为-20℃,沸点为103℃,60℃在空气中可自燃,其结构和部分键长如图所示。
Fe(CO)5的晶体类型为 , 与Fe配位的原子为原子(填名称)。下列说法正确的是(填标号)。
A.中心Fe原子可能采取sp3杂化
B.配体与Fe原子所形成的配位键的键能相同
C.Fe在周期表中位于Ⅷ族,属于d区元素
D.制备Fe(CO)5应在隔绝空气的条件下进行
(3)、某种氮化铁晶体(FexNy)的晶胞如图1所示,Cu可以完全替代该晶体中a位置或者b位置上的Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示。FexNy中N的配位数为;其中更稳定的Cu替代型产物的化学式为。 26. 回答下列问题:(1)、现有六种物质:①碘晶体②晶体硅③晶体④晶体⑤晶体⑥铁,其中属于原子晶体的化合物是(填序号);③在熔化时破坏的作用力为。(2)、①②③
26. 回答下列问题:(1)、现有六种物质:①碘晶体②晶体硅③晶体④晶体⑤晶体⑥铁,其中属于原子晶体的化合物是(填序号);③在熔化时破坏的作用力为。(2)、①②③ ④金刚石,这四种物质中碳原子采取杂化的是(填序号);乳酸分子中有个手性碳。 27.(1)、金刚砂(SiC)的硬度为9.5,其晶胞结构如图甲所示,则金刚砂晶体类型为;在SiC中,每个C原子周围最近的C原子数目为;若晶胞的边长为apm,阿伏加德罗常数为6.02×1023mol-1 , 则金刚砂的密度表达式为。
④金刚石,这四种物质中碳原子采取杂化的是(填序号);乳酸分子中有个手性碳。 27.(1)、金刚砂(SiC)的硬度为9.5,其晶胞结构如图甲所示,则金刚砂晶体类型为;在SiC中,每个C原子周围最近的C原子数目为;若晶胞的边长为apm,阿伏加德罗常数为6.02×1023mol-1 , 则金刚砂的密度表达式为。 (2)、硅的某种单质的晶胞如图乙所示。GaN晶体与该硅晶体结构相似,则GaN晶体中,每个Ga原子与个N原子相连,与同一个Ga原子相连的N原子构成的空间结构为。若该硅晶体的密度为ρg·cm-3 , 阿伏加德罗常数的值为NA , 则晶体中最近的两个硅原子之间的距离为cm( 用代数式表示即可)。28. 如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
(2)、硅的某种单质的晶胞如图乙所示。GaN晶体与该硅晶体结构相似,则GaN晶体中,每个Ga原子与个N原子相连,与同一个Ga原子相连的N原子构成的空间结构为。若该硅晶体的密度为ρg·cm-3 , 阿伏加德罗常数的值为NA , 则晶体中最近的两个硅原子之间的距离为cm( 用代数式表示即可)。28. 如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题: (1)、根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的区。(2)、②、⑥两元素形成的化合物的空间构型为 , 其中心原子的杂化轨道类型为。(3)、写出元素③与元素⑤形成的稳定化合物的结构式(4)、⑧的二价阳离子与过量的④的氢化物的水化物作用生成的配离子化学式为:(5)、元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于晶体(填晶体类型)。(6)、元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为。(7)、金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的原子个数之比为。
(1)、根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的区。(2)、②、⑥两元素形成的化合物的空间构型为 , 其中心原子的杂化轨道类型为。(3)、写出元素③与元素⑤形成的稳定化合物的结构式(4)、⑧的二价阳离子与过量的④的氢化物的水化物作用生成的配离子化学式为:(5)、元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于晶体(填晶体类型)。(6)、元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为。(7)、金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的原子个数之比为。
四、推断题
-
29. 已知X、Y、Z、M、N是原子序数依次增大的前四周期元素,其中Y是地壳中含量第二的元素,X、Y、Z是核外未成对电子数均为2的非金属元素,ZX3的空间结构为平面三角形,M的价层电子数为6,N与Z同族。请回答下列问题:(1)、X为(填元素名称,下同),Y为 , Z为。(2)、M在元素周期表的位置是 , 基态N原子的价层电子排布式为。(3)、X、Y、Z的第一电离能由大到小的顺序为(填元素符号)。(4)、Z与N的最简单氢化物的稳定性比较: (写化学式),原因为。(5)、YX2的晶体类型为 , 其熔点(填“高于”或“低于”)NX2。30. 第IVA族元素及其化合物是结构化学研究的热点。几种晶体结构如图所示:
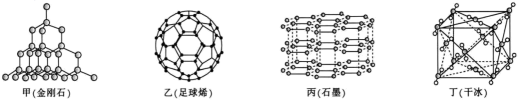 (1)、基态锗(G)的价电子排布图为。(2)、上述四种晶体中,石墨中碳原子之间具有的作用有。(3)、在碳族元素中,最简单气态氢化物中最稳定的是(填分子式)。(4)、在碳的氢化物中,既含σ键,又含π键的分子有许多,其中含σ键与π键数目之比为5:1的分子的结构简式为(写一种)。(5)、硅晶体结构类似于金刚石(如图甲),则14g硅晶体中含mol共价键。1mol石墨如图丙晶体中含mol共价键。(6)、设NA为阿伏加德罗常数的值,已知干冰(如图丁)的晶胞边长为apm,则干冰的密度为g•cm-3(用含a和NA的代数式表示)。
(1)、基态锗(G)的价电子排布图为。(2)、上述四种晶体中,石墨中碳原子之间具有的作用有。(3)、在碳族元素中,最简单气态氢化物中最稳定的是(填分子式)。(4)、在碳的氢化物中,既含σ键,又含π键的分子有许多,其中含σ键与π键数目之比为5:1的分子的结构简式为(写一种)。(5)、硅晶体结构类似于金刚石(如图甲),则14g硅晶体中含mol共价键。1mol石墨如图丙晶体中含mol共价键。(6)、设NA为阿伏加德罗常数的值,已知干冰(如图丁)的晶胞边长为apm,则干冰的密度为g•cm-3(用含a和NA的代数式表示)。
-