高中化学(人教2019)选择性必修二期末知识点复习4 分子的空间结构
试卷更新日期:2023-05-10 类型:复习试卷
一、单选题
-
1. 少量与反应生成和。下列说法正确的是A、中只含离子键 B、的电子式为
 C、中为杂化
D、固体溶于水属于放热反应
2. 从科技前沿到日常生活,化学无处不在。下列说法错误的是A、我国首次在实验室实现了二氧化碳到淀粉的合成,生物酶催化剂的使用改变了反应历程 B、神舟十三号顺利升空时,火箭尾部喷射的气体呈红棕色是因为部分助燃剂转化为 C、水是21世纪最宝贵的资源之一,明矾与高铁酸钾均可作水处理剂,两者处理水的原理相同 D、2022年北京冬奥会将采用石墨烯材料制造户外保暖穿戴设备,石墨烯中碳原子为杂化3. 下列分子中,具有正四面体结构的是( )A、 B、 C、 D、
C、中为杂化
D、固体溶于水属于放热反应
2. 从科技前沿到日常生活,化学无处不在。下列说法错误的是A、我国首次在实验室实现了二氧化碳到淀粉的合成,生物酶催化剂的使用改变了反应历程 B、神舟十三号顺利升空时,火箭尾部喷射的气体呈红棕色是因为部分助燃剂转化为 C、水是21世纪最宝贵的资源之一,明矾与高铁酸钾均可作水处理剂,两者处理水的原理相同 D、2022年北京冬奥会将采用石墨烯材料制造户外保暖穿戴设备,石墨烯中碳原子为杂化3. 下列分子中,具有正四面体结构的是( )A、 B、 C、 D、 4. 已知有关氮、磷的单键和三键的键能数据(单位:kJ·mol)如下表:
4. 已知有关氮、磷的单键和三键的键能数据(单位:kJ·mol)如下表:193
946
197
489
下列说法错误的是
A、1 mol 中含P-P键的数目为 B、中的P原子采取杂化 C、P原子半径较大不易形成π键 D、比( )能量更低所以氮元素通常以形式存在
5. 下列关于丙烯(CH3CH=CH2)分子的说法中,错误的是A、有8个σ键,1个π键 B、丙烯分子中的碳原子有sp3和sp2两种杂化类型 C、所有原子都在同一平面上 D、丙烯的键线式为
)能量更低所以氮元素通常以形式存在
5. 下列关于丙烯(CH3CH=CH2)分子的说法中,错误的是A、有8个σ键,1个π键 B、丙烯分子中的碳原子有sp3和sp2两种杂化类型 C、所有原子都在同一平面上 D、丙烯的键线式为 6. 三硝酸六尿素合铁[Fe(H2NCONH2)6](NO3)3]是常见的有机铁肥,一定条件下可由Fe(NO3)3和尿素(H2NCONH2)合成。下列说法正确的是A、NO的空间构型为V形 B、第一电离能:O>N>C>Fe C、尿素分子中碳为手性碳原子 D、尿素水溶液中存在尿素分子与水分子形成的氢键7. 下列分子或离子的VSEPR模型与空间结构一致的是A、 B、 C、 D、8. 某有机物M的结构简式如图,其中1、2、3号原子的杂化方式分别为
6. 三硝酸六尿素合铁[Fe(H2NCONH2)6](NO3)3]是常见的有机铁肥,一定条件下可由Fe(NO3)3和尿素(H2NCONH2)合成。下列说法正确的是A、NO的空间构型为V形 B、第一电离能:O>N>C>Fe C、尿素分子中碳为手性碳原子 D、尿素水溶液中存在尿素分子与水分子形成的氢键7. 下列分子或离子的VSEPR模型与空间结构一致的是A、 B、 C、 D、8. 某有机物M的结构简式如图,其中1、2、3号原子的杂化方式分别为 A、sp3、sp3、sp3 B、sp3、sp3、sp2 C、sp2、sp3、sp2 D、sp3、sp2、sp29. 我国科学家最近成功合成了世界上首个五氮阴离子盐(用R代表)。经X射线衍射测得化合物R的晶体结构,其局都结构如下图所示,从结构角度分析R中两种阳离子的不同之处是
A、sp3、sp3、sp3 B、sp3、sp3、sp2 C、sp2、sp3、sp2 D、sp3、sp2、sp29. 我国科学家最近成功合成了世界上首个五氮阴离子盐(用R代表)。经X射线衍射测得化合物R的晶体结构,其局都结构如下图所示,从结构角度分析R中两种阳离子的不同之处是 A、中心原子的杂化轨道类型 B、中心原子的价层电子对数 C、空间结构 D、共价键类型10. 一种杂环有机物M的结构如图所示,下列说法正确的是
A、中心原子的杂化轨道类型 B、中心原子的价层电子对数 C、空间结构 D、共价键类型10. 一种杂环有机物M的结构如图所示,下列说法正确的是 A、第一电离能: B、电负性: C、C原子的杂化方式有三种 D、π键与σ键个数比为4:2311. 下列说法正确的是A、某分子由X和Y原子构成,个数比为1:2,则X原子一定为sp2杂化 B、元素Ga的核外电子排布式为[Ar]4s24p1 , 位于元素周期表中p区 C、NH3中N-H间的键角比CH4中C-H间的键角大 D、基态Cr原子有6个未成对电子12. 下列化合物在核磁共振氢谱中出现两组峰且峰面积之比为3:2的是A、2,3-二甲基丁烷 B、对二甲苯 C、2-甲基丙烯 D、乙酸甲酯13. 一种有机合成中间体和活性封端剂的分子结构式如下图所示。W、X、Y、Z是原子序数依次增大的短周期主族非金属元素,X、Y同主族,Z的基态原子核外只有一个未成对电子。下列说法正确的是
A、第一电离能: B、电负性: C、C原子的杂化方式有三种 D、π键与σ键个数比为4:2311. 下列说法正确的是A、某分子由X和Y原子构成,个数比为1:2,则X原子一定为sp2杂化 B、元素Ga的核外电子排布式为[Ar]4s24p1 , 位于元素周期表中p区 C、NH3中N-H间的键角比CH4中C-H间的键角大 D、基态Cr原子有6个未成对电子12. 下列化合物在核磁共振氢谱中出现两组峰且峰面积之比为3:2的是A、2,3-二甲基丁烷 B、对二甲苯 C、2-甲基丙烯 D、乙酸甲酯13. 一种有机合成中间体和活性封端剂的分子结构式如下图所示。W、X、Y、Z是原子序数依次增大的短周期主族非金属元素,X、Y同主族,Z的基态原子核外只有一个未成对电子。下列说法正确的是 A、基态X原子的电子轨道表示式为:
A、基态X原子的电子轨道表示式为: B、分子空间结构为正四面体形
C、电负性:Y<X<Z
D、四种元素原子半径的大小顺序为W<X<Y<Z
14. 很多含巯基()的有机化合物是重金属元素汞的解毒剂。解毒剂化合物I可与氧化汞生成化合物Ⅱ,化合物Ⅲ也是一种汞解毒剂,化合物Ⅳ是一种强酸。下列说法正确的是
B、分子空间结构为正四面体形
C、电负性:Y<X<Z
D、四种元素原子半径的大小顺序为W<X<Y<Z
14. 很多含巯基()的有机化合物是重金属元素汞的解毒剂。解毒剂化合物I可与氧化汞生成化合物Ⅱ,化合物Ⅲ也是一种汞解毒剂,化合物Ⅳ是一种强酸。下列说法正确的是 A、在Ⅰ中S原子采取杂化 B、在Ⅱ中键角是180° C、在Ⅲ中存在离子键和共价键 D、在Ⅳ中硫氧键的键能均相等15. 化学与生产生活、能源、航空航天、医疗健康等诸多领域的需求密切相关。下列说法错误的是A、北京冬奥会吉祥物“冰墩墩”的制作原料之一聚氯乙烯可通过加聚反应制得 B、汕头海湾隧道风塔亮灯,美轮美奂的LED灯光与原子核外电子跃迁释放能量有关 C、“神舟十三号”飞船返回舱外壳的烧蚀材料之一酚醛树脂是酚与醛在碱的催化下相互缩合而成的具有网状结构的高分子 D、核酸是生物体遗传信息的载体,通过红外光谱仪可检测其结构中存在的多种单键、双键、氢键等化学键16. 下列有关杂化轨道的说法错误的是( )A、四面体形、三角锥形、V形分子的结构可以用杂化轨道解释 B、、、sp杂化轨道的夹角分别为109°28'、120°、180° C、杂化轨道全部参加形成化学键 D、杂化前后的轨道数不变,但轨道的形状发生了改变17. 下列变化规律正确的是( )A、微粒半径: B、碳碳键键长:碳碳单键<碳碳双键<碳碳三键 C、硬度:金刚石<碳化硅<硅 D、键角:18. 是常见的补铁剂。下列说法正确的是( )A、中子数为10的氧原子: B、其中碳原子的杂化类型:和 C、的名称:胺基 D、基态的价电子的排布图:
A、在Ⅰ中S原子采取杂化 B、在Ⅱ中键角是180° C、在Ⅲ中存在离子键和共价键 D、在Ⅳ中硫氧键的键能均相等15. 化学与生产生活、能源、航空航天、医疗健康等诸多领域的需求密切相关。下列说法错误的是A、北京冬奥会吉祥物“冰墩墩”的制作原料之一聚氯乙烯可通过加聚反应制得 B、汕头海湾隧道风塔亮灯,美轮美奂的LED灯光与原子核外电子跃迁释放能量有关 C、“神舟十三号”飞船返回舱外壳的烧蚀材料之一酚醛树脂是酚与醛在碱的催化下相互缩合而成的具有网状结构的高分子 D、核酸是生物体遗传信息的载体,通过红外光谱仪可检测其结构中存在的多种单键、双键、氢键等化学键16. 下列有关杂化轨道的说法错误的是( )A、四面体形、三角锥形、V形分子的结构可以用杂化轨道解释 B、、、sp杂化轨道的夹角分别为109°28'、120°、180° C、杂化轨道全部参加形成化学键 D、杂化前后的轨道数不变,但轨道的形状发生了改变17. 下列变化规律正确的是( )A、微粒半径: B、碳碳键键长:碳碳单键<碳碳双键<碳碳三键 C、硬度:金刚石<碳化硅<硅 D、键角:18. 是常见的补铁剂。下列说法正确的是( )A、中子数为10的氧原子: B、其中碳原子的杂化类型:和 C、的名称:胺基 D、基态的价电子的排布图: 19. 确定有机化合物组成和结构的方法很多,下列说法错误的是( )A、异戊烷的核磁共振氢谱中有3组峰: B、质谱仪可用于有机物相对分子质量的测定 C、利用红外光谱法可以区分乙烷和乙烯 D、通过李比希元素分析仪可以确定有机物最简式20. 根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是( )
19. 确定有机化合物组成和结构的方法很多,下列说法错误的是( )A、异戊烷的核磁共振氢谱中有3组峰: B、质谱仪可用于有机物相对分子质量的测定 C、利用红外光谱法可以区分乙烷和乙烯 D、通过李比希元素分析仪可以确定有机物最简式20. 根据杂化轨道理论和价层电子对互斥模型,判断下列分子或者离子的空间构型正确的是( )选项
分子式
中心原子杂化方式
VSEPR模型名称
空间结构
A
sp
V形
V形
B
sp2
平面三角形
三角锥形
C
sp2
四面体形
平面三角形
D
sp3
正四面体形
正四面体形
A、A B、B C、C D、D21. 下列说法正确的是( )A、和都是正四面体型分子且键角都为 B、中心原子为杂化,呈平面三角形 C、向溶液中加入稀硫酸,溶液变浑浊 D、、分子中所有原子的最外层电子都满足了8电子稳定结构22. 工业合成尿素的原理: , 下列说法正确的是( )A、中键比键数目多 B、的分子构型为正四面体形 C、中的所有原子处在同一平面 D、基态氧原子的核外电子轨道表示式: 23. 邻二氮菲(phen)与Fe2+生成稳定的橙红色离子[Fe(phen)3]2+ , 可用于Fe2+浓度的测定,邻二氮菲的结构简式如图所示。下列说法错误的是( )
23. 邻二氮菲(phen)与Fe2+生成稳定的橙红色离子[Fe(phen)3]2+ , 可用于Fe2+浓度的测定,邻二氮菲的结构简式如图所示。下列说法错误的是( ) A、邻二氮菲分子中碳原子和氮原子杂化方式相同 B、[Fe(phen)3]2+中Fe2+的配位数为6 C、邻二氮菲中所有原子共平面 D、用邻二氮菲测定Fe2+的浓度时,为防止OH-与Fe2+反应,酸性越强越准确
A、邻二氮菲分子中碳原子和氮原子杂化方式相同 B、[Fe(phen)3]2+中Fe2+的配位数为6 C、邻二氮菲中所有原子共平面 D、用邻二氮菲测定Fe2+的浓度时,为防止OH-与Fe2+反应,酸性越强越准确二、填空题
-
24. 氯吡苯脲(结构简式如图所示)是一种膨大剂,具有加速细胞分裂,促进细胞增大、分化,促进果实增大的作用,属于植物生长调节剂中的一类。
 (1)、氯元素基态原子核外有种不同运动状态的电子,核外电子占据的最高能层符号为。(2)、膨大剂能在动物体内代谢,其产物较为复杂,其中有、、等。
(1)、氯元素基态原子核外有种不同运动状态的电子,核外电子占据的最高能层符号为。(2)、膨大剂能在动物体内代谢,其产物较为复杂,其中有、、等。①请用共价键知识解释分子比分子稳定的原因。
②分子的空间结构是。
(3)、查文献可知,可用2-氯-4-氨基吡啶与苯酯反应,生成氯吡苯脲,其反应方程式如图所示:
①反应过程中,每生成1 mol氯吡苯脲,断裂σ键和π键个数之比为。
②异氰酸苯酯分子中碳原子的杂化方式为;氮元素的第一电离能大于氧元素的原因是。
(4)、人体必需的抗坏血酸分子结构如图所示,推测抗坏血酸在水中的溶解性:(填“难溶”或“易溶”)于水;抗坏血酸分子中有个手性碳原子。
三、综合题
-
25. 磷酸亚铁锂(LiFePO4)和锰酸锂(LiMn2O4)均可用作锂离子电池正极材料。回答下列问题:(1)、在周期表中,与Li化学性质最相似的邻族元素是 , 基态O原子的价电子轨道表示式为。基态P原子电子占据最高能级的电子云轮廓图为形。(2)、原子核外电子有两种相反的自旋状态,分别用+和-表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为。(3)、PO的空间结构为形, 其中心原子的杂化轨道类型为。(4)、PH3和NH3相比,更易液化,原因是。(5)、Fe元素位于周期表的区。已知:I3(Mn)=3248 kJ·mol-1 , I3(Fe)= 2957kJ·mol-1。Mn的第三电离能大于Fe的第三电离能,其主要原因是。26. 按要求填空。(1)、测定有机物M(
 )的相时分子质量的光谱为(填代号)。
)的相时分子质量的光谱为(填代号)。A..红外光谱 B.质谱 C.核磁共振氢谱
M的分子式为;写出M在一定条件下与氧气发生催化氧化的反应方程式:。
(2)、两分子 与浓硫酸共热发生脱水反应生成六元环状酯C6H8O4 , 该反应的化学方程式为。 (3)、合成高分子的基本方法包括加聚反应和缩聚反应。写出有机物
与浓硫酸共热发生脱水反应生成六元环状酯C6H8O4 , 该反应的化学方程式为。 (3)、合成高分子的基本方法包括加聚反应和缩聚反应。写出有机物 在一定条件下发生加聚反应的化学方程式。 (4)、已知共轭双烯与含有双键的化合物相互作用,能生成六元环状化合物,例如
在一定条件下发生加聚反应的化学方程式。 (4)、已知共轭双烯与含有双键的化合物相互作用,能生成六元环状化合物,例如 +
+  →
→ 。在一定条件下,化合物
。在一定条件下,化合物 和化合物
和化合物 能发生类似上述的反应,生成两种化合物(互为同分异构体),写出任意一种产物的结构简式。 27. 铜元素有很好的配位性能,能与绝大多数配体形成配合物,铜配合物在催化、光电材料等方面的应用成为研究重点。(1)、基态Cu原子的核外电子排布式为 , Cu在元素周期表中属于区。(2)、将CuCl粉末溶于浓氨水可以得到无色的[Cu(NH3)2]Cl溶液,无色的[Cu(NH3)2]+不稳定,遇氧气易被氧化成深蓝色的[Cu(NH3)4]2+。
能发生类似上述的反应,生成两种化合物(互为同分异构体),写出任意一种产物的结构简式。 27. 铜元素有很好的配位性能,能与绝大多数配体形成配合物,铜配合物在催化、光电材料等方面的应用成为研究重点。(1)、基态Cu原子的核外电子排布式为 , Cu在元素周期表中属于区。(2)、将CuCl粉末溶于浓氨水可以得到无色的[Cu(NH3)2]Cl溶液,无色的[Cu(NH3)2]+不稳定,遇氧气易被氧化成深蓝色的[Cu(NH3)4]2+。①Cu2+与NH3之间形成的化学键称为 , 提供孤电子对的成键原子是。
②上述两种配合物的配体都是(填化学式),该配体的空间结构为。
③利用[Cu(NH3)2]+易被氧化的性质可检验氨气中的痕量O2 , 反应的离子方程式为。
(3)、螯合物是具有环状结构的配合物,铜的一种整合物结构如图,该配合物中Cu2+的配位数为 , 其中C、N、О按电负性由小到大的顺序排列为。该配合物中碳原子的杂化方式有。 28. 臭氧()在催化下可以将烟气中的、分别氧化为和 , 也可以在其他条件下被还原为。回答下列问题:(1)、中心原子轨道的杂化类型为 , 的晶体类型为晶体。(2)、基态核外电子排布式为。(3)、N、H、O三种元素的电负性由小到大的顺序为。(4)、的沸点高于 , 这是因为。(5)、分子中键与键的数目之比为。
28. 臭氧()在催化下可以将烟气中的、分别氧化为和 , 也可以在其他条件下被还原为。回答下列问题:(1)、中心原子轨道的杂化类型为 , 的晶体类型为晶体。(2)、基态核外电子排布式为。(3)、N、H、O三种元素的电负性由小到大的顺序为。(4)、的沸点高于 , 这是因为。(5)、分子中键与键的数目之比为。四、推断题
-
29. 有机物M(只含C、H、O三种元素中的两种或三种)具有牛奶香气,主要用于配制奶油乳品等香精,是我国批准使用的香料产品。某化学兴趣小组借助李比希法、现代科学仪器测定有机物M的分子组成和结构,具体实验过程如下:(1)、步骤一:确定M的实验式和分子式。
利用元素分析仪测得有机物M中碳的质量分数为54.5%,氢的质量分数为9.1%。
①M的实验式为。
②已知M的密度是同温、同压下二氧化碳密度的2倍,则M的分子式为。
(2)、步骤二:确定M的结构简式。用核磁共振仪测出M的核磁共振氢谱如图1所示;利用红外光谱仪测得M的红外光谱如图2所示:
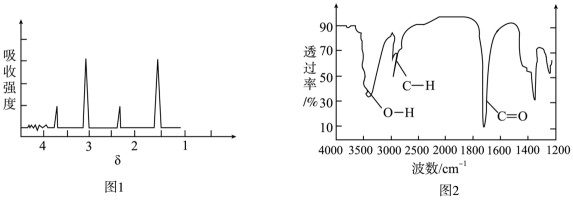
M中官能团的名称为 , M的结构简式为(填键线式)。
(3)、写出两种含有酯基的M的同分异构体的结构简式。
-