高中化学(人教2019)选择性必修二期末知识点复习1 原子结构
试卷更新日期:2023-05-10 类型:期末考试
一、单选题
-
1. 下列能级符号中,错误的是A、3f B、2s C、3d D、2p2. 下列说法正确的是A、钠原子由时,原子释放能量,由基态转化成激发态 B、1s电子云呈球形,表示电子绕原子核做圆周运动 C、在第三能层中自旋状态相同的电子最多有4个 D、同一原子中,2p、3d、4f能级的轨道数依次增多3. 在周期表前四周期元素中,基态原子最外层电子排布式为的元素有A、3种 B、4种 C、5种 D、6种4. 下列说法中,正确的是A、活化分子间的碰撞一定是有效碰撞 B、同一原子1s、2s的电子云半径相同 C、原子核外电子发生跃迁属于化学变化 D、同一原子中没有运动状态完全相同的电子5. 下列不包含d能级的能层是A、L B、M C、N D、O6. 下列说法或化学用语错误的是A、s轨道形状为球形,无取向;p轨道形状为哑铃形,有取向 B、p能级电子能量不一定高于s能级电子能量 C、电子从2s跃迁到3s时,将吸收能量 D、基态氧原子的轨道表示式:
 7. 下列说法错误的是( )A、同一原子中,1s、2s、3s电子的能量逐渐增大 B、在电子云图中,用小黑点表示绕核做高速圆周运动的电子 C、、、轨道相互垂直,且能量相等 D、通过原子光谱上的特征谱线能鉴定某些元素8. 下列关于丙烯(CH3CH=CH2)分子的说法中,错误的是A、有8个σ键,1个π键 B、丙烯分子中的碳原子有sp3和sp2两种杂化类型 C、所有原子都在同一平面上 D、丙烯的键线式为
7. 下列说法错误的是( )A、同一原子中,1s、2s、3s电子的能量逐渐增大 B、在电子云图中,用小黑点表示绕核做高速圆周运动的电子 C、、、轨道相互垂直,且能量相等 D、通过原子光谱上的特征谱线能鉴定某些元素8. 下列关于丙烯(CH3CH=CH2)分子的说法中,错误的是A、有8个σ键,1个π键 B、丙烯分子中的碳原子有sp3和sp2两种杂化类型 C、所有原子都在同一平面上 D、丙烯的键线式为 9. 第四周期元素的基态原子核外电子排布中,未成对电子最多可以有A、3个 B、4个 C、5个 D、6个10. 中华文化博大精深,蕴含着许多化学知识。下列说法错误的是A、“蜡(主要成分为石蜡)炬成灰泪始干”,“泪”是蜡烛燃烧的产物 B、“强烧之,紫青烟起……云是真硝石也”,此现象涉及电子的跃迁 C、“春蚕到死丝方尽”中,“丝”的主要成分为蛋白质 D、“葡萄美酒夜光杯”中的“美酒”的酿制包含了淀粉的水解过程11. 人们的幸福是靠辛勒劳动创造出来的。下列化学知识解读错误的是
9. 第四周期元素的基态原子核外电子排布中,未成对电子最多可以有A、3个 B、4个 C、5个 D、6个10. 中华文化博大精深,蕴含着许多化学知识。下列说法错误的是A、“蜡(主要成分为石蜡)炬成灰泪始干”,“泪”是蜡烛燃烧的产物 B、“强烧之,紫青烟起……云是真硝石也”,此现象涉及电子的跃迁 C、“春蚕到死丝方尽”中,“丝”的主要成分为蛋白质 D、“葡萄美酒夜光杯”中的“美酒”的酿制包含了淀粉的水解过程11. 人们的幸福是靠辛勒劳动创造出来的。下列化学知识解读错误的是选项
劳动项目
化学知识解读
A
用食醋除去水壶中的水垢
水垢的主要成分——CaCO3是离子晶体
B
用铁锅炒菜
Fe的价层电子排布式为3d54s2
C
用热的碳酸钠溶液清洗油污
油污在碱性条件下水解可以生成丙三醇
D
用乙醇对公共场所杀菌消毒
利用了乙醇的强氧化性
A、A B、B C、C D、D12. 某有机物M的结构简式如图,其中1、2、3号原子的杂化方式分别为 A、sp3、sp3、sp3 B、sp3、sp3、sp2 C、sp2、sp3、sp2 D、sp3、sp2、sp213. 下列说法正确的是A、两个p轨道不能形成σ键,只能形成π键 B、2p、3p、4p能级的轨道数依次增多 C、2px、2py、2pz轨道相互垂直,但能量相等 D、电负性大于1.8的一定为非金属,小于1.8的一定为金属14. 下列说法中正确的是A、在多电子原子中,p道电子能量一定高于s轨道电子能量 B、2p和3p轨道形状均为哑铃形 C、基态氮原子的轨道表示式为
A、sp3、sp3、sp3 B、sp3、sp3、sp2 C、sp2、sp3、sp2 D、sp3、sp2、sp213. 下列说法正确的是A、两个p轨道不能形成σ键,只能形成π键 B、2p、3p、4p能级的轨道数依次增多 C、2px、2py、2pz轨道相互垂直,但能量相等 D、电负性大于1.8的一定为非金属,小于1.8的一定为金属14. 下列说法中正确的是A、在多电子原子中,p道电子能量一定高于s轨道电子能量 B、2p和3p轨道形状均为哑铃形 C、基态氮原子的轨道表示式为 D、B原子由1s22s22p→1s22s22p时,由基态转化为激发态,形成发射光谱
15. 下列轨道表示式能表示基态氮原子最外层结构的是A、
D、B原子由1s22s22p→1s22s22p时,由基态转化为激发态,形成发射光谱
15. 下列轨道表示式能表示基态氮原子最外层结构的是A、 B、
B、 C、
C、 D、
D、 16. 三氯化氮 (NCl3)常温下是一种淡黄色的液体,其分子结构呈三角锥形。以下关于的说法正确的是( )A、分子中的N原子为杂化 B、分子中不存在孤电子对 C、它的沸点比的沸点低 D、因的键能大,所以的沸点高17. 是常见的补铁剂。下列说法正确的是( )A、中子数为10的氧原子: B、其中碳原子的杂化类型:和 C、的名称:胺基 D、基态的价电子的排布图:
16. 三氯化氮 (NCl3)常温下是一种淡黄色的液体,其分子结构呈三角锥形。以下关于的说法正确的是( )A、分子中的N原子为杂化 B、分子中不存在孤电子对 C、它的沸点比的沸点低 D、因的键能大,所以的沸点高17. 是常见的补铁剂。下列说法正确的是( )A、中子数为10的氧原子: B、其中碳原子的杂化类型:和 C、的名称:胺基 D、基态的价电子的排布图: 18. 下列有关杂化轨道的说法错误的是( )A、四面体形、三角锥形、V形分子的结构可以用杂化轨道解释 B、、、sp杂化轨道的夹角分别为109°28'、120°、180° C、杂化轨道全部参加形成化学键 D、杂化前后的轨道数不变,但轨道的形状发生了改变19. 2017年5月中科院等部门在京正式向社会发布113号元素(符号为)的中文名称为“鉨”,关于该元素的下列说法,正确的是( )A、该元素位于元素周期表的p区 B、该元素的价电子排布式为 C、该元素的最高价氧化物对应水化物可能具有两性 D、该元素在同族元素中的金属性最弱20. 下列说法中正确的是( )A、含离子键,在熔融状态下能导电 B、轨道上的电子一定比轨道能量高 C、价电子越多的金属元素的金属性越强 D、第四周期元素的基态原子中,未成对电子数最多的是
18. 下列有关杂化轨道的说法错误的是( )A、四面体形、三角锥形、V形分子的结构可以用杂化轨道解释 B、、、sp杂化轨道的夹角分别为109°28'、120°、180° C、杂化轨道全部参加形成化学键 D、杂化前后的轨道数不变,但轨道的形状发生了改变19. 2017年5月中科院等部门在京正式向社会发布113号元素(符号为)的中文名称为“鉨”,关于该元素的下列说法,正确的是( )A、该元素位于元素周期表的p区 B、该元素的价电子排布式为 C、该元素的最高价氧化物对应水化物可能具有两性 D、该元素在同族元素中的金属性最弱20. 下列说法中正确的是( )A、含离子键,在熔融状态下能导电 B、轨道上的电子一定比轨道能量高 C、价电子越多的金属元素的金属性越强 D、第四周期元素的基态原子中,未成对电子数最多的是二、综合题
-
21. 根据原子核外电子排布规律,回答下列问题:(1)、写出基态S原子的核外电子排布式:。(2)、画出基态N原子的轨道表示式:。(3)、Fe3+比Fe2+的稳定性(填“强”或“弱”),从结构上分析原因是;基态Fe2+与Fe3+离子中未成对的电子数之比为。(4)、基态K原子中,核外电子占据最高能层的符号是 , 占据该能层电子的电子云轮廓图形状为。(5)、在周期表中,与Li的化学性质最相似的邻族元素是(填元素符号),该元素基态原子核外M层电子的自旋状态(填“相同”或“相反”)。(6)、在KHSO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是(填离子符号)。22. 完成下列化学用语。(1)、Mn原子的电子排布式:。(2)、的离子结构示意图为。(3)、Co的价电子排布图为。(4)、
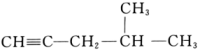 系统命名:。 (5)、4,4-二甲基-2-戊醇的结构简式为。(6)、
系统命名:。 (5)、4,4-二甲基-2-戊醇的结构简式为。(6)、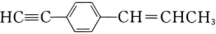 分子中最多有个原子在同一平面内。 23. 请回答下列问题:(1)、请用学过的知识解释下列现象:
分子中最多有个原子在同一平面内。 23. 请回答下列问题:(1)、请用学过的知识解释下列现象:①O3在水中的溶解度比O2在水中的溶解度大,原因是;
②在水晶柱面上滴一滴熔化的石蜡,用一根红热的铁针刺中凝固的石蜡,结果石蜡在不同方向熔化的快慢不同,原因是。
(2)、将О原子的轨道表示式补充完整 。 (3)、已知COCl2分子中所有原子均满足8电子稳定结构,则其分子中σ键和π键的个数比为 , 中心原子的杂化方式为。(4)、已知超分子18-冠-6的空腔直径为260~320 pm,则下列碱金属离子可被18-冠-6识别的是
。 (3)、已知COCl2分子中所有原子均满足8电子稳定结构,则其分子中σ键和π键的个数比为 , 中心原子的杂化方式为。(4)、已知超分子18-冠-6的空腔直径为260~320 pm,则下列碱金属离子可被18-冠-6识别的是碱金属离子
离子直径/pm
A
152
B
204
C
276
D
334
三、推断题
-
24. A、B、C、D、E是原子序数依次增大的前四周期元素。
元素
原子结构(基态)等
A
宇宙中含量最多的元素
B
原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能都低于同周期相邻元素
C
原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能都高于同周期相邻元素
D
原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对
E
前四周期元素中未成对电子数最多
(1)、写出下列元素的元素符号:A;E。(2)、B元素在周期表中的位置为 , 属于周期表的区。(3)、E元素基态原子的电子排布式:。(4)、B,C,D三种元素的电负性:>>(填元素符号)。