高中化学(人教2019)选择性必修二期末复习模拟测试卷1
试卷更新日期:2023-05-10 类型:期末考试
一、单选题
-
1. 下列轨道表示式中能正确表示基态原子的核外电子排布的是A、
 B、
B、 C、
C、 D、
D、 2. 锑的相关信息如图所示,下列说法正确的是
2. 锑的相关信息如图所示,下列说法正确的是元素符号:Sb
原子序数:51
相对原子质量:121.8
价电子排布式:5s25p3
A、Sb元素的质量数是121.8 B、Sb元素位于第五周期第VA族 C、Bi原子的5p能级上有1个未成对电子 D、Bi原子最外层有5个能量相同的电子3. 下列关于元素第一电离能的说法错误的是A、钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 B、因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大 C、最外层电子排布为ns2np6(当只有K层时为1s2)的原子,第一电离能较大 D、对于同一元素而言,原子的电离能I1<I2<I3……4. 铜氨液可以吸收CO,其反应为:。下列说法正确的是A、价层电子排布式为: B、CO为非极性分子 C、空间构型为三角锥形 D、中含有3mol配位键5. X、Y为同周期主族元素, Y有8种不同运动状态的电子,二者形成的一种化合物固态时以[XY2]+[XY3]-的形式存在。下列说法错误的是A、Y形成的单质可能是极性分子 B、[XY3] -中心原子杂化方式为sp2 C、[XY2]+空间结构为直线形 D、X、Y形成的简单氢化物稳定性: X> Y6. 物质的组成与结构决定了物质的性质与变化,结构化学是化学研究的重要领域。下列说法正确的是A、由于氢键的作用,的稳定性强于 B、已知苯酚( )具有弱酸性,其;水杨酸(
)具有弱酸性,其;水杨酸( )第一级电离形成的离子(
)第一级电离形成的离子( )能形成分子内氢键,据此判断,相同温度下电离平衡常数
C、的几何构型为型,其中心原子的杂化形式为杂化
D、在基态原子中,核外存在2对自旋相反的电子,其核外电子有4种运动状态
7. 下列说法正确的是A、同一原子中,电子的能量总是低于p电子的能量 B、原子核外电子排布,先排满K层再排L层,排满M层再排N层,满足能量最低原理 C、任何轨道形状均是球形,只是能层不同,球的半径大小不同而已 D、各能层的原子轨道数为(n为能层序数)8. 少量与反应生成和。下列说法正确的是A、中只含离子键 B、的电子式为
)能形成分子内氢键,据此判断,相同温度下电离平衡常数
C、的几何构型为型,其中心原子的杂化形式为杂化
D、在基态原子中,核外存在2对自旋相反的电子,其核外电子有4种运动状态
7. 下列说法正确的是A、同一原子中,电子的能量总是低于p电子的能量 B、原子核外电子排布,先排满K层再排L层,排满M层再排N层,满足能量最低原理 C、任何轨道形状均是球形,只是能层不同,球的半径大小不同而已 D、各能层的原子轨道数为(n为能层序数)8. 少量与反应生成和。下列说法正确的是A、中只含离子键 B、的电子式为 C、中为杂化
D、固体溶于水属于放热反应
9. 以和为原料制备高纯度次氯酸的机理如图,V为元素钒,其最高化合价为价,、分别为两种不同氨基酸,下列说法错误的是
C、中为杂化
D、固体溶于水属于放热反应
9. 以和为原料制备高纯度次氯酸的机理如图,V为元素钒,其最高化合价为价,、分别为两种不同氨基酸,下列说法错误的是 A、该催化循环过程中有氢氧键的断裂和形成 B、反应过程中,中心原子钒的化合价和成键数目均发生改变 C、该机理中化合物a是催化剂,B、C、D、E是中间产物 D、该过程的总反应为:10. 1,3-丁二烯与按进行的某种反应可以分成两步完成,下图是该反应过程中的能量变化图。下列说法正确的是
A、该催化循环过程中有氢氧键的断裂和形成 B、反应过程中,中心原子钒的化合价和成键数目均发生改变 C、该机理中化合物a是催化剂,B、C、D、E是中间产物 D、该过程的总反应为:10. 1,3-丁二烯与按进行的某种反应可以分成两步完成,下图是该反应过程中的能量变化图。下列说法正确的是 A、1,3-丁二烯与反应属于取代反应 B、1,3-丁二烯分子中不存在手性碳原子 C、第二步应决定总反应的快慢 D、加入催化剂可以改变该反应的反应热11. 下列物质中,由极性键构成的极性分子的是A、 B、 C、 D、12. S和O可组成一系列负二价阴离子,结构如图。下列说法正确的是
A、1,3-丁二烯与反应属于取代反应 B、1,3-丁二烯分子中不存在手性碳原子 C、第二步应决定总反应的快慢 D、加入催化剂可以改变该反应的反应热11. 下列物质中,由极性键构成的极性分子的是A、 B、 C、 D、12. S和O可组成一系列负二价阴离子,结构如图。下列说法正确的是硫酸根
焦硫酸根
过二硫酸根
硫代硫酸根



 A、电负性 , 该系列中不存在非极性键 B、1mol焦硫酸根在水溶液中可生成2mol C、硫酸根和硫代硫酸根的空间构型均为正四面体 D、过二硫酸根具有极强氧化性,原因是其中S元素处于价13. 符号“”没有给出的信息是A、能层 B、能级 C、电子的自旋取向 D、电子云在直角坐标系的取向14. 下列说法正确的是A、除稀有气体外,第二周期元素随着核电荷数递增,元素的最高正价从+1递增到+7 B、H2O的热稳定性高于H2S是因为水分子间存在氢键 C、共价化合物只含共价键,离子化合物只含离子键 D、共价键的键长等于成键原子之间的核间距
A、电负性 , 该系列中不存在非极性键 B、1mol焦硫酸根在水溶液中可生成2mol C、硫酸根和硫代硫酸根的空间构型均为正四面体 D、过二硫酸根具有极强氧化性,原因是其中S元素处于价13. 符号“”没有给出的信息是A、能层 B、能级 C、电子的自旋取向 D、电子云在直角坐标系的取向14. 下列说法正确的是A、除稀有气体外,第二周期元素随着核电荷数递增,元素的最高正价从+1递增到+7 B、H2O的热稳定性高于H2S是因为水分子间存在氢键 C、共价化合物只含共价键,离子化合物只含离子键 D、共价键的键长等于成键原子之间的核间距二、解答题
-
15. 以镁铝复合氧化物()为载体的负载型镍铜双金属催化剂(Ni-Cu/)是一种新型的高效加氢或脱氢催化剂,其制备流程如下:
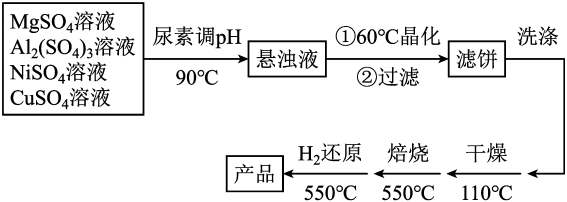
已知:常温下, , 。回答下列问题:
(1)、在元素周期表中,Ni在(填“s”“p”“d”“f”或“ds”)区,基态铜原子的价电子排布式为。(2)、在加热条件下,尿素在水中发生水解反应,放出和(填化学式)两种气体。(3)、“晶化”过程中,需保持恒温60℃,可采用的加热方式为。(4)、常温下,若“悬浊液”中 , 则溶液的。(5)、在消防工业中常用于与小苏打、发泡剂组成泡沫灭火剂,请写出其灭火原理(用离子方程式表示)。三、综合题
-
16. 完成下列填空。(1)、某元素气态氢化物溶于水后溶液显碱性,其元素符号为;其轨道表示式为。(2)、B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为 , C+的结构示意图为。(3)、某元素的原子最外层电子排布式为nsnnpn+2 , 则n=;该元素符号为。(4)、某元素的正三价离子的3d能级为半充满,D的元素符号为 , 其基态原子的电子排布式为。(5)、某元素基态原子的M层全充满,N层没有成对电子且只有一个未成对电子,其元素符号为 , 该元素分布在区。17. 二氧化碳作为温室气体,其减排和再利用是世界气候问题的重大课题,而利用二氧化碳催化加氢制甲醇,就是减少温室气体二氧化碳的探索之一。回答下列问题:(1)、分子中存在个键。(2)、我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为固溶体。四方晶胞如图所示,离子在晶胞中的配位数是。
 (3)、二氧化碳催化加氢制甲醇,涉及反应有:
(3)、二氧化碳催化加氢制甲醇,涉及反应有:反应I.
反应II.
反应III.
某压强下在体积固定的密闭容器中,按照投料发生反应I、II、III。平衡时,CO、在含碳产物中物质的量分数及转化率随温度的变化如图所示。

n曲线代表的物质为。
②在150~250℃范围内,转化率随温度升高而降低的原因是。
(4)、和反应制备的反应机理如图所示(带*的表示吸附在催化剂表面)
①研究表明,图中过程ii的活化能小但实际反应速率慢,是控速步骤,导致该步反应速率小的原因可能是。
A.对该反应有阻碍作用
B.其它物种的存在削弱了同一吸附位上H的吸附
C.温度变化导致活化能增大
D.温度变化导致平衡常数减小
②已知:图中HCOO为甲酸物种,结构是
 ,为甲氧基物种。从化学键视角将图中i与ii的过程可描述为。
,为甲氧基物种。从化学键视角将图中i与ii的过程可描述为。四、推断题
-
18. 已知X、Y、Z、W、R是元素周期表前四周期中原子序数依次增大的常见元素,相关信息如下表:
元素
相关信息
X
元素原子的核外p电子数比s电子数少1
Y
地壳中含量最多的元素
Z
第一电离能至第四电离能分别是: , , ,
W
前四周期中电负性最小的元素
R
在周期表的第十一列
(1)、X基态原子中能量最高的电子,其电子云在空间有个方向,原子轨道呈形。(2)、是动物和人体所必需的微量元素之一,也是重要的工业原料,与Y同族。Se的原子结构示意图为。(3)、Z的基态原子的电子排布式为。(4)、与Z元素成“对角线规则”关系的某短周期元素G的最高价氧化物的水化物具有两性,写出该两性物质与W元素的最高价氧化物的水化物反应的离子方程式:。(5)、R元素位于元素周期表的区,比较元素R与镍的第二电离能(填“<”或“>”),其原因是。五、实验探究题
-
19. 环己酮是重要的化工原料和化工溶剂,某研究小组对其进行了一些探究。(1)、Ⅰ.环己酮的制备。反应原理为
 ,还原产物为 ,反应过程放热,温度过高时环己酮易进一步被氧化,实验装置如图所示。
,还原产物为 ,反应过程放热,温度过高时环己酮易进一步被氧化,实验装置如图所示。 
已知: 溶液呈橙红色, 溶液呈墨绿色。
分液漏斗中盛放的试剂为。(填字母)
a. 溶液 b.环己醇的硫酸溶液
(2)、三颈烧瓶中反应体系的温度需控制在55~60℃,其加热方式为。(3)、反应结束后,还需滴加甲醇,直到(填实验现象)为止,随后分离提纯得到环己酮。(4)、若20.0 mL环己醇( )完全反应并提纯后,得到纯环己酮( )9.6 mL,则环己酮的产率为。(计算结果保留2位有效数字)(5)、Ⅱ.环己酮的结构与性质环己酮中三种元素的电负性由小到大的顺序为。(用元素符号表示)
(6)、若要测定环己酮的相对分子质量,可以采用的波谱分析手段为。(7)、已知: 。环己酮和乙二醇在酸性条件下反应生成分子式为 的产物,其结构简式为。
。环己酮和乙二醇在酸性条件下反应生成分子式为 的产物,其结构简式为。
-
-