高中化学(人教2019)必修二期末知识点复习13 实验:乙醇、乙酸的主要性质
试卷更新日期:2023-05-10 类型:复习试卷
一、综合题
-
1. 按照组成元素可将有机物分为烃和烃的衍生物。(1)、I.某些烃分子的模型如图所示

回答下列问题:
丁的分子式是 , 写出戊的同分异构体的结构简式(一种即可)。(2)、等质量的上述烃,完全燃烧时耗氧量最多的是(填分子式),写出乙完全燃烧的化学方程式。(3)、Ⅱ.烃可以通过化学反应制得烃的衍生物,例如由丙烯可以制得丙烯酸(CH2=CHCOOH)、乳酸[CH3CH(OH)COOH]等。丙烯酸中含氧官能团的名称是。
(4)、丙烯酸可以使溴水褪色,该反应类型为 , 写出反应的化学方程式。(5)、3.6g乳酸与足量钠反应,能生成标准状况下H2的体积为L。(6)、丙烯酸可以和乙醇发生酯化反应,写出反应方程式。2. 山西老陈醋是中国四大名醋之一,已有3000余年的历史,素有“天下第一醋”的盛誉。老陈醋以高粱、麸皮、谷糠和水为主要原料,以大麦、碗豆所制大曲为糖化发酵剂,经酒精发酵后,再经固态醋酸发酵、熏醅、陈酿等工序酿制而成。(1)、山西老陈醋中含游离氨基酸多达18种,其中8种为人体所必需,氨基酸被人体吸收后可结合成人体所需要的基本营养物质,该营养物质是。(2)、高粱中的淀粉在大曲的作用下转化为糖,化学方程式是 , 生成的糖在酶的催化下转化为乙醇,同时还生成。(3)、乙醇继续被氧化最终生成乙酸,区分乙醇与乙酸的一种方法是。(4)、山西流传着“家有二两醋,不用去药铺”的民诊,说明食用老陈醋对人体有很多有益功效,请列举一例。3.(1)、正丁烷与异丁烷互为同分异构体的依据是。(2)、乙烯与加成,乙烯使酸性溶液褪色的原因是 , 工业上制取乙醇的化学方程式是。(3)、将下端绕成螺旋状的铜丝在酒精灯外焰上灼烧,铜丝表面会变黑。反应的化学方程式为;将表面变黑的铜丝灼烧后立即插入盛有无水乙醇的试管中,可以看到乙醇沸腾,铜丝表面恢复红亮。反应的化学方程式为;上述实验操作反复几次后,可以闻到有刺激性气味的物质生成。反应的总的化学方程式为。铜是该反应的 , 原因是。4. 乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。(1)、乙烯的电子式 , 结构简式。(2)、鉴别甲烷和乙烯的试剂是(填序号)。a.稀硫酸 b.溴的四氯化碳溶液 c.水 d.酸性高锰酸钾溶液
(3)、下列物质中,可以通过乙烯加成反应得到的是(填序号)。a.CH3CH3 b.CH3CHCl2 c.CH3CH2OH d.CH3CH2Br
(4)、已知 2CH3CHO+O2 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示: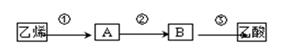
反应②的化学方程式为。 工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为 , 反应类型是。
5. 按要求完成下列问题。(1)、现有5种有机物:①乙烯;②乙醇;③葡萄糖;④乙酸;⑤乙酸乙酯。①能发生银镜反应的是(填序号,下同);
②能发生水解反应的是;
③具有酸性且能发生酯化反应的是;
④既能发生加成反应,又能发生加聚反应的是;
⑤能使酸性高锰酸钾褪色的是。
(2)、下列说法正确的是___________(填字母)。A、含元素种类相同而结构不同的化合物互为同分异构体 B、某有机物完全燃烧后生成二氧化碳和水,说明该有机物中必定含有碳、氢、氧三种元素 C、甲烷与氯气的混合气体在光照条件下反应生成的是一氯甲烷和氯化氢 D、乙烯与氯气加成反应的产物是6. 淀粉是一种多糖,以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如图所示: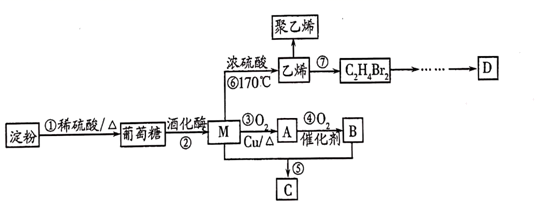 (1)、M中的官能团的名称为 , ⑦的反应类型是。(2)、③的化学方程式是。(3)、聚乙烯和聚丙烯都是生产塑料的合成树脂,写出由丙烯制备聚丙烯的化学方程式:。(4)、⑤的化学方程式是。(5)、1molD与足量NaHCO3溶液反应能生成2molCO2 , 含有与D相同种类官能团的物质E的分子式为C5H10O2 , 写出分子中有两个甲基的E的所有同分异构体的结构简式。7. 我国传统酿造工艺历史悠久,流程一为由谷物酿酒的过程,流程二为饮酒后乙醇在人体内的转化过程。根据题给信息和所学知识回答下列问题:
(1)、M中的官能团的名称为 , ⑦的反应类型是。(2)、③的化学方程式是。(3)、聚乙烯和聚丙烯都是生产塑料的合成树脂,写出由丙烯制备聚丙烯的化学方程式:。(4)、⑤的化学方程式是。(5)、1molD与足量NaHCO3溶液反应能生成2molCO2 , 含有与D相同种类官能团的物质E的分子式为C5H10O2 , 写出分子中有两个甲基的E的所有同分异构体的结构简式。7. 我国传统酿造工艺历史悠久,流程一为由谷物酿酒的过程,流程二为饮酒后乙醇在人体内的转化过程。根据题给信息和所学知识回答下列问题: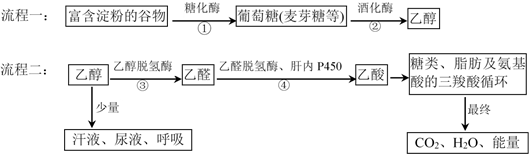 (1)、葡萄糖的结构简式为 , 所含官能团有醛基和(写名称)。(2)、下列说法正确的是。
(1)、葡萄糖的结构简式为 , 所含官能团有醛基和(写名称)。(2)、下列说法正确的是。a.由谷物酿造的酒,对人体有益而无害,可放心饮用
b.蛋白质、淀粉水解的最终产物分别是氨基酸和葡萄糖
c.交警用酒精检测仪(含K2Cr2O7)查“酒驾”,其实质是乙醇被氧化
d.脂肪属于高分子化合物,水解后才能被人体吸收
e.啤酒的度数一般是3~5(%vol),表示的是100mL酒中含有3~5g乙醇
(3)、实验室中实现③转化的化学方程式为。(4)、阿司匹林( ) 是一种解热、镇痛和消炎药物,可由水杨酸(
) 是一种解热、镇痛和消炎药物,可由水杨酸(  ) 和乙酸反应得到,该反应的化学方程式为 , 其反应类型为。 8.(1)、从A.甲烷 B.乙酸 C.乙醇 D.蛋白质等四种有机物中,选择合适的物质,将其标号填在横线上。
) 和乙酸反应得到,该反应的化学方程式为 , 其反应类型为。 8.(1)、从A.甲烷 B.乙酸 C.乙醇 D.蛋白质等四种有机物中,选择合适的物质,将其标号填在横线上。①蚕丝的主要成分是。
②我国“西气东输”的气体主要成分是。
③酒驾是指驾驶员呼出的气体中含量超标。
④可清除热水瓶内胆水垢[主要成分CaCO3和Mg(OH)2]的是。
(2)、A、B、C、D、E均为中学常见有机物,其转化关系如下图,回答下列问题:
①E物质的结构简式为 , A⟶B的化学方程式为。
②实验室利用A和C制取D,反应的化学方程式为 , 收集装置可选用下图装置(填标号)。
 9. 如图所示是高中化学常见四种有机物的比例模型示意图。请用字母序号填空:
9. 如图所示是高中化学常见四种有机物的比例模型示意图。请用字母序号填空: (1)、可燃冰的主要成分是;(2)、分子中所有原子共平面的是;(3)、能与金属钠反应的是。
(1)、可燃冰的主要成分是;(2)、分子中所有原子共平面的是;(3)、能与金属钠反应的是。二、实验探究题
-
10. 某校化学兴趣小组围绕乙醇的性质进行了相关探究,请你参与并完成对有关问题的解答。(1)、甲同学向小烧杯中加入无水乙醇,再放入一小块金属钠(约绿豆粒大),观察实验现象。请在表中将实验现象及结论补充完全。
实验现象
实验结论
①
钠沉在烧杯底部
钠的密度乙醇(填“大于”或“小于”)
②
反应有气体产生
(2)、乙同学探究了乙醇的催化氧化反应,反应装置如图。实验操作流程为:点燃酒精灯,加热片刻后,再间歇性地挤压气囊鼓入空气。
①反应时中铜丝的颜色变化为。
②一段时间后中收集到一种新物质,写出生成该物质的化学方程式 , 该实验说明乙醇具有性(填“氧化”或“还原”)。
(3)、丙同学根据教材中制备乙酸乙酯的实验装置图进行了改进,如图,继续实验。
乙醇
乙酸
乙酸乙酯
98%浓硫酸
熔点/℃
16.6
——
沸点/℃
78.5
117.9
77.5
338.0
资料:温度高于140℃时发生副反应:
①水从冷凝管的 (填“”或“”)处进入。
②考虑到反应速率等多种因素,用上述装置制备乙酸乙酯时,反应的最佳温度范围是 (填字母)。
A. B. C.
(4)、用30g乙酸与46g乙醇反应,如果实际产量是理论产量的67%,则实际得到乙酸乙酯的质量是g。11. “太原青霜熬绛饧,甘露冻作紫水精。”是宋代诗人杨万里赞美太原葡萄酒的诗句,太原市清徐县自古以来就以葡萄酒和山西老陈醋的酿制闻名全国。(1)、葡萄酒中含有乙醇,乙醇的官能团是。(2)、酒类产品标签中的酒精度是指乙醇的体积分数,清徐某品牌葡萄酒的酒精度为4%,则一瓶400 mL的葡萄酒中乙醇的体积是 , 乙醇进入人体后,会在肝中通过酶的催化作用被(填“氧化”或“还原”)为乙醛和乙酸,最终生成二氧化碳和水。乙醇在人体内转化为乙醛的化学方程式是。葡萄酒中常常添加微量二氧化硫以延长其保质期,这是利用了二氧化硫的性。(3)、酿醋过程中的熏醅使醋增色、增香、增脂,其原理是乙醇与乙酸发生了反应。在实验室中用下列装置模拟该反应的原理:
①A试管中碎瓷片的作用是 , B试管中盛装的是。
②A试管中发生反应的化学方程式是 , 反应类型是 , 该反应中浓硫酸的作用是。
12. 乙醇分子中的羟基在一定条件下可以被氧化为醛基(—CHO),为验证此性质,有关实验如下:某实验小组用下列装置进行乙醇催化氧化的实验。已知乙醇的沸点为78.5℃。

在鼓入空气的条件下进行实验:加入药品后,点燃酒精灯给铜网加热,打开止水夹,鼓入空气。
(1)、实验过程中铜网出现红色、黑色交替的现象。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是反应(填“放热”或“吸热”)。上述过程中发生反应的总化学方程式为。(2)、甲和乙两个水浴的作用不相同。甲的作用是;乙的作用是。(3)、反应进行一段时间后,试管a中能收集到不同的物质,它们是。集气瓶中收集到的气体的主要成分是 , 若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。13. 乙醚是有机合成中重要的溶剂,在医药上常用作麻醉剂。实验室可用如图所示装置制备乙醚(夹持和加热装置均省略):
反应原理如下:
主反应 2CH3CH2OH CH3CH2OCH2CH3+ H2O
副反应CH3CH2OH CH2=CH2↑ + H2O
CH3CH2OH CH3COOH
实验中可能用到的数据:
物质
乙醇
乙醚
乙酸
熔点/℃
-114.l
- 116.2
16.6
沸点/℃
78.4
34.5
l 17.9
水溶性
与水互溶
微溶
易溶
实验过程:
①在三颈烧瓶中加入12 mL质量分数为92%乙醇(相对密度为0.80g•cm-3)和12 mL浓硫酸,再加入几粒沸石,分液漏斗中盛有25mL质量分数为92%乙醇,按图连接好装置:
②加热,将温度迅速上升到140℃开始向三颈烧瓶中滴加乙醇,维持反应温度在140℃,乙醇全部滴入后,继续反应一段时间,停止加热;
③将馏出液转入分液漏斗,分别用氢氧化钠溶液、饱和氯化钠溶液、饱和氯化钙溶液洗涤,得到有机粗产品;
④ 用无水氯化钙于燥粗产品至澄清,过滤,将滤液进行蒸馏,得到4.8g乙谜。
请回答下列问题:
(1)、仪器a的名称是。(2)、混合浓硫酸和乙醇的实验操作是。(3)、反应温度不超过140℃其的目是。(4)、提纯乙醚时氢氧化钠溶液的作用是。(5)、本实验中乙醚的产率为% (结果保留小数点后一位数字).14.(1)、按要求选择合理实验装置:
①鉴别Na2CO3和NaHCO3固体,选用(填序号,下同)。
②分离水和植物油,选用。
③用乙酸、乙醇和浓硫酸制备乙酸乙酯,选用。
(2)、写出1-丙醇在空气中催化氧化的化学方程式:。15. 为了探究氨、乙醇的性质,某同学设计并进行了下列实验。
请回答:
(1)、仪器B的名称为。(2)、为快速制备氨气,A中应加入的试剂为 , B中应放入的试剂为。(3)、若A中加入乙醇,B中加入生石灰,C中加入无水硫酸铜,反应一段时间后,C中的现象为。经检测反应中既生成了乙醛,又生成了少量乙酸。请写出乙醇与氧化铜反应生成乙醛的化学方程式。(4)、在(3)中实验里,某同学为检验尾气中是否含有乙醇,虚线框处宜选择的装置是(填“甲”或“乙”);实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入试管中,观察到铜丝由黑渐渐变红,由此可得出的结论是。(并简述其理由)16. 下图所示为某化学兴趣小组设计的乙醇催化氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出).图中A试管盛有无水乙醇(沸点为78℃),B处为螺旋状的细铜丝,C处为无水硫酸铜粉末,干燥管D中盛有碱石灰,E为新制的氢氧化铜,F为氧气的发生装置.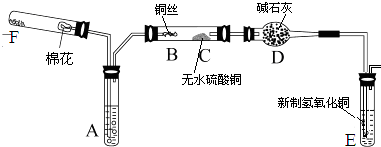 (1)、在实验过程中,需要加热的仪器(或区域)有(填仪器或区域的代号A~F) .(2)、B处发生的化学反应方程式为 .(3)、C处应出现的现象是 ,
(1)、在实验过程中,需要加热的仪器(或区域)有(填仪器或区域的代号A~F) .(2)、B处发生的化学反应方程式为 .(3)、C处应出现的现象是 ,D处使用碱石灰的作用是 ,
E处应出现的实验现象是 ,
F处可以添加的固体药品是 .
(4)、若本实验中拿去F装置(包括其上附的单孔塞和导管),同时将A试管处原来的双孔塞换成单孔塞用以保证装置的气密性,其它操作不变,则发现C处无明显变化,而E处除了依然有上述(3)中所出现的现象之外,还有气体不断地逸出.由此推断此时B处发生反应的化学方程式为 .17. A是化学实验室中常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平。有关物质的转化关系如图所示: (1)、A中含有的官能团是;B的结构简式是;D的结构简式是。(2)、反应①的化学方程式是。(3)、反应②的化学方程式是;反应类型是。
(1)、A中含有的官能团是;B的结构简式是;D的结构简式是。(2)、反应①的化学方程式是。(3)、反应②的化学方程式是;反应类型是。