高中化学(人教2019)必修二期末知识点复习1 硫及其化合物
试卷更新日期:2023-05-10 类型:复习试卷
一、单选题
-
1. 下列说法错误的是A、SO2可用于食品加工 B、液氨可作制冷剂 C、工业上用焦炭还原石英砂来制取粗硅 D、工业上将氯气通入饱和石灰水中来制备漂白粉2. 科学生产中蕴藏着丰富的科学知识。化学改善人类生活,创造美好世界。下列生产、生活情境中涉及的原理错误的是A、太阳能电池板广泛应用在航天器上,利用的光电性质 B、葡萄酒中通常添加少量 , 既可以杀菌又可以防止营养成分被氧化 C、催化光解设施可处理汽车尾气中的CO、 , CO和催化反应生成和 D、景德镇的瓷器可由黏土经高温烧结而成,过程中发生了化学变化3. 下列实验操作和现象得出的实验结论正确的是
实验操作
实验现象
实验结论
A
将通入盛有2mL新制氯水的试管中
新制氯水褪色
有氧化性
B
常温下,将铁片、铜片分别插入浓硝酸中
铁无明显变化铜片剧烈反应
金属活动性:Cu>Fe
C
取少量待测液于试管中,加入浓NaOH溶液并加热,将一片湿润的红色石蕊试纸放在试管口
试纸变蓝
溶液中含有
D
取少量待测液于试管中,滴加几滴溶液
产生白色沉淀
溶液中含有
A、A B、B C、C D、D4. 下列实验结论与实验现象不对应的一组是选项
实验
现象
结论
A
向某盐溶液中加入溶液
溶液变为红色
该溶液中含有
B
向某盐溶液中加入浓溶液,加热
产生的气体能使湿润的红色石蕊试纸变蓝
该溶液中含有
C
向蔗糖中滴加浓硫酸
蔗糖变黑
浓硫酸具有脱水性
D
向淀粉溶液中加入少量稀 , 加热,冷却后加溶液至碱性,再加少量新制的 , 加热
生成砖红色沉淀
淀粉完全水解
A、A B、B C、C D、D5. 化学在人类社会的可持续发展中发挥着重要作用。下列说法错误的是A、储氢合金、钛合金、耐热合金和形状记忆合金能满足某些尖端技术的需要 B、“天宫二号”空间实验室的太阳能电池板的主要材料是二氧化硅 C、在葡萄酒中添加适量的二氧化硫,可以使葡萄酒保持良好的品质 D、非处方药的包装上印有“OTC”标识6. 下列关于SO2的叙述正确的是A、SO2是无色、无味、有毒的气体 B、SO2不能使酸性高锰酸钾褪色 C、SO2的大量排放是形成酸雨的唯一原因 D、SO2与NaOH溶液反应可能生成Na2SO3或NaHSO37. 将适量蔗糖放入烧杯中,滴几滴水,搅拌均匀;然后再加入适量浓硫酸,迅速搅拌,观察到蔗糖逐渐变黑,体积膨胀,并产生气体,下列说法错误的是A、浓硫酸表现出脱水性和强氧化性 B、黑色物质是炭 C、浓硫酸被氧化 D、气体中含有SO2和CO28. 大约4 000年前,埃及人已经用硫燃烧所形成的二氧化硫漂白布匹。在古罗马著名诗人荷马的著作里讲到硫燃烧有消毒和漂白作用。下列物质都具有漂白性:①潮湿的氯气、②二氧化硫、③活性炭、④过氧化钠,其漂白原理相同的是( )A、①③ B、②③ C、①④ D、②④9. 下列关于物质的用途叙述错误的是A、浓具有强吸水性,能吸收蔗糖的水分并使其炭化 B、具有强氧化性,可溶解铜、银等不活泼金属 C、二氧化硅可以用来生产通信容量大、抗干扰性能好的光导纤维 D、氮化硅陶瓷具有耐高温、抗氧化、耐腐蚀等性能,是制造火箭发动机的理想材料10. 物质间纷繁复杂的转化关系是化学的魅力所在,一定条件下,在下列选项物质的每步转化中,有不能直接实现的是A、 B、 C、 D、11. 浓硫酸与下列物质作用时,既表现氧化性又表现酸性的是A、红热的木炭 B、胆矾晶体 C、铜 D、使蔗糖变黑12. 下列关于硫单质及其化合物之间转化反应的方程式书写正确的是A、单质转化为盐: B、酸转化为氧化物: C、酸转化为盐: D、可溶性盐转化为另一种盐:13. 化学与生活密切相关,下列有关说法正确的是( )A、单晶硅可用于制造光导纤维 B、液氨汽化吸收大量的热,可用作制冷剂 C、冬奥会的火炬外壳使用了新型有机非金属材料——碳纤维复合材料 D、二氧化硫具有漂白性,可用于大量漂白银耳14. 已知某物质X能发生如下转化:
下列有关上述转化关系中物质及其反应的叙述正确的是( )
A、若X为C,则Y可以和氢氧化钠反应生成盐和水 B、若X为S,则A为硫酸 C、反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应 D、X一定是非金属单质或非金属氢化物15. 化学与生产、生活和科技密切相关。下列说法正确的是( )A、2022年2月进行的北京冬奥会上运动员的“战袍”利用黑科技——石墨烯发热材料进行加热保暖,石墨烯是有机高分子材料 B、跨洲际往返塞尔维亚的“运-20”机身采用钨碳熔合材料,属于新型无机非金属材料 C、手机、笔记本计算机、照相机和摄像机等电器所用的电池大多数为一次电池 D、二氧化硫可用作葡萄酒的食品添加剂,用来杀死有害细菌,防止色素被氧化16. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、17. 下列有关物质的性质与用途具有对应关系的是( )A、二氧化硫有还原性,可用作葡萄酒的抗氧化剂 B、浓硫酸具有强氧化性,可用作酯化反应的催化剂 C、硝酸见光易分解,可用于制氮肥 D、氨气极易溶于水,可用作制冷剂二、填空题
-
18. 燃煤的烟气中含有SO2 , 为了治理雾霾天气,工厂采用多种方法实现烟气脱硫。(1)、“湿式吸收法”利用吸收剂与SO2发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是(填字母序号)。
a.石灰乳 b.CaCl2溶液
(2)、某工厂利用含SO2的烟气处理含Cr2O72-的酸性废水,吸收塔中反应后的铬元素以Cr3+形式存在,具体流程如下: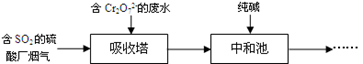
①用SO2处理含铬废水时,利用了SO2的性。
②吸收塔中发生反应的离子方程式为。
(3)、该废水经处理后,测得有关数据如下(其他离子忽略不计):离子
Cr2O72-
Cr3+
H +
Na +
SO42-
浓度(mol/L)
a
0.2×10-6
1.2×10-6
6.8×10-6
3.0×10-6
则a= 。
三、综合题
-
19. 阅读短文,回答问题。
(Ⅰ)二氧化硫()是大气污染物中的一种,但合理使用可为人类造福。在葡萄酒酿制中适量添加 , 可防止葡萄酒在陈酿和贮藏过程中被氧化,抑制葡萄汁中微生物的活动。食糖加工过程中可使用进行脱色。按照我国《食品添加剂使用标准(GB2760-2014)》,合理使用不会对人体健康造成危害。的获取和转化是工业制硫酸的关键步骤。工业利用硫制硫酸的主要过程如下:。硫酸工业的尾气中含有少量 , 若直接排放会污染空气,并导致硫酸型酸雨。工业上可先用氨水(一种碱)吸收,再用硫酸处理,将重新生成的循环利用。
(1)、葡萄酒酿制过程中的作用是作剂。(2)、用硫制硫酸的主要过程中,属于氧化还原反应的是(填序号)。(3)、硫酸工业尾气中的用氨水吸收,写出反应的化学方程式。(4)、足量通入溴水中的现象是;写出相关化学方程式。20. 为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。回答下列问题:(1)、据汞的原子结构示意图 , 汞在第周期。 (2)、①叠氮化钠(NaN3)可用于汽车安全气囊的产气药,NaN3在撞击时能发生分解反应生成两种单质。计算理论上65 gNaN3完全分解,释放出标准状况下的气体体积L。
, 汞在第周期。 (2)、①叠氮化钠(NaN3)可用于汽车安全气囊的产气药,NaN3在撞击时能发生分解反应生成两种单质。计算理论上65 gNaN3完全分解,释放出标准状况下的气体体积L。②氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,工业将氧化铝、氮气和碳在一定条件下反应制得AlN和CO,请将下列的化学反应方程式配平。
_Al2O3+_N2+_C—_AlN+_CO
(3)、利用元素的化合价推测物质的性质是化学研究的重要于段。如图是硫元素的“价—类”二维图:
①从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有(填化学式)。
②Z的浓溶液与铁单质在加热条件下可以发生化学反应生成Y,该反应的化学方程式为。
四、实验探究题
-
21. 浓硫酸与木炭在加热条件下可发生化学反应,为检验反应的产物,某同学设计了如下图所示的实验。请据此回答下列问题
 (1)、圆底烧瓶内发生反应的化学方程式为。(2)、A装置中的现象是 , 证明产物中有生成(填写化学式,下同)。(3)、B装置证明产物中有生成,现象是。(4)、D装置中的现象是。(5)、C装置发生反应的离子方程式是。22. 某化学小组制备并验证的部分性质,装置如图所示(部分夹持装置省略):
(1)、圆底烧瓶内发生反应的化学方程式为。(2)、A装置中的现象是 , 证明产物中有生成(填写化学式,下同)。(3)、B装置证明产物中有生成,现象是。(4)、D装置中的现象是。(5)、C装置发生反应的离子方程式是。22. 某化学小组制备并验证的部分性质,装置如图所示(部分夹持装置省略): (1)、仪器a的名称是。(2)、装置A制取的反应中,利用了浓硫酸的性,(填“能”或“不能”)用浓硝酸代替。(3)、在滴加浓硫酸之前,需先通入一段时间的 , 此操作的目的是。(4)、装置B中的反应生成乳白色浑浊的同时生成了一种强碱,则该反应的化学方程式为。(5)、装置D验证了的漂白性,为了进一步探究与品红作用的可逆性,请写出有关实验操作及现象:。(6)、为测定装置E中收集到的混合气体中二氧化硫的含量,进行如下操作:
(1)、仪器a的名称是。(2)、装置A制取的反应中,利用了浓硫酸的性,(填“能”或“不能”)用浓硝酸代替。(3)、在滴加浓硫酸之前,需先通入一段时间的 , 此操作的目的是。(4)、装置B中的反应生成乳白色浑浊的同时生成了一种强碱,则该反应的化学方程式为。(5)、装置D验证了的漂白性,为了进一步探究与品红作用的可逆性,请写出有关实验操作及现象:。(6)、为测定装置E中收集到的混合气体中二氧化硫的含量,进行如下操作:
当注入标准状况下10mL混合气体时,酸性 , 溶液恰好褪色,假设混合气体中能被溶液充分吸收。已知:。该混合气体中二氧化硫的体积分数为。
23. 用铜单质与浓硫酸反应制备并验证某些性质的装置如图所示:
回答下列问题:
(1)、a中用可抽拉的铜丝,最大的优点是 , a中反应的化学方程式为。(2)、实验开始后,b、c中的现象分别是、。(3)、若d中试剂分别是溶液、溶液或溶液时,其中没有沉淀生成的试剂是 , 有沉淀生成的试剂是。(4)、若去掉图中的棉团,可能的危害是。(5)、若实验结束时铜有剩余,为证明a中还存在稀硫酸,某同学取出少量溶液放入试管中,然后向试管中加入试剂X,根据实验现象可确定确实存在稀硫酸,则试剂X不可能是____(填序号)。A、 B、铁粉 C、
-