福建省莆田市2023届高中毕业班下学期3月第二次教学质量检测化学试题
试卷更新日期:2023-05-09 类型:高考模拟
一、单选题
-
1. 化学与生产、生活及科技等息息相关。下面说法错误的是A、“兴化米粉”的主要成分是淀粉 B、“莆田尾暝灯”闹元宵使用蜡烛的主要成分是烃类 C、“云度”汽车使用的碳纤维属于新型有机材料 D、“福建舰”采用富锌涂层具有防水、隔氧等作用2. 从某中草药中提取一种具有治疗癌症作用的有机物,结构如下图所示。下列说法错误的是
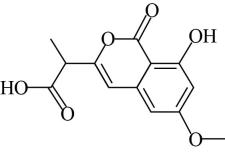 A、含有平面环状结构 B、含有1个手性碳原子 C、能发生取代反应、加成反应 D、该有机物最多能与反应3. 科学家发现某些生物酶能将海洋中的转化为 , 该过程的总反应为。设为阿伏加德罗常数的值,下列说法正确的是A、溶液中含离子的数目为 B、标准状况下,中含键的数目为 C、18克中含电子对的数目为 D、完全反应失去电子的数目为4. 用下列装置进行相应的实验,能达到实验目的的是
A、含有平面环状结构 B、含有1个手性碳原子 C、能发生取代反应、加成反应 D、该有机物最多能与反应3. 科学家发现某些生物酶能将海洋中的转化为 , 该过程的总反应为。设为阿伏加德罗常数的值,下列说法正确的是A、溶液中含离子的数目为 B、标准状况下,中含键的数目为 C、18克中含电子对的数目为 D、完全反应失去电子的数目为4. 用下列装置进行相应的实验,能达到实验目的的是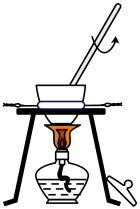
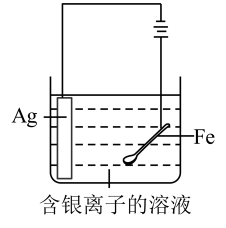


A.灼烧碎海带
B.电镀银
C.氧化还原反应滴定
D.制备乙酸乙酯
A、A B、B C、C D、D5. 现有下列实验探究摩尔盐的化学性质。装置
实验
试剂a
现象

①
紫色石蕊溶液
溶液变红色
②
溶液
产生白色沉淀
③
稀硝酸溶液
溶液变黄色
④
浓溶液
产生具有刺激性气味的气体
下列离子方程式不能准确解释相应实验现象的是
A、①中溶液变红:、 B、②中产生白色沉淀: C、③中溶液变黄: D、④中产生有刺激性气体:6. 碘及其化合物广泛用于医药、染料等方面。的一种制备方法如下图所示。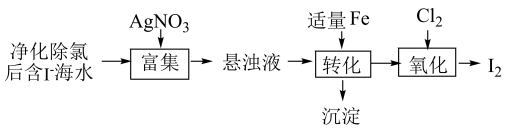
下列说法错误的是
A、“富集”中所发生的离子反应为: B、“转化”中为了使悬浊液充分反应,使用铁粉并搅拌 C、“转化”中生成的沉淀与硝酸反应所得产物可循环使用 D、“氧化”中通入足量氯气时只得到氧化产物7. 活泼自由基与氧气的反应一直是关注的热点。自由基与反应过程的能量变化如下图所示,已知升高温度,活化能大的反应速率增大的程度越大。下列说法正确的是 A、比稳定 B、升高温度,生成的反应速率增大的程度更大 C、该历程中最小正反应的活化能为 D、改变催化剂可以改变生成的反应焓变8. 我国科学家在寻找“点击反应”的砌块过程中,发现一种新的化合物,结构如下图所示,其中X、Y、Z和W是原子序数依次增大的短周期主族元素,Y与W是同一主族元素。下列说法正确的是
A、比稳定 B、升高温度,生成的反应速率增大的程度更大 C、该历程中最小正反应的活化能为 D、改变催化剂可以改变生成的反应焓变8. 我国科学家在寻找“点击反应”的砌块过程中,发现一种新的化合物,结构如下图所示,其中X、Y、Z和W是原子序数依次增大的短周期主族元素,Y与W是同一主族元素。下列说法正确的是 A、元素电负性:Z>Y>W B、简单氢化物沸点:X>Y>W C、简单离子半径:Z>Y>X D、X、W氧化物的水化物均为强酸9. 铁碳微电解技术是处理酸性废水的一种工艺,装置如下图所示。若上端口打开,并鼓入空气,可得到强氧化性中间体羟基自由基;若上端口关闭,可得到强还原性中间体氢原子。下列说法正确的是
A、元素电负性:Z>Y>W B、简单氢化物沸点:X>Y>W C、简单离子半径:Z>Y>X D、X、W氧化物的水化物均为强酸9. 铁碳微电解技术是处理酸性废水的一种工艺,装置如下图所示。若上端口打开,并鼓入空气,可得到强氧化性中间体羟基自由基;若上端口关闭,可得到强还原性中间体氢原子。下列说法正确的是 A、无论上端口是关闭还是打开,正极反应式均为: B、完全转化为羟基自由基时转移了电子 C、若处理含酚类的酸性废水,则上端口应关闭 D、若处理含的酸性废水,则上端口应打开并鼓入空气10. 常温下,用溶液滴定溶液,消耗溶液的体积与混合液关系如下图所示。滴定过程中有白色沉淀生成,但整个过程未见气泡产生。已知:碳酸 , ;。下列说法正确的是
A、无论上端口是关闭还是打开,正极反应式均为: B、完全转化为羟基自由基时转移了电子 C、若处理含酚类的酸性废水,则上端口应关闭 D、若处理含的酸性废水,则上端口应打开并鼓入空气10. 常温下,用溶液滴定溶液,消耗溶液的体积与混合液关系如下图所示。滴定过程中有白色沉淀生成,但整个过程未见气泡产生。已知:碳酸 , ;。下列说法正确的是 A、ab段升高的主要原因: B、bc段溶液不可能出现白色沉淀 C、b点: D、c点:
A、ab段升高的主要原因: B、bc段溶液不可能出现白色沉淀 C、b点: D、c点:二、综合题
-
11. 锗是现化高科技产业重要的基础材料。用含氧化锌烟尘(杂质主要有、、、、等)为主要原料制备氧化锌和高纯度单质锗的一种工艺流程如图所示。

已知:①单宁酸是一种只含C、H、O元素的有机化合物
② , 常温下 , , ,
③当溶液中某离子的物质的量浓度不大于时,该离子沉淀完全
(1)、“酸浸”后所得的滤渣主要成分除外,还含有。(填化学式)(2)、如图所示,“酸浸”过程中浓硫酸用量超过理论量会导致锗的浸出率降低,其可能的原因为。 (3)、“调”所用试剂X为(填一种物质的化学式),若“酸浸”后溶液中 , 则应调控的范围为。(4)、若“沉锌”的产物为 , 则反应的离子方程式为。(5)、“水解”反应的化学方程式为。(6)、在750℃的熔融盐体系中,将“水解”产物作为电极进行电解生成单质 , 该电极反应式为。12. 可用于环境消毒。实验室利用如图装置制备溶液,已知通入溶液存在如下反应:
(3)、“调”所用试剂X为(填一种物质的化学式),若“酸浸”后溶液中 , 则应调控的范围为。(4)、若“沉锌”的产物为 , 则反应的离子方程式为。(5)、“水解”反应的化学方程式为。(6)、在750℃的熔融盐体系中,将“水解”产物作为电极进行电解生成单质 , 该电极反应式为。12. 可用于环境消毒。实验室利用如图装置制备溶液,已知通入溶液存在如下反应:Ⅰ.
Ⅱ.
反应Ⅰ的反应速率很快,反应Ⅱ在室温下较慢。
 (1)、仪器a的名称是。(2)、制备 , 必要时可进行加热,则装置甲中试剂X为(填化学式),相应的化学方程式为。(3)、装置乙中蒸馏水的作用是。(4)、为了提高产率,对装置丙进行改进,可采取的一种措施是。(5)、实验过程中仍有少量进入装置丁的原因是(写一种原因)。(6)、有效氯指的是每升含氯消毒液的氧化能力相当于多少克的氧化能力。实验测得装置丙中的有效氯为 , 假设有效氯都来自 , 则该溶液中的物质的量浓度为。若实验制得的溶液在放置过程中又有部分转化成 , 则有效氯含量(填“变大”“变小”或“不变”)。13. 有效转化是研究“碳中和”的重要方向。(1)、可用于人工合成淀粉,其中前两步的反应如下图所示。
(1)、仪器a的名称是。(2)、制备 , 必要时可进行加热,则装置甲中试剂X为(填化学式),相应的化学方程式为。(3)、装置乙中蒸馏水的作用是。(4)、为了提高产率,对装置丙进行改进,可采取的一种措施是。(5)、实验过程中仍有少量进入装置丁的原因是(写一种原因)。(6)、有效氯指的是每升含氯消毒液的氧化能力相当于多少克的氧化能力。实验测得装置丙中的有效氯为 , 假设有效氯都来自 , 则该溶液中的物质的量浓度为。若实验制得的溶液在放置过程中又有部分转化成 , 则有效氯含量(填“变大”“变小”或“不变”)。13. 有效转化是研究“碳中和”的重要方向。(1)、可用于人工合成淀粉,其中前两步的反应如下图所示。
已知
则的(用、、表示)。
(2)、CO2催化加氢可合成乙烯,反应为2CO2(g)+6H2(g)C2H4(g)+4H2O(g) ΔH<0,在恒压密闭容器中,起始充入2molCO2(g)和6molH2(g)发生反应,不同温度下达到平衡时各组分的体积分数随温度的变化如图所示。
①下列说法正确的是
A.b点时:2v正(H2)=3v逆(H2O)
B.a、b、c三点的平衡常数:Ka>Kc>Kb
C.将H2O(g)液化分离可提高C2H4的产率
D.活性更高的催化剂可提高CO2的平衡转化率
②表示C2H4体积分数随温度变化的曲线是(填“k”“l”“m”或“n”)
③若d点表示240℃某时刻H2的体积分数,保持温度不变,则反应向(填“正”或“逆”)反应方向进行。
④205℃,反应达b点所用时间为tmin,则此过程中用CO2表示的反应速率是mol/min。若平衡时b点总压为P,则平衡常数Kp=(列出计算式,以分压表示,分压=总压×物质的量分数)。
⑤其他条件相同,分别在催化剂X、Y作用下发生该反应,测得相同时间CO2的转化率与温度的关系如下图所示。使用催化剂X,当温度高于302℃,CO2转化随着温度升高而下降的原因是。
 14. 是普鲁士蓝类化合物中的一种,可用于钠离子电池的正极材料。晶胞如图所示(未标出)。
14. 是普鲁士蓝类化合物中的一种,可用于钠离子电池的正极材料。晶胞如图所示(未标出)。 (1)、基态Mn原子的外围电子轨道表示式为。(2)、Mn、Fe元素的第三电离能(I3):(填“>”或“<”)。(3)、中的第二周期元素与H元素形成的、、化合物中,A-A键键能依次减小,从结构角度分析其原因是。其中分子中N原子的杂化类型为。(4)、晶胞中,与形成配位键的元素有。晶胞结构的另一种表示中,若O点处于晶胞体心位置,则晶胞中处于位置。15. 阿帕替尼是我国自主研制的一种小分子酪氨酸酶抑制剂,是目前唯一一种口服治疗晚期胃癌的靶向药物。其合成路线如下图所示。
(1)、基态Mn原子的外围电子轨道表示式为。(2)、Mn、Fe元素的第三电离能(I3):(填“>”或“<”)。(3)、中的第二周期元素与H元素形成的、、化合物中,A-A键键能依次减小,从结构角度分析其原因是。其中分子中N原子的杂化类型为。(4)、晶胞中,与形成配位键的元素有。晶胞结构的另一种表示中,若O点处于晶胞体心位置,则晶胞中处于位置。15. 阿帕替尼是我国自主研制的一种小分子酪氨酸酶抑制剂,是目前唯一一种口服治疗晚期胃癌的靶向药物。其合成路线如下图所示。
回答下列问题:
(1)、H中含氧官能团的名称为。(2)、B的结构简式为 , C的分子式为。(3)、D→E、G→H的反应类型分别为。(4)、E→G化学反应方程式。(5)、F的同分异构体中,含一个苯环,核磁共振氢谱有2组峰且面积比为的结构简式为。