四川省达州市2023届高三下学期第二次诊断性测试理科综合化学试题
试卷更新日期:2023-05-09 类型:高考模拟
一、单选题
-
1. 化学与生活、生产及环境密切相关,下列说法错误的是A、常规融雪剂(CaCl2、NaCl等)的使用对桥梁和环境有破坏作用 B、“北溪”管道输送的天然气主要成分是烷烃,其中己烷占绝大多数 C、家庭装修时用水性漆替代传统的油性漆,有利于健康及环境 D、葡萄酒中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒2. 下列离子方程式书写正确的是A、用Pt电极电解AlCl3饱和溶液:2H2O+2Cl-H2↑+Cl2↑+2OH- B、向NaClO溶液中通入少量SO2:SO2+ClO-+H2O=+Cl-+2H+ C、碳酸氢铵溶液中滴入少量的氢氧化钠溶液:+OH-NH3·H2O D、CuSO4溶液与闪锌矿(ZnS)反应生成铜蓝(CuS):Cu2+(aq)+ZnS(s)Zn2+(aq)+CuS(s)3. 某有机物分子结构如图所示,下列说法正确的是
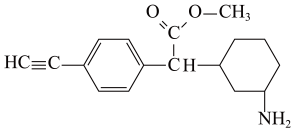 A、该分子中含有4种官能团 B、该分子一氯代物有12种 C、该分子中至少有7个碳原子共直线 D、该有机物只能与碱溶液反应4. 如图所示实验操作正确的是A、
A、该分子中含有4种官能团 B、该分子一氯代物有12种 C、该分子中至少有7个碳原子共直线 D、该有机物只能与碱溶液反应4. 如图所示实验操作正确的是A、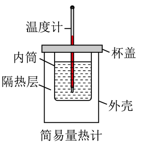 测定中和反应反应热
B、
测定中和反应反应热
B、 除去Fe2(SO4)3溶液中的FeSO4
C、
除去Fe2(SO4)3溶液中的FeSO4
C、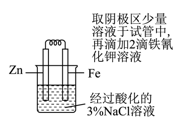 验证牺牲阳极法保护铁
D、
验证牺牲阳极法保护铁
D、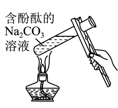 验证温度对水解平衡的影响
5. 四川大学余达刚教授课题组发展了一种镍催化下用CO2制备苯乙酸的反应,反应原理如图所示。下列有关说法正确的是
验证温度对水解平衡的影响
5. 四川大学余达刚教授课题组发展了一种镍催化下用CO2制备苯乙酸的反应,反应原理如图所示。下列有关说法正确的是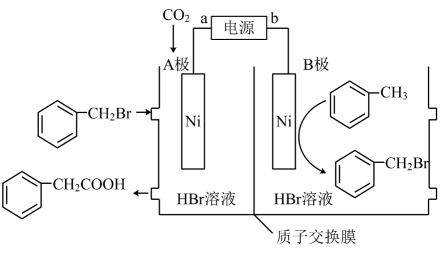 A、H+向B极移动 B、A极的电极反应式为
A、H+向B极移动 B、A极的电极反应式为 C、若使用铅蓄电池作电源,则每生成0.5mol苯乙酸,消耗49gH2SO4
D、该反应的原子利用率为100%,有利于实现碳中和
6. W、X、Y、Z、M、N为六种短周期主族元素。W的核外电子数等于其周期数,X、Y、Z是原子序数依次增大的同周期元素且W2Z是最常用的溶剂。W、X、Y、Z的最外层电子数之和与N的质子数相等。只有M是金属元素。下列说法正确的是A、由W、Y、Z三种元素组成的化合物可能是强电解质 B、氢化物的沸点:Z>N>X C、离子半径:N>M>Z>Y D、W和M形成的化合物溶于水显酸性7. 常温下,向浓度为0.01mol·L-1的H3AsO3溶液中滴加NaOH溶液,溶液中含砷微粒的物质的量分数与溶液pH的关系如图所示。关于该过程的说法错误的是
C、若使用铅蓄电池作电源,则每生成0.5mol苯乙酸,消耗49gH2SO4
D、该反应的原子利用率为100%,有利于实现碳中和
6. W、X、Y、Z、M、N为六种短周期主族元素。W的核外电子数等于其周期数,X、Y、Z是原子序数依次增大的同周期元素且W2Z是最常用的溶剂。W、X、Y、Z的最外层电子数之和与N的质子数相等。只有M是金属元素。下列说法正确的是A、由W、Y、Z三种元素组成的化合物可能是强电解质 B、氢化物的沸点:Z>N>X C、离子半径:N>M>Z>Y D、W和M形成的化合物溶于水显酸性7. 常温下,向浓度为0.01mol·L-1的H3AsO3溶液中滴加NaOH溶液,溶液中含砷微粒的物质的量分数与溶液pH的关系如图所示。关于该过程的说法错误的是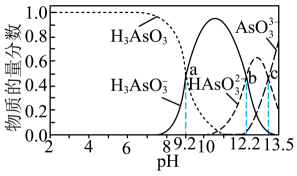 A、pH为7.35~7.45的溶液中含砷元素的主要微粒是H3AsO3 B、Ka1(H3AsO3)的数量级是10-10 C、当pH=13时,溶液中的=-0.8 D、c点,c(Na+)>c()+3c()+2c()
A、pH为7.35~7.45的溶液中含砷元素的主要微粒是H3AsO3 B、Ka1(H3AsO3)的数量级是10-10 C、当pH=13时,溶液中的=-0.8 D、c点,c(Na+)>c()+3c()+2c()二、非选择题
-
8. 锰酸锂(LiMn2O4)是锂电池的正极材料,以软锰矿为原料,生产锰酸锂的流程如下:
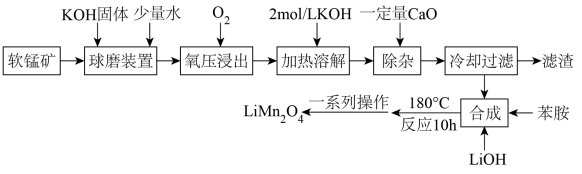
已知:
①软锰矿的成分如下:
成分
MnO2
Fe2O3
CaO
SiO2
其他不反应杂质
质量分数
69.6%
7.6%
5.6%
9.0%
8.2%
②K2MnO4在强碱性溶液(pH大于13.5)中稳定,在酸性、中性和弱碱性环境中会发生歧化反应生成和MnO2。
③苯胺(C6H5NH2)还原性较强,在该条件下可被氧化为硝基苯(C6H5NO2)。
④锰酸锂为灰黑色粉末,离子化合物,易溶于水,难溶于无水乙醇。
(1)、“氧压浸出”的浸出温度为260℃,并维持500r/min的速率搅拌,此时发生的氧化还原反应的化学方程式为。(2)、“加热溶解”和“除杂”时均要严格控制溶液pH的原因是 , “除杂”中加入CaO后,需要适当加热并搅拌的目的是 , 若此时溶液中c()=2.5mol/L,则1m3溶液中理论上需要加入的CaO的质量为kg。(3)、“一系列的操作”是将所得溶液加热浓缩、冷却结晶、过滤、洗涤、干燥,其中洗涤的试剂最好选用____。A、冷水 B、热水 C、95%的乙醇溶液 D、LiOH溶液(4)、纯度的测定:取0.5800g锰酸锂[Mr(LiMn2O4)=181]样品与稀硝酸和双氧水反应,将Mn元素完全转化为Mn2+ , 除去过量的双氧水,调节pH,滴加指示剂,用浓度为0.3000mol/L的EDTA标准溶液滴定,终点时消耗EDTA标准溶液20.00mL(Mn2+与EDTA反应的化学计量数之比为1:1)①若反应时,N元素的化合价不变,则锰酸锂与稀硝酸和双氧水反应的离子方程式为。
②样品中锰酸锂的纯度为%(保留两位有效数字)。
9. 某重金属离子处理剂M(Na2CS3·xH2O)为红色固体,易溶于水,性质与碳酸钠类似,水溶液显碱性,在空气中易被氧化。(1)、Ⅰ.M的制备:步骤一:向三颈烧瓶中加入少量磁力搅拌子,再加入10.00mL(密度为1.26g/mL)CS2。
步骤二:用恒压滴液漏斗向三颈烧瓶中加入50mLl.00mol/L的Na2S溶液,再向球形冷凝管中通入冷水,打开磁力搅拌器和加热装置,控制温度在25℃反应15min,关掉磁力搅拌器和加热装置。待溶液冷却后, (实验操作),得M的溶液,通过处理后得M晶体(Na2CS3·xH2O)。

步骤三:再将温度分别控制在30℃、35℃、40℃、45℃,重复以上操作,可得反应温度对全硫碳酸钠产率的影响如图乙;硫化钠和二硫化碳分别在40℃和45℃反应时,反应时间对全硫碳酸钠产率的影响如图丙。

已知:CS2易燃,有毒,不溶于水,沸点为46℃,能与NaOH溶液反应。
回答下列问题:
步骤一三颈烧瓶中加入的CS2是否过量(填“是”或“否”),发生反应的化学方程式为:。
(2)、该制备过程不能用明火加热的原因是。由图,温度应控制在℃,原因是。(3)、步骤一若三颈烧瓶中忘加磁力搅拌子,正确操作是。步骤三中的实验操作和过滤均用到的玻璃仪器是。(4)、Ⅱ.M的性质探究:M溶液显碱性的原因是(用离子方程式表示)。
(5)、向M溶液中滴加硫酸酸化的K2Cr2O7溶液,溶液中有绿色的Cr3-产生。某同学在所得溶液中加入过量的BaCl2溶液,通过测定产生的白色沉淀的质量来求所用Na2CS3质量,你是否同意他的观点(填“是”或“否”),理由是。10. 工业上常用甲烷和水蒸气催化重整制备H2 , 该工艺同时发生如下反应:反应Ⅰ:CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1
反应Ⅱ:CO(g)+H2O(g)CO2(g)+H2(g) ΔH2
(1)、反应Ⅰ和反应Ⅱ以物质的量分数表示的平衡常数Kx与温度T变化关系如图甲所示,则ΔH1-ΔH20(填“>”“<”或“=”)。 (2)、恒容密闭容器中,按质量比为8:9加入CH4和H2O,下列说法正确的是____。A、达平衡时,CH4和H2O的转化率相等 B、反应Ⅰ在低温时容易自发进行 C、当压强不再发生改变时,反应Ⅰ和反应Ⅱ均达到了平衡 D、单位时间内,若有2molH-O键断裂,同时有3molH-H键断裂,则反应Ⅰ处于平衡状态(3)、某科研小组研究了反应I的动力学,获得其速率方程v正=k正·cm(CH4)·cn(H2O),k正为速率常数(只受温度影响),反应级数是反应的速率方程式中各反应物浓度的指数之和。在某温度下进行实验,测得各组分初始浓度和反应初始速率如下:
(2)、恒容密闭容器中,按质量比为8:9加入CH4和H2O,下列说法正确的是____。A、达平衡时,CH4和H2O的转化率相等 B、反应Ⅰ在低温时容易自发进行 C、当压强不再发生改变时,反应Ⅰ和反应Ⅱ均达到了平衡 D、单位时间内,若有2molH-O键断裂,同时有3molH-H键断裂,则反应Ⅰ处于平衡状态(3)、某科研小组研究了反应I的动力学,获得其速率方程v正=k正·cm(CH4)·cn(H2O),k正为速率常数(只受温度影响),反应级数是反应的速率方程式中各反应物浓度的指数之和。在某温度下进行实验,测得各组分初始浓度和反应初始速率如下:实验序号
1
2
3
CH4浓度/mol·L-1
0.1000
0.2000
0.2000
H2O浓度/mol·L-1
0.1000
0.1000
0.2000
速率/mol·L-1·s-1
3.75×10-4
1.50×10-3
3.00×10-3
若某时刻,测得c(CH4)=0.4000mol·L-1 , c(H2O)=0.4000mol·L-1 , 则此时的反应速率v正=。
(4)、在2.4MPa下,将CH4和H2O(g)按照1:3的比例通入反应器中。平衡时各组分的物质的量分数与温度的关系如图乙所示。
①600℃时,若经过tmin,反应达到平衡。该条件下,反应I的Kp=(MPa)2(列出计算式即可)。
②H2的含量在740℃左右出现峰值的原因为。
(5)、某工厂用电解原理除去H2中的杂质CH4、CO和CO2 , 其装置如图丙所示:
①CH4参与的电极反应为。
②经测定,原料气中各气体的体积分数为:
气体
H2
CH4
CO
CO2
体积分数
82%
3%
5%
10%
若电解过程中消耗了100m3的原料气,则可得到相同条件下纯净H2m3。
11. 科学工作者合成了含镁、镍、碳、氮4种元素的超导材料,具有良好的应用前景。回答下列问题:(1)、下列属于碳原子激发态轨道表示式的有(填字母,下同),其中失去最外层上一个电子所需能量最低的是。 (2)、含有碳元素的有机化合物分布极广,最简单的为碳正离子 , 该离子的几何构型为;乙醇的挥发性比水的强,原因是;如图是叶绿素的结构示意图,配体是一种平面大环有机物,该结构中N原子的杂化方式为 , C-Nσ键有个。
(2)、含有碳元素的有机化合物分布极广,最简单的为碳正离子 , 该离子的几何构型为;乙醇的挥发性比水的强,原因是;如图是叶绿素的结构示意图,配体是一种平面大环有机物,该结构中N原子的杂化方式为 , C-Nσ键有个。 (3)、某种半导体NiO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,半径r(O2-)=anm。
(3)、某种半导体NiO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,半径r(O2-)=anm。
①阿伏加德罗常数的值为NA , 则该晶体密度为g·cm-3.(用含a,NA的表达式表示)。
②NiO晶体中部分O原子被N原子替代后可以改善半导体的性能,Ni-N键中离子键成分的百分数小于Ni-O键,原因是。
③若该晶胞中氧原子有25%被氮原子替代,则该晶体的化学式为;N所替代的O的位置可能是。
12. 有机物G是多种药物和农药的合成中间体,下图是G的一种合成路线: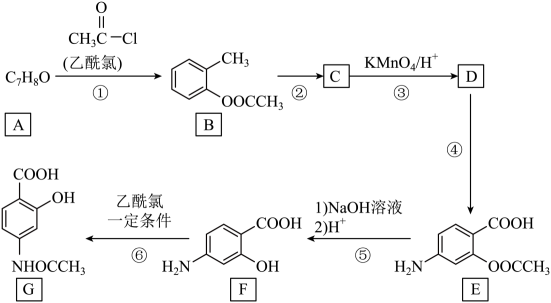
已知:
①
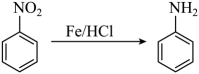 (苯胺,呈碱性,易被氧化)。
(苯胺,呈碱性,易被氧化)。②甲基吡啶(
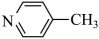 )和苯胺互为同分异构体,并具有芳香性。
)和苯胺互为同分异构体,并具有芳香性。③苯环上有烷烃基时,新引入的取代基连在苯环的邻、对位:苯环上有羧基时,新引入的取代基连在苯环的间位。
回答下列问题:
(1)、A的名称为。(2)、②的化学方程式为 , 反应类型为。(3)、D的结构简式为 , 1molE在反应⑤过程中最多消耗molNaOH。(4)、G的芳香性同系物M的分子式为C11H13O4N,满足下列条件的M有种,写出其中一种同分异构体的结构简式:。①分子结构中含一个六元环,且环上一氯代物只有一种
②1mol该物质与足量NaHCO3反应生成2molCO2
③核磁共振氢谱有4组峰,峰面积之比为6:4:2:1
(5)、根据题中的信息,设计以甲苯为原料合成有机物 的流程图(无机试剂任选)。
的流程图(无机试剂任选)。