陕西省宝鸡市陈仓区2023届高三下学期一模化学试题
试卷更新日期:2023-05-09 类型:高考模拟
一、单选题
-
1. 化学与社会、生产、生活和科技都密切相关。下列有关说法正确的是A、“天宫二号”使用的碳纤维,是一种新型有机高分子材料 B、利用化石燃料燃烧产生的CO2合成聚碳酸酯可降解塑料,有利于实现“碳中和” C、阿司匹林可用于治疗胃酸过多,碘酸钾可用作营养强化剂 D、二氧化氯泡腾片和酒精可杀灭新型冠状病毒,二者消毒时均表现为强氧化性2. 设NA为阿伏加德罗常数的值,下列说法正确的是A、1.0L1mol/LAlCl3溶液中,Al3+的数目为1.0NA B、0.2mol苯含有双键的数目为0.6NA C、电解熔融CuCl2 , 阴极增重3.2g,外电路中通过电子的数目为0.1NA D、标准状况下22.4LSO3的质量为80g3. X、Y、Z为原子序数依次增大的主族元素,Y与Z同主族。W为第四周期元素,最外层电子数为1,价层电子数为11,四种元素组成的某蓝色晶体基本结构单元的结构简式如下图所示。下列说法错误的是
 A、原子半径Z>Y>X B、Y的第一电离能比同周期相邻元素小 C、单质W和Z在加热条件下生成化合物WZ D、Y的简单氢化物的热稳定性强于Z的简单氢化物4. 脱氢醋酸常用于生产食品保鲜剂,脱氢醋酸的制备方法如图。下列说法错误的是
A、原子半径Z>Y>X B、Y的第一电离能比同周期相邻元素小 C、单质W和Z在加热条件下生成化合物WZ D、Y的简单氢化物的热稳定性强于Z的简单氢化物4. 脱氢醋酸常用于生产食品保鲜剂,脱氢醋酸的制备方法如图。下列说法错误的是 A、a分子中所有原子处于同一平面 B、a、 b均能使溴水、酸性KMnO4溶液褪色 C、在一定条件下,a、b均能与H2 , 发生加成反应 D、b与
A、a分子中所有原子处于同一平面 B、a、 b均能使溴水、酸性KMnO4溶液褪色 C、在一定条件下,a、b均能与H2 , 发生加成反应 D、b与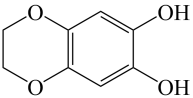 互为同分异构体
5. 遇会生成蓝色沉淀,因此常用于的检验。文献显示:具有氧化性,可以氧化;还原性Fe大于。
互为同分异构体
5. 遇会生成蓝色沉淀,因此常用于的检验。文献显示:具有氧化性,可以氧化;还原性Fe大于。某科研小组探究Fe与能否直接反应的实验如下:
实验1:取加热至沸腾并快速冷却的溶液(加热、冷却过程中溶液颜色无变化)于试管中,并加入1mL的苯,再加入铁粉,长时间无蓝色沉淀出现。
实验2:在“实验1”中,若使用砂纸打磨过的铁粉,一会儿就出现蓝色沉淀。
实验3:在“实验1”中,若加少量NaCl,立即出现蓝色沉淀;若换成加入或;则不出现蓝色沉淀。
实验4:在“实验1”中,若将铁粉换成在稀硫酸中反应一段时间的铁片,立即出现蓝色沉淀。
下列说法错误的是
A、实验1中长时间无蓝色沉淀出现,可能是因为铁粉表面有氧化膜 B、可能起破坏铁粉表面氧化膜的作用 C、Fe与可以直接反应 D、在Fe、C、NaCl溶液组成的原电池中,通过直接滴加溶液至电解质溶液中的方法,可以检验是否发生原电池反应6. 下列方案设计、现象和结论都正确的是选项
目的
方案设计
现象和结论
A
探究温度对化学平衡的影响
将2mL0.5mol/L的CuCl2溶液加热后置于冷水中,观察现象
若溶液由黄绿色变为蓝绿色,说明降低温度,[Cu(H2O)4]2++4Cl-[CuCl4]2-+4H2O向逆方向移动
B
检验食品脱氧剂中还原铁粉是否已变质
取脱氧剂包装内固体粉末于试管中,加足量稀盐酸溶解,充分反应后滴加KSCN溶液,振荡,观察溶液颜色变化
若溶液未变红色,说明脱氧剂中还原铁粉没有变质
C
比较CH3COO-和ClO-水解程度大小
用pH试纸分别测定同浓度CH3COONa和NaClO溶液的pH
若测得CH3COONa溶液pH大,说明CH3COO-水解程度大于ClO-
D
探究电石与水的反应
将电石与饱和食盐水反应产生的气体通入酸性高锰酸钾溶液,观察现象
若酸性高锰酸钾溶液褪色,说明电石与水反应生成了乙炔
A、A B、B C、C D、D7. 化学上常用表示溶液中的。时,用的溶液滴定的溶液(),滴定过程中与所加溶液的体积()的关系如图所示(忽略体积变化),下列说法错误的是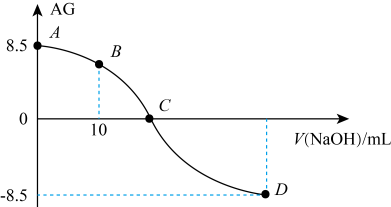 A、点溶液的 , 从点到点的过程中,水的电离程度先变大再变小 B、点溶液中存在: C、点加入溶液的体积小于 , 溶质为和 D、点加入溶液的体积小于
A、点溶液的 , 从点到点的过程中,水的电离程度先变大再变小 B、点溶液中存在: C、点加入溶液的体积小于 , 溶质为和 D、点加入溶液的体积小于二、非选择题
-
8. 五氧化二钒(V2O5)在冶金、化工等领域有重要应用。实验室以含钒废料(含V2O3、FeO、CuO、MnO、SiO2、Al2O3、有机物)为原料制备V2O5的一种流程如图:
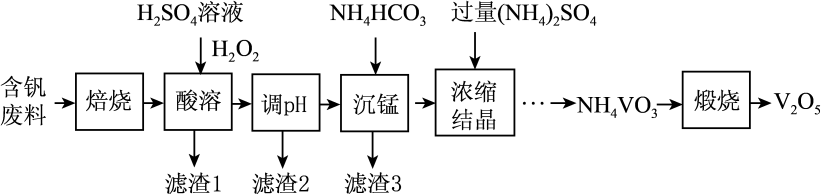
已知:25℃时,难溶电解质的溶度积常数如表所示:
难溶电解质
Cu(OH)2
Mn(OH)2
Al(OH)3
Ksp
2.2×10−20
4×10−14
1.9×10−33
(1)、“焙烧”的目的是。(2)、酸溶时加入H2O2的目的是。(3)、常温下,若“调pH”为7,Cu2+是否能沉淀完全:(填“是”或“否”)(溶液中离子浓度小于10−5 mol∙L−1时,认为该离子沉淀完全)。(4)、“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为。(5)、结晶所得的NH4VO3需进行水洗、干燥。证明NH4VO3已洗涤干净的实验操作及现象为。(6)、在煅烧NH4VO3生成的V2O5过程中,固体残留率=×100%随温度变化的曲线如图所示。其分解过程中,A点失去的物质是(填写化学式)。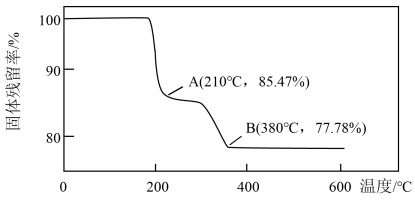 (7)、为测定该产品的纯度,兴趣小组同学准确称取V2O5产品2.000g,加入过量稀硫酸使其完全反应,生成(VO2)2SO4 , 并配成100mL溶液。取10.00mL溶液用0.1000 mol∙L−1的H2C2O4标准溶液滴定,滴定到终点时消耗标准液10.00mL。已知滴定过程中H2C2O4被氧化为CO2 , VO黄色(被还原为VO2+蓝色),该反应的离子方程式:;该产品的纯度为。9. 硫酸铅(PbSO4),制造铅蓄电池的一种原料;以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,可实现铅的再生利用。(1)、铅蓄电池中需要配制5.3 mol∙L−1的H2SO4溶液,需要的仪器有玻璃棒、(从下列图中选择,写出名称)。
(7)、为测定该产品的纯度,兴趣小组同学准确称取V2O5产品2.000g,加入过量稀硫酸使其完全反应,生成(VO2)2SO4 , 并配成100mL溶液。取10.00mL溶液用0.1000 mol∙L−1的H2C2O4标准溶液滴定,滴定到终点时消耗标准液10.00mL。已知滴定过程中H2C2O4被氧化为CO2 , VO黄色(被还原为VO2+蓝色),该反应的离子方程式:;该产品的纯度为。9. 硫酸铅(PbSO4),制造铅蓄电池的一种原料;以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,可实现铅的再生利用。(1)、铅蓄电池中需要配制5.3 mol∙L−1的H2SO4溶液,需要的仪器有玻璃棒、(从下列图中选择,写出名称)。 (2)、工业上以PbS为原料可以制取PbSO4 , 80℃时浸取,将PbS与盐酸、MnO2和饱和食盐水一起浸取,PbS反应后生成和S。
(2)、工业上以PbS为原料可以制取PbSO4 , 80℃时浸取,将PbS与盐酸、MnO2和饱和食盐水一起浸取,PbS反应后生成和S。①写出PbS反应的离子方程式:。
②浸取时应控制盐酸的浓度。其他条件一定,若盐酸浓度过大,铅元素的浸出率反而下降,原因是。
(3)、用废旧铅酸电池中的含铅废料,制备高纯PbO,实现铅的再生利用的过程中,
过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++PbO2+4H++=2Fe3++PbSO4+2H2O
ii:2Fe3++Pb+=2Fe2++PbSO4
下列实验方案可证实上述催化过程。请将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2 , 溶液变红。
b.。
(4)、已知:Ksp(PbCO3)=1.5×10−13 , Ksp(PbSO4)=1.8×10−8.在某制备过程中,经检测,过滤出的PbCO3沉淀中混有PbSO4 , 则该滤液中=。(5)、以铅蓄电池为电源,电解二氧化碳酸性溶液可制得丙烯(如图)。
①Y极与电源(填“正极”或“负极”)相连。
②该离子交换膜为膜。
③X极的电极反应式为。
10. 基于载氮体的碳基化学链合成氨技术示意图如下。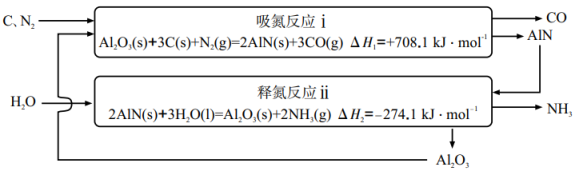 (1)、总反应 。(2)、有利于提高反应ⅰ平衡转化率的条件为____(填标号)。A、高温高压 B、高温低压 C、低温高压 D、低温低压(3)、在温度t、100kPa条件下进行反应ⅰ,平衡时若氮气转化率为50%,则压强为 , 平衡常数(以分压表示,分压=总压×物质的量分数)。(4)、60℃、100kPa条件下,反应ⅰ中溶液pH随时间变化如图,120min~180min持续收集到氨气,但溶液pH几乎不变的原因是。
(1)、总反应 。(2)、有利于提高反应ⅰ平衡转化率的条件为____(填标号)。A、高温高压 B、高温低压 C、低温高压 D、低温低压(3)、在温度t、100kPa条件下进行反应ⅰ,平衡时若氮气转化率为50%,则压强为 , 平衡常数(以分压表示,分压=总压×物质的量分数)。(4)、60℃、100kPa条件下,反应ⅰ中溶液pH随时间变化如图,120min~180min持续收集到氨气,但溶液pH几乎不变的原因是。 (5)、为探究反应ⅱ中15min时反应速率突然加快的原因,我国科学家利用计算机模拟了反应ⅱ的反应路径。
(5)、为探究反应ⅱ中15min时反应速率突然加快的原因,我国科学家利用计算机模拟了反应ⅱ的反应路径。
①比较不同路径,路径1能垒较低的原因是的键能大于的键能。
②15min时反应速率突然加快的原因是。
(6)、相较于哈伯法合成氨,碳基化学链合成氨的优势有能够降低能耗、减少原料成本。(写出一条即可)。11.(1)、I.2022年4月,大型运输机运−20向塞尔维亚远程运送“常规军事物资”,展示了大国重器“鲲鹏”的突出性能,为世人瞩目。运−20的外壳大量使用了AM系列Mg−Al−Mn,铝的价电子排布图为 , 第一电离能铝(填“大于”、“等于”或“小于”)镁,镁原子核外有种不同运动状态的电子。
(2)、为了减轻飞机的起飞重量并保持机身强度,运-20使用了大量的树脂材料,其中一种树脂材料的部分结构如图1所示,其中碳原子的杂化方式为 , 其个数比为。 (3)、Ⅱ.大型飞机的高推重比发动机被誉为航空工业皇冠上的“宝石”,采用大量的金属钨作为耐高温耐磨损材料。
(3)、Ⅱ.大型飞机的高推重比发动机被誉为航空工业皇冠上的“宝石”,采用大量的金属钨作为耐高温耐磨损材料。钨元素位于第六周期第VIB族,价电子排布的能级与Cr相同,但排布方式与Cr有所不同,请写出钨原子的价层电子排布式。
(4)、图2为碳和钨形成的一种化合物的晶胞模型,碳原子和钨原子个数比为 , 其中一个钨原子周围距离最近且相等的碳原子有个。 (5)、已知该晶胞边长为acm,高为hcm,NA为阿伏加德罗常数。摩尔质量为M g∙mol−1。该晶体密度为 g∙cm−3。12. 化合物G是一种抗骨质疏松药,俗称依普黄酮。以甲苯为原料合成该化合钧的路线如下:
(5)、已知该晶胞边长为acm,高为hcm,NA为阿伏加德罗常数。摩尔质量为M g∙mol−1。该晶体密度为 g∙cm−3。12. 化合物G是一种抗骨质疏松药,俗称依普黄酮。以甲苯为原料合成该化合钧的路线如下:
已知:

回答下列问题:
(1)、反应①的条件为 , 反应⑤的反应类型为。(2)、用系统命名法给 命名。 (3)、E中含氧官能团的名称为 , 向F中加入浓溴水,1molF最多可以与molBr2反应。(4)、H的结构简式为。(5)、已知N为催化剂,E和M反应生成F和另一种有机物X,写出E→F反应的化学万程式:。(6)、D有多种同分异构体,写出同时满足下列条件的所有同分异构体:。
命名。 (3)、E中含氧官能团的名称为 , 向F中加入浓溴水,1molF最多可以与molBr2反应。(4)、H的结构简式为。(5)、已知N为催化剂,E和M反应生成F和另一种有机物X,写出E→F反应的化学万程式:。(6)、D有多种同分异构体,写出同时满足下列条件的所有同分异构体:。a.含苯环的单环化合物;
b.苯环上只有一个取代基;
c.核磁共振氢谱有四组峰,且峰面积之比为3:2:2:1。