山西省运城市2023届高三下学期第二次模拟调研测试理综化学试题
试卷更新日期:2023-05-09 类型:高考模拟
一、单选题
-
1. 化学与生产、生活密切相关。下列说法错误的是A、长时间高温蒸煮可杀死“甲流”病毒 B、可用氢氟酸溶蚀玻璃生产磨砂玻璃 C、5G、6G技术离不开制备光缆的晶体硅 D、石灰石是制造玻璃和水泥的主要原料之一2. 下列有关物质结构与性质的比较正确的是A、基态原子未成对电子数:Cr> Mn> As B、酸性:CH3COOH>CH2ClCOOH>CH2FCOOH C、键角:SeO3< < D、沸点:AsH3> PH3>NH33. 有机物M(结构简式为(
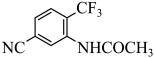 )是合成花椒毒素的重要中间体,下列说法错误的是 A、电负性:F>O>N>C B、第一电离能:N>O>C C、M中碳原子的杂化方式有2种 D、M可以形成分子间氢键4. 由主族元素X、Y、Z、W组成的化合物ZX4W(YX4)3具有良好的储氢性能,其中,X、Y、Z是短周期元素, 与均为10电子数微粒,四种元素的原子序数之和为33。下列有关说法错误的是A、X与Y、Z均可形成多种化合物 B、非金属性:Z> Y> >X C、X、W元素可形成离子化合物 D、原子半径:W> Y> Z> >X5. 吲哚衍生物具有广泛又重要的生物活性。现有甲、乙两种吲哚衍生物,二者之间可相互转化,其结构简式如图所示:
)是合成花椒毒素的重要中间体,下列说法错误的是 A、电负性:F>O>N>C B、第一电离能:N>O>C C、M中碳原子的杂化方式有2种 D、M可以形成分子间氢键4. 由主族元素X、Y、Z、W组成的化合物ZX4W(YX4)3具有良好的储氢性能,其中,X、Y、Z是短周期元素, 与均为10电子数微粒,四种元素的原子序数之和为33。下列有关说法错误的是A、X与Y、Z均可形成多种化合物 B、非金属性:Z> Y> >X C、X、W元素可形成离子化合物 D、原子半径:W> Y> Z> >X5. 吲哚衍生物具有广泛又重要的生物活性。现有甲、乙两种吲哚衍生物,二者之间可相互转化,其结构简式如图所示: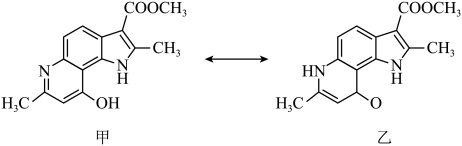
下列关于甲,乙的说法正确的是
A、甲、乙的化学式不相同 B、甲、乙中所含有官能团种类相同 C、甲、乙在酸碱溶液均能稳定存在 D、甲、乙均能与H2发生加成反应6. 我国科研人员利用双极膜技术构造出一类具有高能量密度、优异的循环性能的新型水系电池,模拟装置如图所示。已知电极材料分别为Zn和MnO2 , 相应的产物为和Mn2+。下列说法错误的是 A、双极膜中的OH-通过膜a移向M极 B、电池工作一段时间后,NaOH溶液的pH不变 C、N电极的反应式为MnO2 +4H+ +2e- =Mn2+ +2H2O D、若电路中通过2 mol e- , 则稀硫酸溶液质量增加89 g7. 室温下,向10 mL0.1 mol·L-1 K2A(室温下,H2A的Ka1=1.64×10-3)溶液中滴加0.1 mol·L-1的HCl溶液,混合溶液的pH与所加HCl溶液体积的关系如图所示。下列说法正确的是
A、双极膜中的OH-通过膜a移向M极 B、电池工作一段时间后,NaOH溶液的pH不变 C、N电极的反应式为MnO2 +4H+ +2e- =Mn2+ +2H2O D、若电路中通过2 mol e- , 则稀硫酸溶液质量增加89 g7. 室温下,向10 mL0.1 mol·L-1 K2A(室温下,H2A的Ka1=1.64×10-3)溶液中滴加0.1 mol·L-1的HCl溶液,混合溶液的pH与所加HCl溶液体积的关系如图所示。下列说法正确的是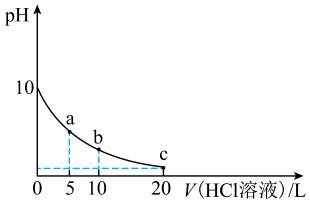 A、室温下,H2A的Ka2≈2.0 ×10-6 B、b点溶液存在关系式:c(K+)=c(Cl-)+c(HA- )+2c(A2- ) C、a、b、c点溶液中水的电离程度:a<b<c D、a、b、c三点溶液均存在关系式:2[c(H2A)+c(HA- )+c(A2-)]=c(K+ )
A、室温下,H2A的Ka2≈2.0 ×10-6 B、b点溶液存在关系式:c(K+)=c(Cl-)+c(HA- )+2c(A2- ) C、a、b、c点溶液中水的电离程度:a<b<c D、a、b、c三点溶液均存在关系式:2[c(H2A)+c(HA- )+c(A2-)]=c(K+ )二、非选择题
-
8. 工厂的含砷废水必须经过一定的处理。 某厂用某含砷废水(含HAsO2、H2SO4、及少量Fe3+、Cu2+、Bi2+ )提取三氧化二砷(俗称砒霜,分子式:As2O3)的流程如下:
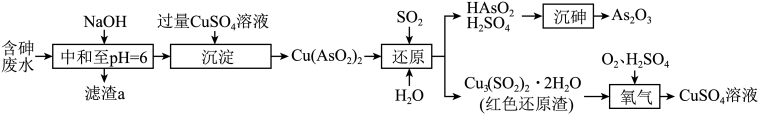
已知:Ksp[Fe(OH)3]=2.8 ×10-3920 ,Ksp[Cu(OH)2]=2.2 ×10-22 , Ksp [Bi(OH)3]=4.4 ×10-31。
回答下列问题:
(1)、滤渣a的成分是(写化学式)。(2)、“沉淀”时,CuSO4溶液必须过量的原因是。(3)、写出“还原”时Cu(AsO2)2与H2O、SO2发生反应的化学方程式:。(4)、红色还原渣(不溶于水)“氧化”时反应的离子方程式为。(5)、“沉砷”后废水中残留的砷可用PFS(聚铁)进一步去除,用石灰乳调节废水的pH值,通入空气,PFS用量[以表示]、终点pH值与砷去除率的关系如图所示。PFS除砷的最佳条件是。 (6)、 当废水中砷质量浓度为5.0g·L-1时,若实验取75 L含砷废水,制得475.2 gAs2O3 , 则As元的素回收率为。(7)、砷化镓(GaAs)为第三代半导体,其立方晶胞结构如图所示。已知晶胞参数为a nm,阿伏加德罗常数值为NA , 则砷化镓晶体密度为g· cm-3。
(6)、 当废水中砷质量浓度为5.0g·L-1时,若实验取75 L含砷废水,制得475.2 gAs2O3 , 则As元的素回收率为。(7)、砷化镓(GaAs)为第三代半导体,其立方晶胞结构如图所示。已知晶胞参数为a nm,阿伏加德罗常数值为NA , 则砷化镓晶体密度为g· cm-3。 9. 为探究某铁硫簇化合物(用FexSy表示)的组成,某化学兴趣小组设计了如图所示的实验装置测定样品中铁、硫的含量:
9. 为探究某铁硫簇化合物(用FexSy表示)的组成,某化学兴趣小组设计了如图所示的实验装置测定样品中铁、硫的含量: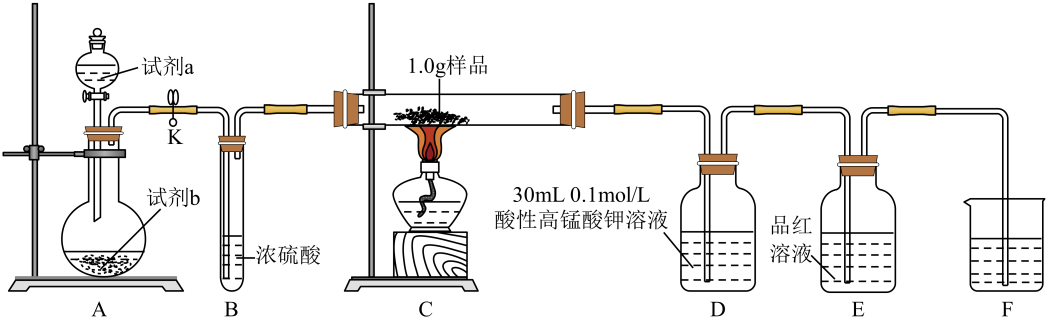
已知: i.样品的主要成分为FexSy , 含少量不溶于水、盐酸,且不参与装置C中反应的杂质;
ii. Mn2+在稀溶液中近乎无色。
实验步骤:
①按图连接装置,进行气密性检查,然后装入相应的药品;
②通入氧气并加热,装置C中固体逐渐转变为红棕色;
③待固体完全转化后,取装置D中的溶液6 mL于锥形瓶中,用0.1 mol·L-1的H2C2O4(草酸)溶液滴定。滴定共进行3次,平均消耗草酸溶液5.0 mL(假设装置D中溶液体积反应前后不变);
④取装置C中的残留固体于烧杯中,加入稀盐酸,充分搅拌后过滤;
⑤向滤液中加入足量氢氧化钠溶液,出现沉淀。过滤后取滤渣灼烧,得0.32 g固体。
回答下列问题:
(1)、A为O2发生装置,则试剂a、试剂b可以分别是。(2)、装置E中品红溶液的作用是。(3)、写出草酸溶液滴定酸性高锰酸钾溶液时反应的离子方程式:。(→ Mn2+)。(4)、为防止尾气污染,装置F中应加入的试剂是 , 步骤⑤中灼烧滤渣应在进行(填仪器名称)。(5)、若实验完成时装置E中品红溶液无变化,根据上述实验所得数据,可确定该铁硫簇化合物的化学式为 , 写出该铁硫簇化合物与O2反应的化学方程式:。(6)、下列操作,可能导致x:y的值偏小的是(填字母)。a.步骤⑤灼烧滤渣不够充分
b.配制草酸标准液时,定容操作俯视刻度线
c.滴定时,草酸溶液不小心滴到锥形瓶外几滴
d.放出草酸的滴定管尖嘴部分滴定前无气泡,滴定终点时有气泡
10. 加深对含氮氧化物的研究,有利于为环境污染提供有效决策。回答下列问题:(1)、已知:2NO(g) +O2(g)2NO2(g) ΔH1=-114 kJ·mol-1;C(s)+O2(g)CO2(g) ΔH2= - 393.5 kJ·mol-1;
2NO(g)N2(g)+O2(g) ΔH3=-181 kJ·mol -1。
C(s)与NO2(g)反应生成N2(g)和CO2(g)的热化学方程式为;关于该可逆反应,改变下列条件,一段时间后,正反应速率增大的是 (填字母)。
A.恒温下,缩小反应容器体积
B.恒容下,降低反应温度
C.恒温恒容下,通入一定量的N2
D.恒温恒容下,将CO2移出容器
(2)、T ℃时,存在如下平衡:2NO2(g)N2O4(g)。该反应正、逆反应速率与NO2、N2O4的浓度关系为:v正= k正c2 (NO2),v逆=k逆c(N2O4) (k正、k逆为速率常数,仅与温度有关),且lg v正~lg c(NO2)与lg v逆~lg c(N2O4)的关系如图所示。
①表示v正的直线是 (填“A”或“B")。
②T ℃时,该反应的平衡常数K=。
③T ℃时,向刚性容器中充入一定量NO2 , 平衡后测得c(NO2)为0.1 mol·L-1 , 平衡时NO2的转化率为(保留一位小数)。平衡后v逆=(用含a的表达式表示)。
④上题③中的反应达到平衡后,其他条件不变,继续通定量入一的NO2 , NO2的平衡浓度将 (填“增大”“减小”或“不变”)。
(3)、为减少汽车尾气中NOx的排放,某研究小组在实验室以耐高温催化剂催化NO转化为N2 , 测得NO转化为N2的转化率随温度变化情况如图所示。结合(1)中的反应,若不使用CO,温度超过775K,发现NO转化为N2的转化率降低,其可能的原因是;用平衡移动原理解释加入CO后,NO转化为N2的转化率增大的原因:。 11. 辣椒素酯具有抗氧化、抗炎和抗肿瘤等功效,其一种合成路线如下:
11. 辣椒素酯具有抗氧化、抗炎和抗肿瘤等功效,其一种合成路线如下: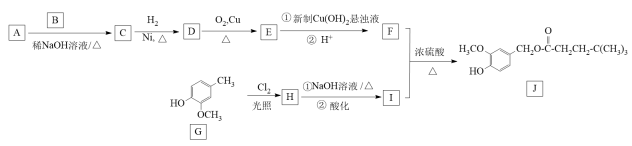
已知: I. A分子中含有两种不同环境的氢,且个数之比为9:1;
Ⅱ.
 ,其中R1、R2为氢或烃基。
,其中R1、R2为氢或烃基。 回答下列问题:
(1)、G中官能团的名称为。(2)、C→D、G→H的反应类型分别为、。(3)、B的结构简式为。(4)、写出E→F第1步反应的化学方程式:。(5)、1 mol J在氢氧化钠溶液中水解最多消耗mol NaOH。(6)、I的同分异构体中符合下列条件的有种(不考虑立体异构) ,其中核磁共振氢谱中有四组峰的有机物的结构简式为(任写一种)。①含有苯环; ②只含一种含氧官能团; ③1 mol该有机物可与3 mol NaOH反应。