山东省聊城市2023届高三下学期第二次模拟考试化学试题
试卷更新日期:2023-05-09 类型:高考模拟
一、选择题
-
1. 古代典籍富载化学知识,下述之物见其还原性者为A、石胆(CuSO4•5H2O):“石胆能化铁为铜。” B、强水(HNO3):“性最烈,能蚀五金,……” C、矶(FeSO4•7H2O):“盖此矶色绿味酸,烧之则赤。” D、金箔(Au):“凡金箔,每金七厘造方寸金一千片,……”2. 下列有关物质性质的应用正确的是A、SO2具有还原性,可用作纸浆漂白 B、生石灰能与水反应,可用来干燥氯气 C、氢氧化铝受热分解,可用作中和过多的胃酸 D、聚四氟乙烯耐酸碱腐蚀,可用作化工反应器的内壁涂层3. 短周期元素X、Y、Z、W原子序数依次增大,基态X、Z、W原子均有两个单电子,W与Z同主族。下列说法错误的是A、第一电离能:Y>Z B、简单离子还原性:W>Z C、氧化物对应水化物的酸性:Y>W D、X、Y的氢化物分子中均可能存在非极性键4. 化合物P具有抗肿瘤活性,结构简式如图,下列有关P的说法错误的是
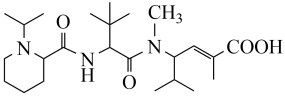 A、存在顺反异构 B、可发生取代反应、氧化反应、消去反应 C、与酸或碱溶液反应均可生成盐 D、水解后可得到三种有机物5. 植物对氮元素的吸收过程如下,下列说法错误的是A、NH3中的键角小于中的键角 B、、中N的杂化方式不同 C、P原子间难形成三键而N原子间可以,是因为P的原子半径大于N,难形成P-Pπ键 D、当有9.2g生成时,过程②转移的电子为1.2mol6. 利用下列装置(夹持装置略)进行实验,能达到实验目的的是
A、存在顺反异构 B、可发生取代反应、氧化反应、消去反应 C、与酸或碱溶液反应均可生成盐 D、水解后可得到三种有机物5. 植物对氮元素的吸收过程如下,下列说法错误的是A、NH3中的键角小于中的键角 B、、中N的杂化方式不同 C、P原子间难形成三键而N原子间可以,是因为P的原子半径大于N,难形成P-Pπ键 D、当有9.2g生成时,过程②转移的电子为1.2mol6. 利用下列装置(夹持装置略)进行实验,能达到实验目的的是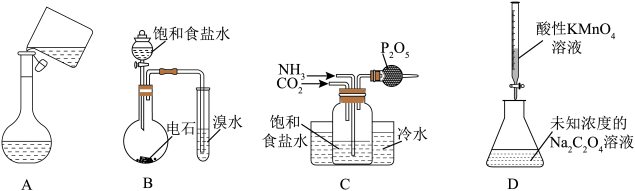 A、溶液的转移 B、验证乙炔使溴水褪色 C、制备碳酸氢钠 D、测定Na2C2O4溶液的浓度7. 化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:
A、溶液的转移 B、验证乙炔使溴水褪色 C、制备碳酸氢钠 D、测定Na2C2O4溶液的浓度7. 化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:
下列说法错误的是
A、Z的分子式为C13H16O5 B、X分子中共平面的碳原子最多有8个 C、Y与足量H2加成后的产物分子中含有4个手性碳原子 D、1molZ可与3molNaOH反应,生成1molH2O8. 已知Zn及其化合物的性质与Al及其化合物的性质相似。实验室利用废旧镀锌铁皮(Fe元素的质量分数为z)制备磁性Fe3O4胶体粒子的过程为:①碱溶:取xg镀锌铁皮于烧杯中,加入足量NaOH溶液,加热、过滤、水洗;②酸溶、氧化:向所得不溶物中加入稀硫酸,调节溶液pH始终保持在1〜2之间并加入NaClO溶液;③碱溶、分离:再向溶液中滴加NaOH溶液并加热,同时向溶液中持续通入N2 , 充分反应,分离得到ygFe3O4胶体粒子,下列说法正确的是A、①中“过滤”所得的滤液中含有Zn2+ B、②中“氧化”时加入的NaClO要过量 C、③中“分离”操作中包括过滤 D、Fe3O4胶体粒子的产率为9. 实验室制备丙炔酸甲酯( , 沸点为103〜105℃)的流程如下,下列说法错误的是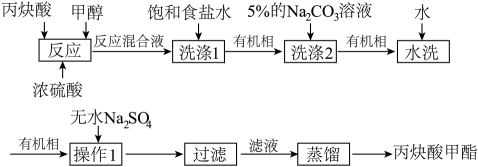 A、“蒸馏”时不能用水浴加热 B、“操作1”名称为干燥 C、“洗涤2”中5%Na2CO3溶液的作用是除去丙快酸等酸性物质 D、“反应”前加入试剂的顺序为浓硫酸、丙焕酸、甲醇10. 铜催化乙炔选择性氢化制1,3-丁二烯的反应机理如图所示(吸附在铜催化剂表面上的物种用*标注)。
A、“蒸馏”时不能用水浴加热 B、“操作1”名称为干燥 C、“洗涤2”中5%Na2CO3溶液的作用是除去丙快酸等酸性物质 D、“反应”前加入试剂的顺序为浓硫酸、丙焕酸、甲醇10. 铜催化乙炔选择性氢化制1,3-丁二烯的反应机理如图所示(吸附在铜催化剂表面上的物种用*标注)。
下列说法正确的是
A、反应Ⅰ的速率大于反应Ⅱ的速率 B、若原料用丙炔,则会有2种分子式为C6H10的有机物生成 C、增大Cu的表面积,可加快反应速率,提高C2H2的平衡转化率 D、转化成C4H6(g)过程中,有非极性键的断裂和形成11. 下列操作不能达到实验目的的是目的
操作
A
验证淀粉未水解
向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,观察颜色变化。
B
验证结合H+的能力比强
室温下,用pH试纸测得:0.1mol/LNa2SO3溶液的pH约为10;0.1mol/LNaHSO3溶液的pH约为5.
C
探究维生素C的还原性
向盛有2mL黄色FeCl3溶液的试管中滴加浓的维生素C溶液,观察颜色变化。
D
研究温度对化学平衡的影响
将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温,观察颜色变化。
A、A B、B C、C D、D12. ClO2是一种高效、低毒的消毒剂。实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,制备ClO2的流程如图: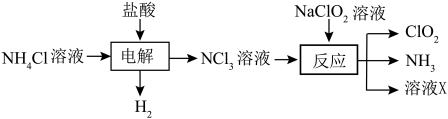
已知:①电解过程中氯元素被氧化。
②ClO2是一种黄绿色易溶于水的气体;三氯化氮为黄色油状液体,熔点较低,很不稳定,受热90℃以上或受震动时发生猛烈爆炸。下列说法正确的是
A、“电解”过程中的阳极电极反应式为 B、“反应”过程中可快速搅拌反应混合液以加快反应速率 C、“反应”过程中的还原产物存在于溶液X中 D、可用稀盐酸除去ClO2中的氨气13. 利用氢氧燃料电池可实现由白磷电解法制备Li[P(CN)2],并能实现H2的循环利用,其工作原理如图所示。(已知:Me为甲基;电极均为石墨电极)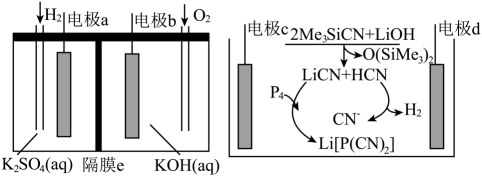
下列说法正确的是
A、电池工作时电极a连接电极d B、当生成9gLi[P(CN)2]时,电极a消耗H2的体积(标准状况)为2.24L C、通电一段时间后,若隔膜e为阴离子交换膜,则c(KOH)减小 D、电极c的电极方程式为14. 天然溶洞的形成与岩石中的CaCO3和空气中CO2溶于天然水体形成的含碳物种的浓度有密切关系。常温下,某溶洞水体中pM随pH的变化关系如图所示。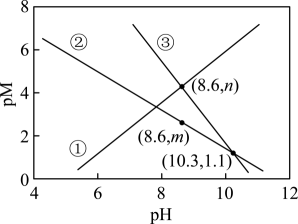
[已知:; , M为或]下列说法正确的是
A、曲线③代表与pH的关系 B、的数量级为10-4 C、 D、pH由4到8的过程中增大的比快15. LiFePO4的晶胞如图所示,其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构,电池充电时,LiFePO4脱出部分Li+ , 形成Li1-xFePO4晶胞。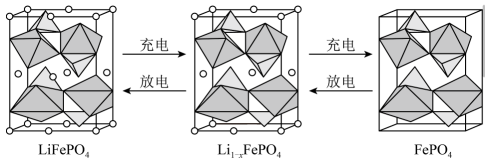
下列说法正确的是
A、每个LiFePO4晶胞中含有4个O原子 B、Li1-xFePO4晶胞中, C、每个LiFePO4晶胞完全转化为FePO4晶胞时,转移电子数为1 D、1molLi1-xFePO4全转化为LiFePO4时,消耗xmolFe3+二、非选择题
-
16. 金属及其化合物在化工、医药、材料等领域有着广泛的应用。请回答下列问题:(1)、与Fe最外层电子数相同且同周期的过渡元素有种。(2)、次磷酸的正盐KH2PO2中P的杂化轨道与O的轨道形成键。(3)、Zn、Fe、Cu等过渡金属的原子或离子易通过配位键形成配合物或配离子。
①
 和
和 中所有原子均共面,其中氮原子较易形成配位键的是。
中所有原子均共面,其中氮原子较易形成配位键的是。②配位原子提供孤电子对的能力与元素的电负性大小有关,元素电负性越大,其原子越不容易提供孤电子对。则对于配合物Fe(SCN)3 , 配体SCN-中提供孤电子对的原子是(填元素符号)。
③将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是。
A.[Cu(NH3)2]Cl B.[Cu(NH3)4]SO4
C.[Zn(NH3)4]SO4 D.[Cr(H2O)5Cl]Cl2
(4)、硫化锌(ZnS)晶体属于六方晶系,Zn原子位于4个S原子形成的正四面体空隙中。晶胞参数如图所示α=120°,β=γ=90°。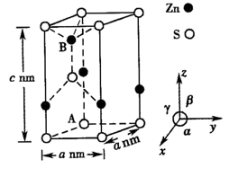
①该晶体中,锌的配位数为。
②已知空间利用率 , 设锌和硫的原子半径分别r1cm和r2cm,则该晶体的空间利用率为(列出计算式即可)。
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。若A点原子的分数坐标为(0,0,0),则B点原子的分数坐标为。
17. 一种利用废催化剂(含TiO2 , WO3等)回收金属Ti、W的工艺流程如图所示。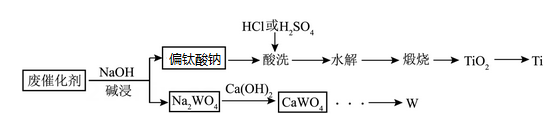
已知:①偏钛酸钠(Na2TiO3)难溶于水;“酸洗”时,Na2TiO3转化为TiOCl2或TiOSO4 , 水解后得到H2TiO3;
②当溶液中某离子浓度≤1×10-5mol/L时,认为该离子沉淀完全。
请回答下列问题:
(1)、为加快“碱浸”的速率,可采取的措施为(任写两条);“碱浸”时生成偏钛酸钠的离子方程式为。(2)、锐钛型和金红石型是TiO2最常见的两种晶体类型,煅烧H2TiO3过程中,TiO2会发生“锐钛型→金红石型”转化,固体质量残留率和晶型转化率随温度变化如图1所示,晶型转化过程中的能量变化如图2所示。设计用“过滤”所得Na2TiO3制备金红石型TiO2的操作方案。 (3)、“煅烧”时,TiO2的提取率随时间、温度的变化关系如图,提取TiO2的适宜条件为。
(3)、“煅烧”时,TiO2的提取率随时间、温度的变化关系如图,提取TiO2的适宜条件为。 (4)、用固体二氧化钛生产海绵钛的装置如图,其原理是TiO2的氧解离进入熔融盐中而得到金属海绵钛。电解过程中,b极是极,阴极的电极反应式为。
(4)、用固体二氧化钛生产海绵钛的装置如图,其原理是TiO2的氧解离进入熔融盐中而得到金属海绵钛。电解过程中,b极是极,阴极的电极反应式为。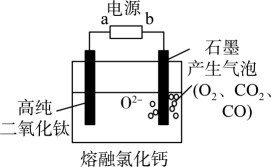 (5)、将氢氧化钙加入钨酸钠溶液中可得到钙酸钙,已知Ksp(CaWO4)=4×10-10(mol/L)2 , Ksp[Ca(OH)2]=9×10-7(mol/L)3 , 当溶液中沉淀完全时,溶液中c(OH-)最大值为mol/L。18. 氧钒(Ⅳ)碱式碳酸铵晶体{(NH4)5[CVO)6(CO3)4(OH)9]•10H2O}是制备多种含钒产品和催化剂的基础原料和前驱体。
(5)、将氢氧化钙加入钨酸钠溶液中可得到钙酸钙,已知Ksp(CaWO4)=4×10-10(mol/L)2 , Ksp[Ca(OH)2]=9×10-7(mol/L)3 , 当溶液中沉淀完全时,溶液中c(OH-)最大值为mol/L。18. 氧钒(Ⅳ)碱式碳酸铵晶体{(NH4)5[CVO)6(CO3)4(OH)9]•10H2O}是制备多种含钒产品和催化剂的基础原料和前驱体。已知:①氧钒(Ⅳ)碱式碳酸铵晶体呈紫红色,难溶于水和乙醇;
②VO2+有较强还原性,易被氧化。
实验室以V2O5为原料制备该晶体的流程如图:
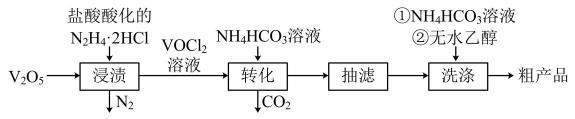
请回答下列问题:
(1)、“浸渍”时反应的化学方程式为。(2)、“转化”时需要在CO2氛围中进行的原因是。(3)、“转化”可在下图装置中进行:
①上述装置连接的合理顺序为e→(按气流方向,用小写字母表示)。
②写出装置D中生成氧钮(Ⅳ)碱式碳酸铵晶体的化学方程式。
(4)、“抽滤”装置如图所示,抽滤原理是。 (5)、“洗涤”时用饱和NH4HCO3溶液洗涤晶体,检验晶体已洗涤干净的操作是。(6)、为测定粗产品中钒元素的含量,称取l.0g粗产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后加入0.01mol/LKMnO4溶液至稍过量,充分反应后继续滴加2%的NaNO2溶液至稍过量,再用尿素除去过量的NaNO2 , 滴入几滴铁氰化钾K3[Fe(CN)6]溶液,最后用0.2mol/L(NH4)2Fe(SO4)2标准溶液滴定,滴定终点消耗标准溶液的体积为20.00mL。(已知粗产品中杂质不含钒,也不参与反应;滴定反应为)
(5)、“洗涤”时用饱和NH4HCO3溶液洗涤晶体,检验晶体已洗涤干净的操作是。(6)、为测定粗产品中钒元素的含量,称取l.0g粗产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后加入0.01mol/LKMnO4溶液至稍过量,充分反应后继续滴加2%的NaNO2溶液至稍过量,再用尿素除去过量的NaNO2 , 滴入几滴铁氰化钾K3[Fe(CN)6]溶液,最后用0.2mol/L(NH4)2Fe(SO4)2标准溶液滴定,滴定终点消耗标准溶液的体积为20.00mL。(已知粗产品中杂质不含钒,也不参与反应;滴定反应为)①滴定终点时的现象为。
②粗产品中钒元素的质量分数为%。
19. 某研究小组采用如下路线合成医药中间体K。
已知:Ⅰ.

Ⅱ.


Ⅲ.

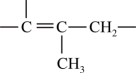 (1)、A的化学名称为 , C的结构简式为。(2)、流程中设计E→F的目的是。(3)、I→K的反应类型为 , I生成K的同时还会生成一种与K互为同分异构体的副产物X,X的结构简式为。(4)、请写出一种同时满足下列条件的B的同分异构体的结构简式:。
(1)、A的化学名称为 , C的结构简式为。(2)、流程中设计E→F的目的是。(3)、I→K的反应类型为 , I生成K的同时还会生成一种与K互为同分异构体的副产物X,X的结构简式为。(4)、请写出一种同时满足下列条件的B的同分异构体的结构简式:。①仅含-CHO、-OH、-C3H7和苯环结构;
②核磁共振氢谱峰面积之比为1:1:2:2:6.
(5)、综合上述信息,请写出以苯、对甲基苯甲酸,CH3CH2CH2MgBr为原料制备 的合成路线。 20. 甲醇是重要的化工原料,研究甲醇的制备及用途在工业上有重要的意义(1)、一种重要的工业制备甲醇的反应为
的合成路线。 20. 甲醇是重要的化工原料,研究甲醇的制备及用途在工业上有重要的意义(1)、一种重要的工业制备甲醇的反应为① H
② H1=+40.9kJ/mol
③ H2=-90.4kJ/mol
试计算HkJ/mol。
(2)、对于反应 , v正=k正·p(CO2)·p3(H2),v逆=k逆·p(CH3OH)·p(H2)。其中k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,分别按初始投料比n(CO2):n(H2)=3:1,n(CO2):n(H2)=1:l、n(CO2):n(H2)=1:3进行反应,测得H2的平衡转化率随压强变化的关系如图所示:
①投料比n(CO2):n(H2)=l:3的曲线是。(填“a”、“b”或“c”)
②已知点N在曲线b上,计算该温度下压强平衡常数Kp=(MPa)-2.(用平衡分压代替平衡浓度计算)
③该温度下,测得某时刻p(CO2)=0.2MPa,p(CH3OH)=p(H2O)=0.1MPa,p(H2)=0.4MPa,此时v正:v逆=。(保留2位有效数字)
(3)、甲醇催化制取丙烯的反应为:。已知Arrhenius经验公式为(其中Ea为活化能,k为速率常数,R和C为常数)。该反应的Arrhenius经验公式的实验数据如图所示:
①该反应的活化能Ea=kJ/mol。
②当用更高效催化剂时,请在图中画出Rlnk与关系的曲线。
(4)、目前世界上一半以上的乙酸都采用甲醇与CO反应来制备: H<0。在恒压密闭容器中通入一定量的CH3OH和CO气体,测得甲醇的转化率随温度变化关系如图所示:
①温度为T1时,该反应的正反应速率v(B)正v(A)逆(填“>”,“=”或“<”)。
②B、C、D三点逆反应速率由大到小的顺序为。[用“v(D)”、“v(C)”、“v(B)”表示]