河北省张家口市2022-2023学年高三第二次模拟考试化学试卷
试卷更新日期:2023-05-09 类型:高考模拟
一、单选题
-
1. “胡服骑射”是我国古代史上的一次大变革,被历代史学家传为佳话。下列说法正确的是A、汉服和胡服的主要成分均为天然有机高分子 B、竹制或木制长弓是利用了竹或木的柔韧性和延展性 C、“胡服骑射”是通过改进物质的化学性质,从而增强物质性能 D、弓箭上的箭羽为鹰或鹅的羽毛,其主要成分为纤维素2. 近年来,中国制造的诸多铬基超耐热合金,铝合金基碳化硅等新型材料为我国航天事业的发展提供助力。下列说法错误的是A、基态Cr原子未成对电子数是基态Al原子的6倍 B、铝合金的硬度、密度等均小于铝单质 C、与Al同周期且第一电离能小于Al的只有一种元素 D、碳化硅的熔点低于金刚石3. 劳动开创未来。下列劳动项目与所述的化学知识有关联的是
选项
劳动项目
化学知识
A
工厂用铁罐车运输浓硫酸
浓硫酸很难电离出H+ , 与铁不反应
B
将铁闸门与直流电源的负极相连
利用牺牲阳极法保护铁闸门不被腐蚀
C
陶瓷表面上釉
隔绝空气,防止陶瓷被氧化
D
消防演练用泡沫灭火器灭火
Al3+与发生了双水解反应
A、A B、B C、C D、D4. 某催化固氮机理如图所示。下列说法正确的是 A、固氮过程是将气态含氮物质转化为固态含氮物质 B、整个过程中涉及到非极性键的断裂和形成 C、三步反应均为氧化还原反应 D、步骤Ⅲ可能为ΔH>0,ΔS<0的反应5. 用粒子轰击可得到一个中子和一种放射性核素 , 即。已知基态X原子中s能级电子总数是p能级电子总数的4倍。下列说法错误的是A、b=13 B、最高价含氧酸的酸性:X<Y C、XF3与YF3中X与Y的杂化方式相同 D、单质的沸点:X>Y6. 羟基茜草素具有止血、化瘀、通经络等功效,其结构简式如图。下列关于羟基茜草素说法错误的是
A、固氮过程是将气态含氮物质转化为固态含氮物质 B、整个过程中涉及到非极性键的断裂和形成 C、三步反应均为氧化还原反应 D、步骤Ⅲ可能为ΔH>0,ΔS<0的反应5. 用粒子轰击可得到一个中子和一种放射性核素 , 即。已知基态X原子中s能级电子总数是p能级电子总数的4倍。下列说法错误的是A、b=13 B、最高价含氧酸的酸性:X<Y C、XF3与YF3中X与Y的杂化方式相同 D、单质的沸点:X>Y6. 羟基茜草素具有止血、化瘀、通经络等功效,其结构简式如图。下列关于羟基茜草素说法错误的是 A、能发生氧化反应和消去反应 B、分子中所有原子可能共平面 C、苯环上的氢原子被4个氯原子取代的结构有5种 D、1mol羟基茜草素最多能与8molH2发生加成反应7. 设NA为阿伏加德罗常数的值,下列说法错误的是A、标准状况下,2.24L丙烯中含有的σ键数目为0.8NA B、6.0gSiO2与足量HF溶液充分反应,生成SiF4的数目为0.1NA C、1.2gNaHSO4晶体中含有的数目为0.01NA D、5.6gFe与3.55g氯气充分反应后转移的电子数目为0.1NA8. 用下列实验装置进行相应实验,其中装置正确且能达到实验目的的是
A、能发生氧化反应和消去反应 B、分子中所有原子可能共平面 C、苯环上的氢原子被4个氯原子取代的结构有5种 D、1mol羟基茜草素最多能与8molH2发生加成反应7. 设NA为阿伏加德罗常数的值,下列说法错误的是A、标准状况下,2.24L丙烯中含有的σ键数目为0.8NA B、6.0gSiO2与足量HF溶液充分反应,生成SiF4的数目为0.1NA C、1.2gNaHSO4晶体中含有的数目为0.01NA D、5.6gFe与3.55g氯气充分反应后转移的电子数目为0.1NA8. 用下列实验装置进行相应实验,其中装置正确且能达到实验目的的是



A.制取并收集SO2
B.制取氢氧化铁胶体
C.制取无水
D.制取乙烯
A、A B、B C、C D、D9. NH3和N2H4是氮的两种常见氢化物。下列说法错误的是A、两种氢化物均能形成分子间氢键 B、两种氢化物溶于水后均能形成配位键 C、NH3的VSEPR模型为三角锥形 D、N2H4中既含极性键又含非极性键10. X、Y、Z、W为原子序数依次增大的前四周期元素,X与Y能形成多种常见二元化合物,Y与Z形成的某化合物是参与光合作用的主要气体,基态原子中X,Y、Z的价电子数之和等于W的价电子数。下列说法正确的是A、W属于d区元素 B、原子半径:X<Y<Z C、氢化物沸点:Y<Z D、基态原子的最外层电子数:X=W11. 下列实验操作和现象可得出相应正确结论的是选项
实验操作
现象
结论
A
向淀粉溶液中加入稀硫酸,加热,一段时间后,冷却,加入NaOH溶液调至碱性,再加入新制的 , 加热
出现砖红色沉淀
淀粉已完全水解
B
加淀粉KBr溶液中通入足量氯气,再滴加淀粉KI溶液
溶液先变为橙色,后变为蓝色
氧化性:
C
向等浓度的NaCl和溶液中滴加少量溶液
出现白色沉淀(铬酸银为深红色沉淀)
D
向溶液中滴加溶液,再加入少量铜粉
开始时无明显变化,加入铜粉后产生蓝色沉淀
氧化性:
A、A B、B C、C D、D12. 我国在H2和CO合成的研究中取得重大突破。向某密闭容器中,按物质的量为2:1的比例充入H2和CO,发生反应:。测得不同压强下的平衡体积分数随温度变化关系如图所示,下列说法错误的是 A、 B、该反应的焓变ΔH>0 C、N点时对应该反应的 D、M、N两点使用不同催化剂时,正反应速率可能相等13. 的水溶液呈碱性,其电离方程式可表示为 , 。常温下。用的水溶液滴定盐酸,滴定过程中三种含氮微粒的物质的量分布分数与溶液pH的关系如图所示,下列说法错误的是
A、 B、该反应的焓变ΔH>0 C、N点时对应该反应的 D、M、N两点使用不同催化剂时,正反应速率可能相等13. 的水溶液呈碱性,其电离方程式可表示为 , 。常温下。用的水溶液滴定盐酸,滴定过程中三种含氮微粒的物质的量分布分数与溶液pH的关系如图所示,下列说法错误的是 A、曲线I代表的微粒是 B、pH=7时, C、 D、b点时溶液中存在:14. 我国新能源汽车上有望推广钠离子电池,一种钠离子电池工作示意图如下,充电时Na+经电解液嵌入石墨(C6),下列说法错误的是
A、曲线I代表的微粒是 B、pH=7时, C、 D、b点时溶液中存在:14. 我国新能源汽车上有望推广钠离子电池,一种钠离子电池工作示意图如下,充电时Na+经电解液嵌入石墨(C6),下列说法错误的是 A、放电时,电势:电极a>电极b B、放电时,电子从电极b经外电路流向电极a,再经电解液流回电极b C、放电过程中,导线上每通过1mole- , 负极质量减少23g D、充电时,电极a上发生反应的电极反应式为
A、放电时,电势:电极a>电极b B、放电时,电子从电极b经外电路流向电极a,再经电解液流回电极b C、放电过程中,导线上每通过1mole- , 负极质量减少23g D、充电时,电极a上发生反应的电极反应式为二、非选择题
-
15. 对硝基苯甲酸(
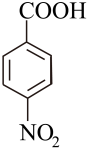 )常用于合成叶酸,可用 , 在酸性条件下氧化对硝基甲苯(
)常用于合成叶酸,可用 , 在酸性条件下氧化对硝基甲苯( )制得,反应原理为
)制得,反应原理为
 (未配平)。
(未配平)。所用实验装置如图(略去加热、夹持装置和部分仪器)。

操作步骤:
①向250mL的三口烧瓶中依次加入2.0550g对硝基甲苯,6.0g粉末及15mL水,在搅拌下滴入10mL浓硫酸(过量),并用冷水冷却;
②加热回流0.5h;
③待反应物冷却后,搅拌下加入40mL冰水,析出沉淀,抽滤;
④将③所得固体放入20mL5%硫酸溶液中,沸水浴上加热10min,冷却后抽滤并洗涤;
⑤将④所得固体溶于10mL5%NaOH溶液中,50℃温热后抽滤,在滤液中加入1g活性炭,煮沸,趁热抽滤;
⑥充分搅拌下将⑤所得滤液慢慢加入盛有60mL15%硫酸溶液的烧杯中,经“一系列操作”得产品,称重为2.0g。
部分物质的用量及物理常数如表:
药品名称
颜色状态
相对分子质量
熔点(℃)
沸点(℃)
水溶解性
对硝基甲醛
淡黄色晶体
137
51.3
237.7
不溶
重铬酸钾
橘红色结晶体粉末
294
398
500
易溶
对硝基苯甲酸
黄白色晶体
167
242
难溶
回答下列问题:
(1)、配平化学方程式, ++
++ ++H2O+Cr2(SO4)3. (2)、仪器a的名称为操作②中,仪器a上可能会有淡黄色晶体析出,该晶体的主要成分为(填化学名称),析出的原因是。(3)、操作⑤中,若温度过高可能产生的不良后果是。(4)、操作⑥将滤液和硫酸混合后,观察到的现象为 , “一系列操作”为。(5)、本实验中对硝基苯甲酸的产率为(保留两位有效数字)。16. 碲在冶金工业中用途广泛。某精炼铜的阳极泥经过处理后的主要成分为Cu2Te、TeO2、CuO等,从中回收碲和胆矾的工艺如下:
++H2O+Cr2(SO4)3. (2)、仪器a的名称为操作②中,仪器a上可能会有淡黄色晶体析出,该晶体的主要成分为(填化学名称),析出的原因是。(3)、操作⑤中,若温度过高可能产生的不良后果是。(4)、操作⑥将滤液和硫酸混合后,观察到的现象为 , “一系列操作”为。(5)、本实验中对硝基苯甲酸的产率为(保留两位有效数字)。16. 碲在冶金工业中用途广泛。某精炼铜的阳极泥经过处理后的主要成分为Cu2Te、TeO2、CuO等,从中回收碲和胆矾的工艺如下:
已知:①高温焙烧后的产物为TeO2和Cu2O;
②Cu2O在酸性条件下会发生歧化反应;
③Te元素在酸化和碱浸后分别转化为TeOSO4和Na2TeO3两种易溶于水的盐。
回答下列问题:
(1)、“高温焙烧”时,Cu2Te发生反应的化学方程式为;从结构的角度分析此时产物是Cu2O而不是CuO的原因为。(2)、“酸化”时需要加入一定量的H2O2 , 其目的为。(3)、“还原”时发生反应的离子方程式为。(4)、胆矾中存在的化学键有(填标号)。a.离子键 b.配位键 c.氢键 d.σ键
(5)、“电解”制Te的原理如图。其中N与电源的(填“正极”或“负极”)相连;与M相连的惰性电极上的电极反应式为。 (6)、Cu2Te的立方晶胞结构如图。其中Te的配位数为;已知晶胞参数为apm,NA为阿伏加德罗常数的值,则该晶体的密度为g·cm-3(列出计算式即可)。
(6)、Cu2Te的立方晶胞结构如图。其中Te的配位数为;已知晶胞参数为apm,NA为阿伏加德罗常数的值,则该晶体的密度为g·cm-3(列出计算式即可)。 17. 1-氯丙烷是一种重要的有机合成中间体,在一定温度下可以转化为2-氯丙烷,其转化原理如下:
17. 1-氯丙烷是一种重要的有机合成中间体,在一定温度下可以转化为2-氯丙烷,其转化原理如下:i.

 (g) ΔH1=-271.96kJ·mol-1
(g) ΔH1=-271.96kJ·mol-1ⅱ.

 (g) ΔH2=-267.80kJ·mol-1
(g) ΔH2=-267.80kJ·mol-1回答下列问题:
(1)、1-氯丙烷转化为2-氯丙烷的热化学方程式为。(2)、在恒温恒压条件下,将丙烯和HCl按起始投料n(丙烯):n(HCl)=1:2匀速通过装有等量相同催化剂的反应器,测得不同温度下丙烯和HCl的转化率如图(忽略温度对催化剂的影响);
①表示HCl转化率的曲线为(填“L1”或“L2”),理由为。
②T1温度下丙烯转化率最高的原因为。
③已知T2温度下,平衡时2-氯丙烷的体积分数为10%,则1-氯丙烷的体积分数为(保留两位有效数字,下同);反应i的平衡常数 [对于反应 , , x为物质的量分数]。
(3)、向恒温恒容密闭容器中充入一定量的1-氯丙烷,只发生1氯丙烷转化为2-氯丙烷的反应。保持温度不变,向平衡体系中再充入一定量的1-氯丙烷,再次平衡后,1氯丙烷的体积分数(填“增大”“减小”或“不变”),原因为。18. M是合成某增强免疫功效药物的中间体,其一种合成路线如下:
已知:

 。
。回答下列问题:
(1)、A的化学名称为;C中所含官能团的名称为。(2)、B→C和F→G的反应类型分别为、。(3)、化合物D的结构简式为。(4)、A→B反应的化学方程式为。(5)、满足下列条件的C的同分异构体有种(不包含立体异构),其中核磁共振氢谱显示有四组峰的结构简式为(任写一种)。i.能与NaHCO3溶液反应生成CO2﹔
ⅱ.能发生银镜反应。
(6)、参考以上合成路线及反应条件,写出以 为原料制备
为原料制备 的合成路线:其他无机试剂任选)。
的合成路线:其他无机试剂任选)。