河北省邯郸市2023届高三二模化学试题
试卷更新日期:2023-05-09 类型:高考模拟
一、单选题
-
1. 2022年中国空间站全面建成,标注着中国航天的崭新高度。下列说法错误的是A、用于“天和”核心舱推进系统的氮化硼陶瓷是新型无机非金属材料 B、空间站搭载的太阳能电池板的核心材料是二氧化硅 C、载人舱所用钛合金的性能可以通过改变合金元素的种类、含量加以调节 D、航天服使用的尼龙、氯丁橡胶、聚酯纤维均为有机高分子材料2. 邯郸市曲周县某公司利用天然植物提取分离产业化技术生产叶黄素,创造了产销量世界第一的佳绩。叶黄素结构简式如图所示。下列说法错误的是
 A、叶黄素能发生加成反应、氧化反应、取代反应 B、叶黄素含有3个手性碳原子,存在立体异构体 C、叶黄素中所有的碳原子可能共平面 D、叶黄素是天然色素,可用作食品添加剂3. 河北邯郸后百家北墓地出土文物2400余件,其中有大量青铜器、陶器、玉石器等,为研究工作提供了珍贵的考古资料。下列有关说法正确的是A、青铜器中的锡会加速铜的腐蚀 B、利用X射线、红外光谱检测等方法鉴定文物 C、测定出土文物中的的含量来确定遗址的年代 D、古人曾用反应炼铜,反应中只作还原剂4. 表示阿伏加德罗常数的值,下列叙述正确的是A、一定条件下,5.6 g Fe与足量S反应,转移个电子 B、常温下,溶液中阴离子总数等于 C、电解精炼铜时每转移个电子,阳极质量一定减少32 g D、常温常压下,6 g 晶体中所含硅氧键数目为5. 下列变化对应的离子(或化学)方程式正确的是A、苯酚钠溶液中通入 , 出现白色浑浊:
A、叶黄素能发生加成反应、氧化反应、取代反应 B、叶黄素含有3个手性碳原子,存在立体异构体 C、叶黄素中所有的碳原子可能共平面 D、叶黄素是天然色素,可用作食品添加剂3. 河北邯郸后百家北墓地出土文物2400余件,其中有大量青铜器、陶器、玉石器等,为研究工作提供了珍贵的考古资料。下列有关说法正确的是A、青铜器中的锡会加速铜的腐蚀 B、利用X射线、红外光谱检测等方法鉴定文物 C、测定出土文物中的的含量来确定遗址的年代 D、古人曾用反应炼铜,反应中只作还原剂4. 表示阿伏加德罗常数的值,下列叙述正确的是A、一定条件下,5.6 g Fe与足量S反应,转移个电子 B、常温下,溶液中阴离子总数等于 C、电解精炼铜时每转移个电子,阳极质量一定减少32 g D、常温常压下,6 g 晶体中所含硅氧键数目为5. 下列变化对应的离子(或化学)方程式正确的是A、苯酚钠溶液中通入 , 出现白色浑浊: B、用漂白粉溶液脱除废气中的少量:
C、溶于过量的氢碘酸溶液中:
D、用溶液处理锅炉水垢中的:
6. 下列实验装置合理且能达到实验目的的是
B、用漂白粉溶液脱除废气中的少量:
C、溶于过量的氢碘酸溶液中:
D、用溶液处理锅炉水垢中的:
6. 下列实验装置合理且能达到实验目的的是 A、用甲装置制备 B、用乙装置鉴别和 C、用丙装置制备氢氧化铁胶体 D、用装置丁制取乙酸乙酯7. 咔唑(
A、用甲装置制备 B、用乙装置鉴别和 C、用丙装置制备氢氧化铁胶体 D、用装置丁制取乙酸乙酯7. 咔唑( )是一种新型有机液体储氢介质。下列说法正确的是 A、电负性 B、同周期元素中第一电离能小于N的有4种 C、咔唑的沸点比
)是一种新型有机液体储氢介质。下列说法正确的是 A、电负性 B、同周期元素中第一电离能小于N的有4种 C、咔唑的沸点比 的沸点高
D、基态氮原子的外围电子轨道表示式不能写为
的沸点高
D、基态氮原子的外围电子轨道表示式不能写为 , 因为违背了泡利不相容原理
8. 液流电池储能寿命长、安全性高,是大规模高效储能首选技术之一、全钒液流电池、铁铬液流电池是使用规模较大的两种液流电池,它们的装置如图所示。已知铁铬液流电池中甲池电解质溶液为、乙池电解质溶液为;氧化性:。下列说法错误的是
, 因为违背了泡利不相容原理
8. 液流电池储能寿命长、安全性高,是大规模高效储能首选技术之一、全钒液流电池、铁铬液流电池是使用规模较大的两种液流电池,它们的装置如图所示。已知铁铬液流电池中甲池电解质溶液为、乙池电解质溶液为;氧化性:。下列说法错误的是 A、铁铬液流电池充电时,a电极与电源正极相连,b电极与电源负极相连 B、铁铬液流电池放电时,乙池的电极反应式为 C、全钒液流电池中,A、B、C、D分别为、、、 D、放电时,电路中通过电子,理论上,有个由乙池经质子交换膜移向甲池9. 某盐用作一种新型电池的电解质,能有效提高电池性能,其结构如图所示。R、X、Y、Z、W为原子序数依次增大的五种短周期元素,W是电负性最强的元素,的电子对数与非空原子轨道数相等。下列说法错误的是
A、铁铬液流电池充电时,a电极与电源正极相连,b电极与电源负极相连 B、铁铬液流电池放电时,乙池的电极反应式为 C、全钒液流电池中,A、B、C、D分别为、、、 D、放电时,电路中通过电子,理论上,有个由乙池经质子交换膜移向甲池9. 某盐用作一种新型电池的电解质,能有效提高电池性能,其结构如图所示。R、X、Y、Z、W为原子序数依次增大的五种短周期元素,W是电负性最强的元素,的电子对数与非空原子轨道数相等。下列说法错误的是 A、Y是形成化合物种类最多的元素 B、R、X、Y、Z、W的最高化合价依次增大 C、Z、W简单氢化物的熔、沸点比同主族其他元素氢化物的熔、沸点高 D、该盐的阴离子中存在配位键10. 钼酸钠是一种白色结晶性粉末,广泛应用于颜料和化工等领域。工业上用钼精矿(主要成分是 , 含少量的)制备钼酸钠晶体()的简化流程如图所示。下列说法错误的是
A、Y是形成化合物种类最多的元素 B、R、X、Y、Z、W的最高化合价依次增大 C、Z、W简单氢化物的熔、沸点比同主族其他元素氢化物的熔、沸点高 D、该盐的阴离子中存在配位键10. 钼酸钠是一种白色结晶性粉末,广泛应用于颜料和化工等领域。工业上用钼精矿(主要成分是 , 含少量的)制备钼酸钠晶体()的简化流程如图所示。下列说法错误的是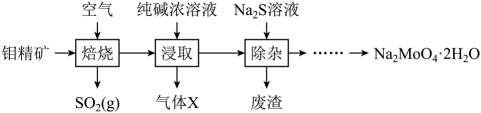
已知:浸取液溶质主要为和。
A、焙烧时发生反应 B、气体X为 , 废渣的主要成分为 C、从滤液中获得的操作为蒸发结晶 D、利用纯碱吸收 , 可获得副产品亚硫酸钠11. 布洛芬具有抗炎、镇痛、解热作用,但口服该药对胃、肠道有刺激性,可以对该分子进行如图所示修饰。下列说法错误的是 A、布洛芬是苯甲酸的同系物 B、该修饰过程原子利用率小于100% C、X分子中的碳原子有、两种杂化形式 D、X分子中有10种化学环境不同的氢原子12. 磷青铜是铜与锡、磷的合金,质地坚硬,主要用作耐磨零件和弹性元件。某立方磷青铜晶胞结构如图所示,晶胞参数为(表示阿伏加德罗常数的值)。下列说法正确的是
A、布洛芬是苯甲酸的同系物 B、该修饰过程原子利用率小于100% C、X分子中的碳原子有、两种杂化形式 D、X分子中有10种化学环境不同的氢原子12. 磷青铜是铜与锡、磷的合金,质地坚硬,主要用作耐磨零件和弹性元件。某立方磷青铜晶胞结构如图所示,晶胞参数为(表示阿伏加德罗常数的值)。下列说法正确的是 A、的外围电子排布式为 B、Ni在元素周期表中位于ds区,属于过渡元素 C、该晶体中,距离Sn原子最近的Cu原子有8个 D、该晶体密度计算式为13. 某酸溶液中含X粒子的物质的量分数与pH的关系如图所示。下列说法正确的是
A、的外围电子排布式为 B、Ni在元素周期表中位于ds区,属于过渡元素 C、该晶体中,距离Sn原子最近的Cu原子有8个 D、该晶体密度计算式为13. 某酸溶液中含X粒子的物质的量分数与pH的关系如图所示。下列说法正确的是 A、已知亚磷酸的结构为
A、已知亚磷酸的结构为 ,则X可能为P
B、在溶液中滴加少量溶液,发生反应的离子方程式为
C、溶液中有
D、溶液中有
14. 工业上用和合成甲醇涉及以下反应:
,则X可能为P
B、在溶液中滴加少量溶液,发生反应的离子方程式为
C、溶液中有
D、溶液中有
14. 工业上用和合成甲醇涉及以下反应:
I.II.
在催化剂作用下,将和的混合气体充入一恒容密闭容器中进行反应,达到平衡时,的转化率和容器中混合气体的平均相对分子质量随温度变化如图。下列判断合理的是

已知:平衡时甲醇的选择性为生成甲醇消耗的在总消耗量中占比。
A、 , B、250℃前以反应Ⅱ为主 C、 , 平衡时甲醇的选择性为60% D、为同时提高的平衡转化率和平衡时甲醇的选择性,应选择的反应条件为高温、高压二、非选择题
-
15. 某化学兴趣小组利用如图所示实验装置(夹持及加热装置省略)在实验室制备并测定其纯度。

回答下列问题:
(1)、与分液漏斗相比,使用滴液漏斗a的优点是。(2)、装置B中发生反应的离子方程式为。(3)、若装置B温度控制不当会有生成,且反应生成的、的物质的量均为 , 则消耗的的物质的量为mol。(4)、某同学认为该装置设计有缺陷,改进措施为 , 否则会使产率偏低。(5)、测定所得样品的纯度:该小组同学认为可以利用一定质量样品与过量在酸性条件下发生反应,再以淀粉溶液为指示剂,用标准溶液滴定产生的测定样品的纯度。①预设滴定终点时溶液的颜色为。
②在接近滴定终点时,使用“半滴操作”可提高测定的准确度,其操作方法是将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,(请在横线上补全操作),继续摇动锥形瓶,观察溶液颜色变化。
③在方案可行性分析时,实验发现在溶液和稀硫酸的混合溶液中加入溶液,最终得到了无色溶液而没有得到预设中的碘溶液,可能的原因是。
④有同学提出可以使用质量分析法测定样品的纯度:称量样品mg、ng,混合加热至质量不再改变,剩余固体质量为pg,则样品中的纯度为(用含m、n、p的代数式表达)。
16. 三氯苯达唑是一种新型咪唑类驱虫药,其合成路线之一如下:
回答下列问题:
(1)、A的名称为。(2)、A→B的反应方程式为。(3)、X的结构简式为。(4)、D→E的反应类型为。(5)、C的芳香族同分异构体中,与C具有相同官能团的有种。(6)、为(填“极性”或“非极性”)分子,分子的空间结构为。(7)、邻苯二胺是染料、农药、助剂、感光材料等的中间体。以溴苯为原料,根据上述合成路线,设计合成邻苯二胺的路线(无机试剂及两个碳以下的有机试剂任选)。17. Be被主要用于原子能反应堆材料、宇航工程材料等,有“超级金属、尖端金属、空间金属”之称。硫酸法是现代工业用绿柱石(主要成分为 , 还含有铁等杂质)生产氧化铍的方法之一,其简化的工艺流程如下:
已知几种金属阳离子的氢氧化物沉淀时的pH如下表:
金属阳离子
开始沉淀时pH
1.5
3.3
6.5
5.2
沉淀完全时pH
3.7
5.0
9.7
—
(1)、步骤②中还可以采取什么措施提高反应速率(除粉碎外,任写一点)。(2)、滤渣1成分的化学式为。(3)、步骤③中加入的目的是。(4)、步骤④不宜使用溶液来沉淀 , 原因是(用必要的文字和离子方程式说明);已知 , 则沉淀完全时,溶液中(通常认为溶液中离子浓度小于时为沉淀完全)。(5)、绿柱石因含有不同杂质而产生不同的颜色。各种绿柱石中最名贵的是祖母绿,这是由铬、钒元素的存在造成的。①基态的最高能层中成对电子与未成对电子的数目之比为。
②重铬酸铵常用作有机合成催化剂,的结构如图。中键数目为。
 18. 2023年全国政府工作报告指出,推动重点领域节能降碳减污。一种太空生命保障系统利用电解水供氧,生成的氢气与宇航员呼出的二氧化碳在催化剂作用下生成水和甲烷,水可循环使用。(1)、已知与的燃烧热分别为 , , , 写出与反应生成和的热化学方程式。(2)、一定温度下,在恒容密闭容器中与反应生成和。
18. 2023年全国政府工作报告指出,推动重点领域节能降碳减污。一种太空生命保障系统利用电解水供氧,生成的氢气与宇航员呼出的二氧化碳在催化剂作用下生成水和甲烷,水可循环使用。(1)、已知与的燃烧热分别为 , , , 写出与反应生成和的热化学方程式。(2)、一定温度下,在恒容密闭容器中与反应生成和。①能说明该反应达到平衡状态的是(填字母)。
A. B.容器内压强一定 C.气体平均相对分子质量一定
D.气体密度一定 E.的体积分数一定
②已知容器的容积为5 L,初始加入和 , 反应平衡后测得的转化率为50%,则该反应的平衡常数为。
③温度不变,再加入、、、各 , 则(填“>”“<”或“=”)。
(3)、工业上在一定条件下利用与可直接合成有机中间体二甲醚:。当时,实验测得的平衡转化率随温度及压强变化如图所示。
①该反应的(填“>”或“<”)0。
②图中压强(p)由大到小的顺序是。
(4)、科学家研发出一种新系统,通过“溶解”水中的二氧化碳,以触发电化学反应,有效减少碳的排放,其工作原理如图所示。
①系统工作时,a极为极,b极区的电极反应式为。
②系统工作时b极区有少量固体析出,可能的原因是。