安徽省黄山市2023年高三下学期第二次质量检测理科综合化学试题
试卷更新日期:2023-05-09 类型:高考模拟
一、单选题
-
1. 化学推动着社会的进步和人类的发展,下列有关说法错误的是A、火箭表面涂层的成分为石墨烯,该成分是一种烯烃 B、ClO2是国际上公认的安全、无毒的绿色消毒剂,可代替氯气用于自来水消毒 C、月球上插着一面用芳纶纤维特制的五星红旗,芳纶纤维属于有机高分子材料 D、液晶显示器是一种采用液晶为材料的显示器,液晶是介于液态和晶态之间的物质状态2. 奥司他韦是目前治疗流感的最常用药物之一,其结构简式如图所示。下列有关该化合物的说法错误的是
 A、分子中既含有σ键,又含有π键 B、该物质可以使溴的四氯化碳溶液褪色 C、1mol该物质可以与3molH2发生加成反应 D、分子中有2种官能团可以发生水解反应3. 下列化学反应对应的离子方程式表示正确的是A、向NH4Al(SO4)2中滴加Ba(OH)2使恰好完全沉淀:Al3++2+2Ba2++4OH-=+2H2O+2BaSO4↓ B、向新制氯水中加入少量CaCO3:2Cl2+H2O+CaCO3=Ca2++2Cl-+CO2↑+2HClO C、向NaHS溶液中滴加少量的CuSO4溶液:Cu2++HS-=CuS↓+H+ D、Fe3O4溶于HI溶液:Fe3O4+8H+=Fe2++2Fe3++4H2O4. “化学多米诺实验”即只需控制第一个反应,利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生。如图是一个“化学多米诺实验”。
A、分子中既含有σ键,又含有π键 B、该物质可以使溴的四氯化碳溶液褪色 C、1mol该物质可以与3molH2发生加成反应 D、分子中有2种官能团可以发生水解反应3. 下列化学反应对应的离子方程式表示正确的是A、向NH4Al(SO4)2中滴加Ba(OH)2使恰好完全沉淀:Al3++2+2Ba2++4OH-=+2H2O+2BaSO4↓ B、向新制氯水中加入少量CaCO3:2Cl2+H2O+CaCO3=Ca2++2Cl-+CO2↑+2HClO C、向NaHS溶液中滴加少量的CuSO4溶液:Cu2++HS-=CuS↓+H+ D、Fe3O4溶于HI溶液:Fe3O4+8H+=Fe2++2Fe3++4H2O4. “化学多米诺实验”即只需控制第一个反应,利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生。如图是一个“化学多米诺实验”。已知:①Cu2++4NH3·H2O=4H2O+[Cu(NH3)4]2+(该反应产物可作为H2O2分解的催化剂)
②A和C中的硫酸溶液浓度相同

下列有关分析错误的是
A、该实验成功的重要条件是整套装置气密性良好 B、C中现象为液面下降 C、B中反应速率大于D中反应速率 D、H中出现浅黄色浑浊5. X、Y、Z、W是元素周期表中原子序数依次增大的前四周期元素。已知X是形成化合物种类最多的元素,Y和W的最外层电子数相同,但不同族,W的次外层电子数是最外层的8倍,Z是主族元素,其盐可以用于净水。某科研团队研究发现,X、Y、W形成的晶体有超导性,该新型超导晶体的一个晶胞如图所示,晶胞参数为a pm。下列说法正确的是 A、X的氢化物可以与水形成氢键 B、电负性:Y>Z C、晶胞中与Y最近的X原子有6个 D、晶体密度为g/cm36. 一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示[KOH溶液中, Zn2+以存在]。电池放电时,下列叙述正确的是
A、X的氢化物可以与水形成氢键 B、电负性:Y>Z C、晶胞中与Y最近的X原子有6个 D、晶体密度为g/cm36. 一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示[KOH溶液中, Zn2+以存在]。电池放电时,下列叙述正确的是 A、Ⅱ区的通过交换膜向I区迁移 B、Ⅲ区的K+通过交换膜最终向I区迁移 C、Zn电极反应:Zn+2e-+4OH-= D、电池总反应:Zn+4OH-+MnO2+4H+=+Mn2++2H2O7. HA是一元弱酸,含少量MA固体的难溶盐MA的饱和溶液中c(M+)随c(H+)而变化, M+不发生水解。实验发现,298K 时c2(M+)~ c(H+)为线性关系,如下图中实线所示。下列叙述错误的是
A、Ⅱ区的通过交换膜向I区迁移 B、Ⅲ区的K+通过交换膜最终向I区迁移 C、Zn电极反应:Zn+2e-+4OH-= D、电池总反应:Zn+4OH-+MnO2+4H+=+Mn2++2H2O7. HA是一元弱酸,含少量MA固体的难溶盐MA的饱和溶液中c(M+)随c(H+)而变化, M+不发生水解。实验发现,298K 时c2(M+)~ c(H+)为线性关系,如下图中实线所示。下列叙述错误的是 A、c(H+) 增大的原因可能是加入了酸HA B、溶液c(H+)= 2×10-4时,c(M+)> 3×10-4mol·L-1 C、随着c(H+)的增大, MA的溶度积Ksp(MA)保持不变 D、c2(M+)~ c(H+) 的线性关系为: c2(M+)= Ksp(MA)
A、c(H+) 增大的原因可能是加入了酸HA B、溶液c(H+)= 2×10-4时,c(M+)> 3×10-4mol·L-1 C、随着c(H+)的增大, MA的溶度积Ksp(MA)保持不变 D、c2(M+)~ c(H+) 的线性关系为: c2(M+)= Ksp(MA)二、非选择题
-
8. 碲被誉为现代工业的维生素,某工艺从精炼铜的阳极泥(主要含有Cu2Te,还有Au、Ag、SiO2等)中分别回收碲和重金属的流程如下图所示:

已知:“焙烧”后,碲主要以TeO2形式存在,TeO2溶于强碱生成。
(1)、基态Te原子的价电子排布式为。(2)、“焙烧”时气体与固体原料逆流而行,目的是;“滤液①”中 的成分为(填化学式)。(3)、“氧化”步骤中,双氧水需分批加入的目的是。(4)、写出“热还原”时发生反应的化学方程式。(5)、滤渣①中含CuO、Au和Ag,“酸浸①”可用浸取(填选项,下同),“酸浸②”可用浸取。A.王水 B.稀硝酸 C.浓氢氧化钠溶液 D.稀硫酸
(6)、粗碲粉中碲质量分数的测定步骤如下:取mg粗碲粉,加入酸使其转化为亚碲酸(H2TeO3),配制成100mL 溶液,取25.00mL 于锥形瓶中。向锥形瓶中加入V1mLc1mol·L-1酸性K2Cr2O7溶液,充分反应使亚碲酸转化为原碲酸(H6TeO6)。用c2mol·L-1硫酸亚铁铵[ (NH4)2 Fe(SO4)2 ]标准溶液滴定剩余的酸性K2Cr2O7溶液,消耗V2mL硫酸亚铁铵标准溶液。该粗碲粉中碲的质量分数为。9. 某研究小组制备纳米ZnO,再与金属有机框架(MOF)材料复合制备荧光材料ZnO@MOF,流程如图:
已知:①含锌组分间的转化关系:Zn2+Zn(OH)2
②ε−Zn(OH)2是Zn(OH)2的一种晶型,39℃ 以下稳定。
请回答:
(1)、步骤I,初始滴入ZnSO4溶液时,反应的化学方程式。(2)、下列有关说法错误的是____ 。A、步骤I,搅拌的作用是避免反应物浓度局部过高,使反应充分 B、步骤I,若将过量NaOH溶液滴入ZnSO4溶液制备ε−Zn(OH)2 , 可提高ZnSO4的利用率 C、步骤Ⅱ,为了更好地除去杂质,可用50℃的热水洗涤(3)、步骤Ⅲ,控温煅烧的目的是。(4)、步骤Ⅲ中,实验室盛放样品的容器名称是。(5)、用(CH3COO)2Zn和过量(NH4)2CO3反应,得到的沉淀可直接控温煅烧得纳米ZnO,沉淀无需洗涤的原因是。(6)、为测定纳米ZnO产品的纯度,可用已知浓度的EDTA标准溶液滴定Zn2+。用称量ZnO样品0.081g,在中用酸溶解样品,然后在中配制一 定体积的Zn2+溶液,再用移液管量取一定体积的 Zn2+溶液,最后用滴定管盛装EDTA标准溶液,滴定Zn2+。从下列选项中选择合理的仪器(按顺序填写且用字母作答)补全以上步骤。仪器: a.烧杯 b.托盘天平 c.容量瓶 d.分析天平 e.试剂瓶
(7)、制备的ZnO@MOF荧光材料可测Cu2+浓度。已知ZnO@MOF的荧光强度比值与Cu2+在一定浓度范围内的关系如图。某研究小组取7.5 ×10−3g人血浆铜蓝蛋白(相对分子质量为1.5 ×105),经预处理,将其中Cu元素全部转化为Cu2+并定容至1L。取样测得荧光强度比值为9.7,则1个人血浆铜蓝蛋白分子中含个铜原子。 10. 氨基甲酸铵(H2NCOONH4)为尿素生产过程的中间产物,易分解。
10. 氨基甲酸铵(H2NCOONH4)为尿素生产过程的中间产物,易分解。已知:
Ⅰ.N2(g)+3H2(g)⇌2NH3(g) ΔH1= -92 kJ·mol-1
Ⅱ. C(s)+O2(g)⇌CO2(g) ΔH2= - 394 kJ·mol-1
Ⅲ. N2(g)+ 3H2(g)+C(s)+O2(g)⇌H2NCOONH4(s) ΔH3= - 646 kJ·mol-1
Ⅳ.H2NCOONH4(s)⇌2NH3(g)+ CO2(g) ΔH4
回答下列问题:
(1)、NH3的空间构型为。NH3的键角大于PH3 , 分析原因:。(2)、ΔH4=。 T℃下在某密闭容器中加入H2NCOONH4(s),假设只发生反应Ⅳ,达平衡时测得NH3的浓度为c1;保持温度不变,加压(缩小容器的体积),测得新的平衡条件下NH3的浓度为c2 , 则c1c 2(填“>” “<”或“=”)。反应Ⅳ在 (填“高温” “低温”或“任意温度”)条件下能够自发进行。(3)、某温度下在一刚性的密闭容器中,充入等物质的量N2和H2发生反应Ⅰ,起始压强为1MPa, 10min 末达平衡,测得平衡时压强为0.8MPa,则10min内v(N2)=MPa/min。此时平衡常数Kp=。对于该条件下的反应,下列说法错误的是。A.当N2的体积分数不变时,说明反应已经达到化学平衡状态
B.温度升高化学反应速率加快,化学平衡常数增大
C.其他条件不变时,若适当增加N2的用量,可以提高H2的平衡转化率
D.使用合适的催化剂可以加快化学反应速率,但ΔH1不变
(4)、在一定的条件 下,将AmolN2和BmolH2充入某体积固定的密闭容器中合成NH3 , 在不同的催化剂(甲或乙)下发生反应,反应相同时间后H2的转化率与温度的关系如图:
某学习小组的同学通过讨论得出结论: 200℃时, a点对应的转化率(5%)不是使用催化剂甲下H2的平衡转化率。判断依据是:。
11. 化合物H是降脂类药物瑞舒伐他汀制备中的关键中间体。在医药工业中的一种合成方法如下:
已知: i.

ii.
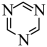 与苯结构相似, 六元环中存在共轭大键,具有芳香性。
与苯结构相似, 六元环中存在共轭大键,具有芳香性。回答下列问题: ;
(1)、A中官能团名称为 , C的化学名称为。(2)、E中碳原子的杂化方式有种。(3)、写出E→F的转化过程中另一生成物的电子式。(4)、在F的同分异构体中,同时满足下列条件的有种(不考虑立体异构)a含有
 和
和 两个直接相连的六元环
两个直接相连的六元环b.两个六元环上均只有一条侧链, - SCH2CH2F与
 连接
连接c.可以使溴的四氯化碳溶液褪色
其中含有手性碳原子的结构简式为。
(5)、参照上述合成路线,以 为原料,设计合成
为原料,设计合成 的路线(无机试剂及不超过两个碳的有机试剂任选)。
的路线(无机试剂及不超过两个碳的有机试剂任选)。