江苏省扬州市仪征市2023年中考一模化学试题
试卷更新日期:2023-05-08 类型:中考模拟
一、单选题
-
1. 党的二十大报告提出“建设人与自然和谐共生的美丽中国”,下列做法不符合这一主题的是A、燃放烟花爆竹,增添节日氛围 B、更多的利用太阳能、风能等清洁能源 C、变废为宝,回收秸秆加工为生物柴油 D、双面使用纸张,节约森林资源2. 下列变化过程中,不涉及化学变化的是A、
 电池供电
B、
电池供电
B、 葡萄酿酒
C、
葡萄酿酒
C、 塑料降解
D、
塑料降解
D、 干冰升华
3. 下列物质由分子构成的是A、铁 B、氨气 C、金刚石 D、氯化钠4. 石膏的主要成分是CaSO4从物质类别来看,CaSO4属于A、酸 B、碱 C、盐 D、氧化物5. 氧化铋(Bi2O3)是制作防火纸材料之一,其中铋元素的化合价为A、+1 B、+2 C、+3 D、-36. 食物残渣应投入的垃圾箱上所印标识是A、
干冰升华
3. 下列物质由分子构成的是A、铁 B、氨气 C、金刚石 D、氯化钠4. 石膏的主要成分是CaSO4从物质类别来看,CaSO4属于A、酸 B、碱 C、盐 D、氧化物5. 氧化铋(Bi2O3)是制作防火纸材料之一,其中铋元素的化合价为A、+1 B、+2 C、+3 D、-36. 食物残渣应投入的垃圾箱上所印标识是A、 B、
B、 C、
C、 D、
D、 7. 交警检查酒驾用的酒精检测仪内的化学反应是 , X的化学式是( )A、SO3 B、Cr2O3 C、Cr (SO4)3 D、Cr2(SO4)38. 空气的质量意味着生活的质量。下列关于空气的说法正确的是A、向空气中排放CO2会形成酸雨 B、少量有害物质进入空气,大自然可以自我净化 C、空气中的稀有气体没有任何用途 D、燃烧法测定空气中氧气含量,可用硫代替红磷9. 根据如图的信息判断,下列说法错误的是
7. 交警检查酒驾用的酒精检测仪内的化学反应是 , X的化学式是( )A、SO3 B、Cr2O3 C、Cr (SO4)3 D、Cr2(SO4)38. 空气的质量意味着生活的质量。下列关于空气的说法正确的是A、向空气中排放CO2会形成酸雨 B、少量有害物质进入空气,大自然可以自我净化 C、空气中的稀有气体没有任何用途 D、燃烧法测定空气中氧气含量,可用硫代替红磷9. 根据如图的信息判断,下列说法错误的是 A、硫原子的核电荷数为16 B、硫原子的相对原子质量为32.06 C、硫原子核外有3个电子层 D、在化学反应中,硫原子容易失去电子形成S2-10. 对反应进行分类有助于认识与研究化学变化。下列反应属于置换反应的是A、 B、 C、 D、11. 下列关于氧化铜与稀硫酸反应的实验操作中,错误的是A、
A、硫原子的核电荷数为16 B、硫原子的相对原子质量为32.06 C、硫原子核外有3个电子层 D、在化学反应中,硫原子容易失去电子形成S2-10. 对反应进行分类有助于认识与研究化学变化。下列反应属于置换反应的是A、 B、 C、 D、11. 下列关于氧化铜与稀硫酸反应的实验操作中,错误的是A、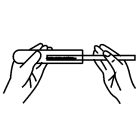 取氧化铜粉末
B、
取氧化铜粉末
B、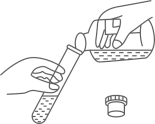 倾倒稀硫酸
C、
倾倒稀硫酸
C、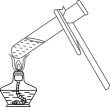 加热混合物
D、
加热混合物
D、 熄灭酒精灯
12. 连花清瘟胶囊的成分中含有一种名为绿原酸(C16H18O9)的物质。下列说法正确的是A、分子中含有43种元素 B、相对分子质量为(12×16+1×18+16×9) C、碳、氢元素的质量比为8:9 D、每个绿原酸分子中含有9个水分子13. 一瓶存放较长时间的石灰水,瓶内壁附有一层白膜,下列有关说法错误的是( )A、白膜都是氢氧化钙 B、白膜的形成与二氧化碳有关 C、白膜可用盐酸除去 D、试剂使用后应及时盖上瓶塞14. 汽车尾气净化装置能将尾气中的CO和NO催化转化为两种无毒气体,微观示意图如下。下列有关说法正确的是
熄灭酒精灯
12. 连花清瘟胶囊的成分中含有一种名为绿原酸(C16H18O9)的物质。下列说法正确的是A、分子中含有43种元素 B、相对分子质量为(12×16+1×18+16×9) C、碳、氢元素的质量比为8:9 D、每个绿原酸分子中含有9个水分子13. 一瓶存放较长时间的石灰水,瓶内壁附有一层白膜,下列有关说法错误的是( )A、白膜都是氢氧化钙 B、白膜的形成与二氧化碳有关 C、白膜可用盐酸除去 D、试剂使用后应及时盖上瓶塞14. 汽车尾气净化装置能将尾气中的CO和NO催化转化为两种无毒气体,微观示意图如下。下列有关说法正确的是 A、参加反应的CO和NO分子个数比为1∶1 B、反应前后碳元素化合价不变 C、反应前后原子种类和数目都改变 D、反应过程中催化剂质量不断减少15. 下列实验方案不能达到目的的是A、制备:用双氧水和二氧化锰制备少量O2 B、检验:用湿润的蓝色石蕊试纸检验NH3 C、除杂:用水除去MnO2中混有的KCl D、鉴别:用肥皂水鉴别蒸馏水和饱和CaCl2溶液16. 下列有关物质的性质与用途关系对应错误的是A、氮气化学性质稳定,可作保护气 B、不锈钢耐腐蚀,可制造医疗器械 C、二氧化碳能溶于水,可用于灭火 D、浓硫酸有吸水性,可用作干燥剂17. 下列现象的解释不合理的是
A、参加反应的CO和NO分子个数比为1∶1 B、反应前后碳元素化合价不变 C、反应前后原子种类和数目都改变 D、反应过程中催化剂质量不断减少15. 下列实验方案不能达到目的的是A、制备:用双氧水和二氧化锰制备少量O2 B、检验:用湿润的蓝色石蕊试纸检验NH3 C、除杂:用水除去MnO2中混有的KCl D、鉴别:用肥皂水鉴别蒸馏水和饱和CaCl2溶液16. 下列有关物质的性质与用途关系对应错误的是A、氮气化学性质稳定,可作保护气 B、不锈钢耐腐蚀,可制造医疗器械 C、二氧化碳能溶于水,可用于灭火 D、浓硫酸有吸水性,可用作干燥剂17. 下列现象的解释不合理的是选项
实验现象
解释
A
打开“雪碧”汽水瓶盖,产生气泡
气体的溶解度随着压强减小而减小
B
在积雪的公路上撒盐,冰雪很快融化
盐水的沸点较高
C
木炭在空气中燃烧发出红光,在氧气中燃烧发出白光
燃烧剧烈程度跟O2含量有关
D
向盛有NaOH固体的试管中加水,试管外壁有热感
NaOH固体溶于水放热
A、A B、B C、C D、D18. 如图是KNO3和NaNO3的溶解度曲线。下列说法正确的是 A、用搅拌的方法能增大NaNO3在水中的溶解度 B、t1℃时,50g水里加入25gKNO3 , 可得到75g溶液 C、t2℃时,等质量的KNO3和NaNO3溶液中溶质的质量一定相等 D、冷却热的KNO3饱和溶液可获得KNO3晶体19. 某化学兴趣小组利用如图微型装置进行CO和Fe2O3反应的实验。下列说法错误的是
A、用搅拌的方法能增大NaNO3在水中的溶解度 B、t1℃时,50g水里加入25gKNO3 , 可得到75g溶液 C、t2℃时,等质量的KNO3和NaNO3溶液中溶质的质量一定相等 D、冷却热的KNO3饱和溶液可获得KNO3晶体19. 某化学兴趣小组利用如图微型装置进行CO和Fe2O3反应的实验。下列说法错误的是 A、操作时,先点燃甲处酒精灯,再将注射器内的CO推入V型玻璃管内 B、实验时可观察到V型玻璃管中红棕色粉末逐渐变黑 C、装置乙的作用是防倒吸 D、实验过程中可观察到丙中澄清石灰水变浑浊,且液面下降20. 科学工作者研发了一种SUNCAT系统,借助该系统利用如图所示的原理可持续合成氨。下列说法正确的是
A、操作时,先点燃甲处酒精灯,再将注射器内的CO推入V型玻璃管内 B、实验时可观察到V型玻璃管中红棕色粉末逐渐变黑 C、装置乙的作用是防倒吸 D、实验过程中可观察到丙中澄清石灰水变浑浊,且液面下降20. 科学工作者研发了一种SUNCAT系统,借助该系统利用如图所示的原理可持续合成氨。下列说法正确的是 A、该系统中只有Li、O的化合价发生了改变 B、涉及的反应类型只有化合反应和分解反应 C、理论上,每合成68gNH3 , 就需要消耗56gN2 D、理论上,每消耗28gN2 , 需额外补充42gLi
A、该系统中只有Li、O的化合价发生了改变 B、涉及的反应类型只有化合反应和分解反应 C、理论上,每合成68gNH3 , 就需要消耗56gN2 D、理论上,每消耗28gN2 , 需额外补充42gLi二、填空题
-
21. 扬州,可爱的家乡,美丽的城市,已拥有“一城三都”桂冠。
 (1)、I.世界美食之都—“吃”在扬州
(1)、I.世界美食之都—“吃”在扬州扬州干丝天下一绝:干丝作为豆制品提供的主要营养成分为(填“淀粉”或“蛋白质”),除此还含一定量的钙,钙元素(填“属于”或“不属于”)人体所需微量元素,适量补充钙可以预防(填字母)。
A.骨质疏松 B.甲状腺疾病 C.侏儒症
(2)、扬州包子闻名天下:面粉发酵时加入小苏打(NaHCO3),在蒸煮过程中小苏打受热分解生成Na2CO3并放出CO2气体,使蒸出来的包子更加的蓬松。该反应的化学方程式为。(3)、II.世界宜居城市—“住”在扬州扬州城市大公园:享受生态之“绿”—绿色植物通过作用让城市成为宜居氧吧。该作用将能转化为化学能。
(4)、扬州公交新能源:感受出行之“绿”—新能源公交车逐步淘汰传统燃油车的意义是。骑电动车要戴安全头盔,其中一种轻质、高强度、防冲击的头盔材质是碳纤维与高新能树脂的结合,它属于(填字母)。A.无机材料 B.合成材料 C.复合材料
(5)、Ⅲ.世界旅游城市—“游”在扬州“烟花三月下扬州”,三月的扬州花红柳绿,香气扑鼻。从微粒角度解释“香气扑鼻”的主要原因是____(填字母)。
A、分子间有空隙 B、分子非常小 C、分子是不断运动的(6)、“二十四桥明月夜”,在瘦西湖内修建的二十四桥为单孔拱桥,汉白玉栏杆,如玉带飘逸。汉白玉的主要成分为(填化学式)。石塔寺千年古银杏顶端安装钢管制成的避雷针,利用了铁的(填“导电”或“导热”)性。22. 水是一种常见的溶剂,也是重要的资源。通过学习我们认识水、使用水、爱护水资源。(1)、I.认识“水”:扬州水源地水质各项常规指标如下:(数据来源于扬州生态环境局官网,2023年3月27日)
取水点
pH
溶解氧(mg/L)
高锰酸盐指数(mg/L)
氨氮(mg/L)
廖家沟新城水源地
8.12-8.30
9.14
2.5
0.11
长江瓜州水源地
8.00-8.15
9.12
3.0
0.09
①两地水源都呈(填“酸”或“碱”)性。
②溶解氧中的“氧”是指(用化学符号表示)。
③(填表格中一项常规指标)含量过高,会导致水体富营养化。
④下列图标是我国“国家节水标志”的是(填字母)。
A .
 B.
B. C.
C. D.
D. (2)、Ⅱ.使用“水”:
(2)、Ⅱ.使用“水”:农业上常用16%的NaCl溶液选种。实验室配制50g溶质质量分数为16%的NaCl溶液。
①用托盘天平称取 gNaCl固体。
②用量筒量水时,采用如图所示观察方式,则所配溶液的溶质质量分数(填“<”“>”或“=”)16%。该操作还需要的仪器是(填仪器名称)。

③最后将NaCl溶液转移到试剂瓶中,贴上标签(如图),在标签上可以不必注明的是(填字母)。

A 50g B.16% C.NaCl溶液
(3)、Ⅲ.处理“水”:大多数天然淡水需要经过处理方可直接饮用。
①“生命吸管”将大运河水转变为饮用水的过程示意图如下:

“活性炭”可去除异味,是因为它具有良好的性。“离子交换树脂”将硬水软化的反应之一是: , 由此可知一个Ca2+可交换出(填数字)个Na+。
②城市集中供热厂锅炉长期使用会形成水垢,可用盐酸去除。写出水垢中Mg2(OH)2CO3与盐酸发生反应的化学方程式。
三、综合题
-
23. 学习小组对影响铁锈蚀因素及控制实验条件的探究开启了项目化学习之旅。

 (1)、【项目一】探究铁锈蚀的条件
(1)、【项目一】探究铁锈蚀的条件铁生锈是(填“剧烈”或“缓慢”)氧化。
(2)、一天后试管a中的铁钉生锈而c中的铁钉没有生锈,由此可得出:铁生锈需要与接触。(3)、铁钉生锈的其中一步反应是铁与氧气、水共同作用生成Fe(OH)2 , 该反应化学方程式为。(4)、【项目二】探究植物油能否完全隔绝氧气一段时间后,仔细观察试管b中铁钉,发现也有锈蚀现象。为此大家又设计了如下实验。
[实验1]将涂水的铁片置于植物油中,并放置于密封的无氧容器中,一天后观察铁片无锈迹。
[实验2]将涂水的铁片置于植物油中,并敞口放置于空气中,一天后发现少量锈斑,再过一段时间观察,锈斑面积增大。
植物油(填“能”或“不能”)完全隔绝空气中的氧气。
(5)、根据实验1和实验2的对比,为达到任务一的目的,试管b可采取的改进措施为。(6)、【项目三】探究植物油隔离对CO2在水中溶解情况的影响已知:CO2在水中的逸出速率大于溶解速率,故也可用排水法收集CO2。
图二中仪器①的名称 , 发生装置有一处明显的不正确。
(7)、实验室制取CO2的化学方程式为。(8)、装置改进后,用两个量筒分别收集100mLCO2并倒置于水槽中,向其中一个量筒内迅速注入少量植物油,使CO2与水被植物油隔开(CO2与植物油不反应)。测得量筒内CO2体积随时间的变化曲线如图三。①分析图三,可得出植物油不能完全将CO2与水隔离,可以(填“加快”或“减缓”)CO2在水中的溶解。
②取量筒内的液体少量于试管中,滴加(填试剂名称),溶液变红色,说明显酸性。
24. 碳酸锂(Li2CO3)是制备锂电池的重要原料。工业上用锂辉石精矿(主要成分为Li2O)为原料制备Li2CO3的流程如下图所示。 (1)、酸浸前将锂辉石精矿粉碎的目的是。酸浸槽中发生反应的化学方程式为。(2)、为了探究酸浸槽中的最佳条件,技术人员做了4组实验,酸浸时间4h,其余相关数据见表。
(1)、酸浸前将锂辉石精矿粉碎的目的是。酸浸槽中发生反应的化学方程式为。(2)、为了探究酸浸槽中的最佳条件,技术人员做了4组实验,酸浸时间4h,其余相关数据见表。组别
矿酸比
硫酸浓度(%)
温度(℃)
锂元素浸出率(%)
A
1:1
90
100
70.34
B
1:1
98
100
73.89
C
1:1
98
150
78.24
D
1:3
98
200
85.53
①本实验中 (填“BC”或“CD”)两组实验对比能说明温度对锂元素的浸出率有影响。
②根据A组和B组实验对比,得出硫酸浓度对锂元素浸出率的影响是:其它条件相同时,。
(3)、反应器中加入饱和K2CO3溶液的目的是。(4)、沉锂池中进行的操作名称是 , 该操作用到的玻璃仪器为漏斗、烧杯、。所得到的滤液在农业上可用作。(5)、根据Li2CO3的溶解度曲线图,分析洗涤槽中应采用的试剂是(填“冰水”或“热水”)。 25. 硫酸铜是一种常见的杀菌剂,在纺织、印刷、电镀等行业有广泛用途。为测定某镀铜工艺电镀液中CuSO4溶液的溶质的质量分数,兴趣小组设计了两个方案进行探究性学习。(1)、Ⅰ.甲方案
25. 硫酸铜是一种常见的杀菌剂,在纺织、印刷、电镀等行业有广泛用途。为测定某镀铜工艺电镀液中CuSO4溶液的溶质的质量分数,兴趣小组设计了两个方案进行探究性学习。(1)、Ⅰ.甲方案【实验原理】锌与CuSO4溶液、锌与稀H2SO4的反应。
锌与CuSO4溶液反应的方程式为:;
(2)、【实验步骤】①组装仪器, 。
②装药品,调节量气装置两边液面相平,读数。
③将CuSO4溶液滴入装有mg锌粉三颈烧瓶中并搅拌,充分反应后,再滴加稀H2SO4至不再有气体产生。
④冷却至室温,调节量气装置两边液面相平,读数。
请将上述实验步骤补充完整。
(3)、如图中仪器M名称叫恒压滴液漏斗,其主要作用是使液体顺利滴下,____(填字母)。 A、加快反应速率 B、防止滴入的液体对气体体积的影响(4)、步骤④中调节两边液面相平的操作是将水准管缓慢(填“上移”或“下移”)。(5)、下列因素中,可能使测得的CuSO4溶液的溶质的质量分数偏高的是____(填字母)。A、加入的锌粉中混有少量的铜粉 B、实验结束后,有部分 H2残留在三颈烧瓶中 C、反应前量气管水面在 0 刻度处,反应后俯视读数(6)、Ⅱ.乙方案
A、加快反应速率 B、防止滴入的液体对气体体积的影响(4)、步骤④中调节两边液面相平的操作是将水准管缓慢(填“上移”或“下移”)。(5)、下列因素中,可能使测得的CuSO4溶液的溶质的质量分数偏高的是____(填字母)。A、加入的锌粉中混有少量的铜粉 B、实验结束后,有部分 H2残留在三颈烧瓶中 C、反应前量气管水面在 0 刻度处,反应后俯视读数(6)、Ⅱ.乙方案【实验原理】CuSO4溶液与BaCl2溶液反应。
【实验步骤】

判断加入BaCl2溶液是否过量的最佳方法是____,然后观察现象判断。
A、静置混合物X,向上层清液中再滴少许BaCl2溶液 B、向滤液Y中滴加少许BaCl2溶液(7)、判断固体是否洗涤干净的方法是:取最后一次洗涤液,滴加(①稀盐酸、②AgNO3溶液、③BaCl2溶液,填写序号),无明显现象,则已洗净。(8)、计算该CuSO4溶液的溶质的质量分数。(写出计算过程)(9)、若固体烘干不彻底,则所得结果将(填“偏大”、“偏小”或“无影响”)。