江苏省无锡市梁溪区2023年中考一模化学试题
试卷更新日期:2023-05-08 类型:中考模拟
一、单选题
-
1. 四季轮回又一春,以下现象中蕴含化学变化的是A、冰雪消融 B、枯木逢春 C、微风拂面 D、花香四溢2. 营养均衡有助于提高免疫力。小明同学为全家人设计了一份午餐食谱,其中蛋白质含量最丰富的是( )A、炒芹菜 B、紫菜汤 C、清蒸鱼 D、米饭3. 某大衣的制作中使用到不同的材料,其中属于合成材料的是A、羊毛面料 B、锦纶内里 C、真皮镶边 D、金属纽扣4. 精准测量铟等元素的相对原子质量的中国科学家是A、道尔顿 B、屠呦呦 C、侯德榜 D、张青莲5. 实现“碳达峰、碳中和”应从不同层面、运用多种方法共同推进,其中没有直接贡献的是A、植树造林 B、开发风能 C、燃煤脱硫 D、节约用电6. 下列物质的俗称和化学式一致的是A、干冰:CO2 B、苏打:NaHCO3 C、消石灰:CaO D、烧碱:Na2CO37. 下列物质中属于纯净物的是A、洁净的空气 B、18K黄金 C、水泥砂浆 D、冰水混合物8. 为巩固实验室制取氧气的方法、加深对氧气性质的认识,某同学进行如下实验,其中错误的操作是A、
 检查装置气密性
B、
检查装置气密性
B、 取用药品
C、
取用药品
C、 用氯酸钾制取氧气
D、
用氯酸钾制取氧气
D、 铁丝燃烧
9. 下列化学用语表示正确的是A、锰酸钾:KMnO4 B、锡元素:SN C、2个氮分子:2N2 D、4个磷原子:P410. 我国在太空完成水稻全生命周期培养实验,实验中发现水稻叶色发黄,需施用的肥料是A、NH4Cl B、K2SO4 C、Ca3(PO4)2 D、KCl11. 下列物质的转化在给定条件下能实现的是A、 B、 C、 D、12. 下列仪器的使用错误的是A、量筒:量取液体体积,不能加热 B、漏斗:用作添加液体试剂,将液体注入小口径容器中 C、试管:用作少量试剂的反应容器,在常温或者加热时使用 D、烧杯:用作较大量试剂的反应容器,可以直接加热13. 用饼状图表示MgO中镁元素与氧元素的质量关系,表示方法正确的是A、
铁丝燃烧
9. 下列化学用语表示正确的是A、锰酸钾:KMnO4 B、锡元素:SN C、2个氮分子:2N2 D、4个磷原子:P410. 我国在太空完成水稻全生命周期培养实验,实验中发现水稻叶色发黄,需施用的肥料是A、NH4Cl B、K2SO4 C、Ca3(PO4)2 D、KCl11. 下列物质的转化在给定条件下能实现的是A、 B、 C、 D、12. 下列仪器的使用错误的是A、量筒:量取液体体积,不能加热 B、漏斗:用作添加液体试剂,将液体注入小口径容器中 C、试管:用作少量试剂的反应容器,在常温或者加热时使用 D、烧杯:用作较大量试剂的反应容器,可以直接加热13. 用饼状图表示MgO中镁元素与氧元素的质量关系,表示方法正确的是A、 B、
B、 C、
C、 D、
D、 14. 《天工开物》中描述了系统、连续的炼铁炼钢过程,利用煤炭炼铁,从炼铁炉流出的生铁水,直接流进炒铁炉里炒成熟铁,从而减少了再熔化的过程。下列说法错误的是A、煤炭燃烧的温度能够达到炼铁所需的温度 B、炼铁炉中流出的是纯铁 C、生铁炒成熟铁的过程中降低了含碳量 D、该炼铁工艺减少了再熔化的过程,节约燃料,彰显了古代劳动人民的智慧15. 乙醇是实验室常用的燃料。下图是乙醇燃烧的微观示意图,相关说法正确的是
14. 《天工开物》中描述了系统、连续的炼铁炼钢过程,利用煤炭炼铁,从炼铁炉流出的生铁水,直接流进炒铁炉里炒成熟铁,从而减少了再熔化的过程。下列说法错误的是A、煤炭燃烧的温度能够达到炼铁所需的温度 B、炼铁炉中流出的是纯铁 C、生铁炒成熟铁的过程中降低了含碳量 D、该炼铁工艺减少了再熔化的过程,节约燃料,彰显了古代劳动人民的智慧15. 乙醇是实验室常用的燃料。下图是乙醇燃烧的微观示意图,相关说法正确的是 A、乙醇由9个原子构成 B、反应前后共有三种氧化物 C、生成乙和丙的质量比为27:44 D、反应中甲和丙的分子个数比是1:116. 小明在儿童节汇演中表演了一个魔术:向“凉白开”中滴加无色液体甲,变成一杯“红酒”;接着向“红酒”中加入无色液体乙,产生大量气泡,变成一杯“汽水”;最后,向“汽水”中加入无色液体丙,变成一杯“牛奶”。已知甲为酚酞溶液,下列说法错误的是A、“凉白开”是碱性溶液 B、液体乙的用量不影响液体丙的选择 C、液体丙可能是AgNO3溶液 D、最后得到的“牛奶”是悬浊液17. 氯化钠、碳酸钠、硝酸钾在不同温度时的溶解度如表所示,某同学根据表中数据作出了其中一种物质的溶解度曲线(如图所示),请根据表和图中信息指出下列说法错误的
A、乙醇由9个原子构成 B、反应前后共有三种氧化物 C、生成乙和丙的质量比为27:44 D、反应中甲和丙的分子个数比是1:116. 小明在儿童节汇演中表演了一个魔术:向“凉白开”中滴加无色液体甲,变成一杯“红酒”;接着向“红酒”中加入无色液体乙,产生大量气泡,变成一杯“汽水”;最后,向“汽水”中加入无色液体丙,变成一杯“牛奶”。已知甲为酚酞溶液,下列说法错误的是A、“凉白开”是碱性溶液 B、液体乙的用量不影响液体丙的选择 C、液体丙可能是AgNO3溶液 D、最后得到的“牛奶”是悬浊液17. 氯化钠、碳酸钠、硝酸钾在不同温度时的溶解度如表所示,某同学根据表中数据作出了其中一种物质的溶解度曲线(如图所示),请根据表和图中信息指出下列说法错误的温度
0
10
20
30
40
溶解度/g
氯化钠
35.7
35.8
36
36.5
37
碳酸钠
6
16
18
36.5
50
硝酸钾
13.3
20.9
31.6
45.8
63.9
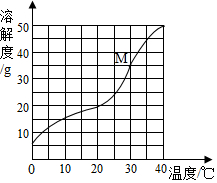 A、曲线M是表中碳酸钠的溶解度曲线 B、从表中的数据可以看出溶解度受温度变化影响最小的物质是氯化钠 C、从混有少量硝酸钾的氯化钠溶液中提纯氯化钠固体,可采用的方法是蒸发结晶 D、如果将表中三种物质的溶解度曲线全部画出,在0℃~40℃范围内会有3个两线交点18. 下列各组物质的鉴别方法错误的是
A、曲线M是表中碳酸钠的溶解度曲线 B、从表中的数据可以看出溶解度受温度变化影响最小的物质是氯化钠 C、从混有少量硝酸钾的氯化钠溶液中提纯氯化钠固体,可采用的方法是蒸发结晶 D、如果将表中三种物质的溶解度曲线全部画出,在0℃~40℃范围内会有3个两线交点18. 下列各组物质的鉴别方法错误的是选项
物质
鉴别方法
A
氧气和氮气
伸入带火星的木条
B
钾肥和铵态氮肥
加入熟石灰研磨
C
稀盐酸和氯化钠溶液
滴加酚酞溶液
D
铁粉和氧化铜粉末
加入稀硫酸
A、A B、B C、C D、D19. 燃气公司常在天然气中加入微量具有特殊气味的乙硫醇(CxHySz)提醒居民天然气泄漏。为确定乙硫醇的化学式,某兴趣小组取6.2g乙硫醇,使其充分燃烧,生成了5.4g水和6.4g有刺激性气味的气体。则乙硫醇的化学式为A、C2H6S B、C3H4S5 C、C2H5S2 D、C3H5S20. 某化学兴趣小组应用压强传感器探究氢氧化钠和二氧化碳的反应,得到压强随时间变化的图像。下列说法错误的是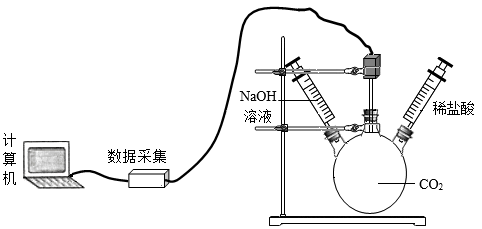
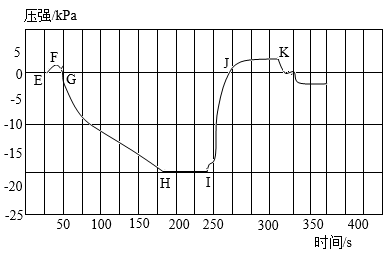 A、步骤①:推入氢氧化钠溶液,瓶内气体被压缩,压强从E到F瞬间变大 B、步骤②:振荡三颈烧瓶,氢氧化钠与二氧化碳反应,压强从G到H迅速减小 C、步骤③:推入稀盐酸,稀盐酸与碳酸钠反应,压强从I到K增大 D、从J到K,反应生成气体,导致压强超过实验初始压强
A、步骤①:推入氢氧化钠溶液,瓶内气体被压缩,压强从E到F瞬间变大 B、步骤②:振荡三颈烧瓶,氢氧化钠与二氧化碳反应,压强从G到H迅速减小 C、步骤③:推入稀盐酸,稀盐酸与碳酸钠反应,压强从I到K增大 D、从J到K,反应生成气体,导致压强超过实验初始压强二、填空题
-
21. 探究水(1)、1766年英国化学家卡文迪许制得“可燃空气”,在纯氧中燃烧只生成水。他所制得的“可燃空气”成分是(填化学式)。(2)、1785年法国科学家拉瓦锡将水蒸气通过红热的铁管,得到氢气和四氧化三铁,写出该反应的化学方程式:。(3)、1800年英国化学家尼科尔森利用伏打电池对水进行通电,发现两极上都有气体逸出,正极与负极管中产生气体体积之比为。22. 常用水(1)、生活用水中可能含有铁、锰、铜等可溶性矿物质,这里的铁、锰、铜是指(填“分子”、“原子”或“元素”);还含有少量的溶解氧,这里的溶解氧是(填“氧分子”或“氧离子”)。(2)、实验室常使用的去离子水是指除去了呈离子形式的杂质的水,鉴别去离子水和硬水,可使用的试剂是。23. 淡化水(1)、冷凝法:海水蒸发冷凝获得淡水,冷凝过程中未发生变化的是(填字母)。
a.分子的质量 b.分子的种类 c.分子的间隔
(2)、膜分离法:海水加压后,水分子能通过反渗透膜,钠离子、镁离子等不能通过,该分离原理与化学实验中的操作相似。加压后,海水中钠离子的浓度。
三、综合题
-
24. 某兴趣小组设计了“氢氧焰”实验。装置如下图所示。
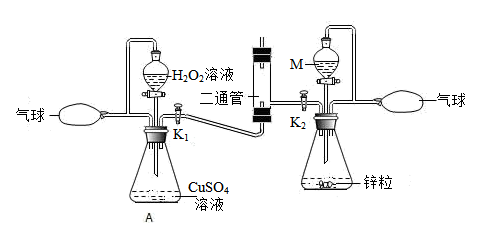 (1)、在实验中制备氧气的化学方程式为;用于制备氢气的试剂M是。(2)、该小组进行了如下操作:关闭K1 , 打开K2 , 打开右侧分液漏斗旋塞,在三通管上方收集气体、验纯后点燃氢气,观察到 , 在火焰上方放置铁片。铁片红热;打开K1 , 打开左侧分液漏斗旋塞,调节氧气流量,观察到铁片迅速熔断。由上述实验现象可知。(3)、关于该实验的说法正确的是(填字母)。
(1)、在实验中制备氧气的化学方程式为;用于制备氢气的试剂M是。(2)、该小组进行了如下操作:关闭K1 , 打开K2 , 打开右侧分液漏斗旋塞,在三通管上方收集气体、验纯后点燃氢气,观察到 , 在火焰上方放置铁片。铁片红热;打开K1 , 打开左侧分液漏斗旋塞,调节氧气流量,观察到铁片迅速熔断。由上述实验现象可知。(3)、关于该实验的说法正确的是(填字母)。a.气球既能保证装置气密性又能储存气体
b.分液漏斗上方导管能够保证上下气压一致
c.为避免爆炸,实验时应先将燃着的木条置于三通管口,后通入氢气
25. 氧化锌具有优异的常温发光性能,在半导体等领域应用广泛。利用工业含锌废渣(主要成分是ZnO,还含有Fe2O3、Al2O3、CdO等杂质)制取氧化锌的流程如下:
【查阅资料】相关金属离子开始沉淀至完全沉淀的pH范围如下表所示:
Fe3+
Al3+
Zn2+
Cd2+
开始沉淀
2.7
3.4
6.5
7.4
沉淀完全
3.7
4.7
8.5
9.4
(1)、酸浸时发生反应的化学方程式为(写出一个),为提高反应速率可采取的措施是。(2)、调pH的目的是将完全沉淀,操作时需控制pH的范围是。(3)、沉时锌粉置换出镉,说明锌的活动性比镉(填“强”或“弱”)。(4)、过滤所得滤液中的溶质为。(5)、沉锌后所得的碱式碳酸锌【Zn2(OH)2CO3】灼烧后生成ZnO和另外两种氧化物,该反应属于(填基本反应类型)。26. 阅读下列知文,回答相关问题。车内空气质量的改善
随着社会经济的高速发展,汽车在人们日常生活中的地位越来越重要。人们在关注汽车的操控性、经济性、安全性的同时,车内空气质量也日益成为人们关注的焦点问题。
车内空气污染主要来源于车内材料以及车外污染物的侵入,其主要污染物如下表所示。
污染来源
涉及污染物
车内材料
汽车内饰
苯(C6H6)、甲苯(C7H8)、甲醛(CH2O)等
空调
空调吸收物、细菌、霉菌
车外环境
空气
PM2.5粉尘、细菌、霉菌、病毒
CO、NOx等有毒气体
为改善车内空气污染,各类车内空气净化技术、产品陆续被各供应商和主机厂进行开发和搭载。目前主要有以下三种技术:活性炭滤网技术、光触媒净化技术以及抗菌涂层技术。
①活性炭滤网技术:通过在空调滤网内喷涂活性炭层,对进入车内的空气进行净化。
②光触媒净化技术:光触媒(TiO2)因其稳定性好,功效持久,不产生二次污染等特点,在空气净化领域已经早有应用。光触媒一般以TiO2材料作为催化剂,在特定波长段的光照下,产生氧化能力极强的羟基自由基,对于甲醛净化具有良好放果,净化原理见图1。

③抗菌涂层技术:氧化锌和银离子是两种应用较多的抗菌涂层材科。但银离子不适合长期储存,高剂量对人体具有毒性,因此,氧化锌具有更为广泛的应用前景。氧化锌的杀菌机理与光触媒技术类似,其杀菌原理见图2。
每种空气净化技术所对应的净化对象和净化能力都各有差异,只有多种技术相结合,互为补充,才能更加全面和彻底地改善车内空气质量。
(1)、下列车内空气污染物中属于有机物的是(填字母)。a.甲苯 b.NOx c.CO
(2)、活性炭滤网技术中活性炭的主要作用是。(3)、甲醛(CH2O)在光触媒技术的作用下发生反应的化学方程式为。(4)、银离子涂层将逐渐被氧化锌涂层取代,除了文中提到的缺陷,另一个重要原因是。(5)、购买新车后,为提高车内空气质量,可采取的简易措施是。27. 中国是茶的故乡,品茗饮茶在中国被视为生活之雅事。(1)、I、种植茶树茶树适宜在pH为5~6的土壤中生长,土壤呈(填“酸性”或“碱性”)。
(2)、茶树生长过程中会将环境中的氟元素富集于体内,青少年缺氟易导致。(3)、Ⅱ、泡制茶汤选择茶具:现选用三种不同材质的茶具泡某品牌龙井茶,测量茶汤中风味物质儿茶素类和咖啡碱的含量。测量结果如下:
浸泡时间(min)
儿茶素类含量(mg/g)
咖啡碱含量(mg/g)
紫砂壶
瓷质盖碗
玻璃杯
紫砂壶
瓷质盖碗
玻璃杯
2
155
162
151
25
26
26
4
201
223
214
32
36
35
以下属于该实验需控制的变量是(填字母)。
a.水温 b.水量 c.水样 d.煮水方式 e.茶叶用量
(4)、结论:不同材质的茶具对茶汤风味虽有一定影响,但差异不大,生活中按需选择即可。选择水:茶汤的滋味和香气与水的酸碱度和矿化度有较大关系。经研究发现水的pH值越低,茶汤的品质越高:水的矿化度(钙、镁离子含量)越低,茶汤的品质越高。选取三种不同水样测量,结果见下表。三种水祥中最适合泡茶的是。
水样
虎跑泉水
当地自来水
某品牌纯净水
pH
5.76
6.92
6.81
矿化度
低
高
低
(5)、Ⅱ、清洁茶具长期使用的茶具中易出现茶垢(主要成分为碳酸钙),需定期清理。
除垢原理
牙膏除垢:牙膏中有摩擦剂,利用摩擦作用,达到去污效果。
柠檬酸除垢:柠檬酸溶液能除垢的原因是。
茶垢清洁剂除垢:茶垢清洁剂中的过碳酸钠遇热水产生大量气体,分解茶垢。
(6)、自制除垢剂①现有50g质量分数为40%的柠檬酸溶液,将其稀释为除垢所需的质量分数为10%的柠檬酸溶液,需加水g。
②用碳酸钠和30%的过氧化氢溶液为主要原料制备过碳酸钠(2Na2CO3·3H2O2),理论上碳酸钠与过氧化氢溶液投料的质量比为;实际制备时该比值会偏低,主要原因是。
28. 2000年以来,锂电池广泛应用,这是锂电池真正大规模使用,凸显锂的战略意义、继美国、欧盟和澳大利亚之后,中国于2019年将锂矿列为24种国家战略性矿产资源之一。(1)、I、锂的结构及性质由如图可知:锂原子内的质子数是 , 锂离子的符号为。与早期电池用锌相比,锂的相对原子质量和体积都更小,作为电池材料具有更高的能量密度。锂电池内发生的某个反应可表示为: , 反应前后氧元素化合价不变,则反应后锰元素的化合价是。
 (2)、Ⅱ、沉淀法提取锂
(2)、Ⅱ、沉淀法提取锂向经过处理的盐湖水(主要成分是NaCl、LiCl)中加入碳酸钠,产生碳酸锂沉淀,写出该反应的化学方程式: , 过滤、洗涤、干燥后得到碳酸锂晶体。请你设计一个实验确认晶体已洗涤干净:。
(3)、Ⅲ、回收废锂电池锂电池中的正极材料是钴酸锂(LiCoO2),钴是一种重金属元素,将其回收的流程如下(杂质不参与反应):
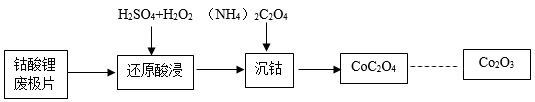
废极片中钴酸锂(LiCoO2)的质量分数为98%,若反应过程中钴元素无损耗,则1kg钴酸锂废极片最终能回收得到Co2O3的质量为。(写出计算过程)
(4)、回收废电池的意义在于(填字母)。a.节约金属资源
b.有利于推动相关企业提高电池高效再生技术
c.防止废电池中的重金属元素对土壤和水造成污染