江苏省扬州市高邮市梅岭教育集团2023年中考一模化学试题
试卷更新日期:2023-05-04 类型:中考模拟
一、单选题
-
1. “绿色发展”“低碳生活”的理念逐渐深入人心。下列做法符合这些理念的是( )A、生活垃圾随意丢弃 B、多乘坐私家车出行 C、工业废水直接排放 D、使用风能等绿色能源2. 在空气的成分中,体积分数约占21%的是( )A、氮气 B、二氧化碳 C、氧气 D、稀有气体3. 下列物质中,组成微粒为离子的是( )A、水 B、金属铁 C、氯化钠 D、干冰4. 下列物品的主要材料中,属于金属材料的是( )A、玻璃水杯 B、塑料花盆 C、青铜摆件 D、陶瓷茶盘5. 自然界里多数物质含有氧元素。下列属于氧化物的是( )A、臭氧 B、氧化镁 C、氢氧化钾 D、硫酸6. 用pH计测得一些物质的pH值如表,下列说法正确的是( )
物质
苹果汁
西瓜汁
牛奶
鸡蛋清
炉具清洁剂
pH
2.9
5.8
6.4
7.6
12.5
A、鸡蛋清和牛奶显碱性 B、西瓜汁比苹果汁的酸性强 C、炉具清洁剂可除铁锈 D、胃酸过多的人应少饮苹果汁7. 下列化学用语与含义不相符的是( )A、2Cl--2个氯原子 B、2Na+-2个钠离子 C、O2--氧离子 D、H2-氢分子8. 某反应前后分子变化的微观示意图如下、下列说法正确的是( ) A、反应后分子数目增加 B、反应前后各元素的化合价不变 C、反应后原子的种类增加 D、反应前后物质的总质量不变9. 对反应进行分类有助于认识与研究。下列属于置换反应的是( )A、 B、 C、 D、10. 蜡烛在密闭容器里燃烧至熄灭,容器里 O2和 CO 含量随时间变化的曲线如图所示,下列说法正确的是( )
A、反应后分子数目增加 B、反应前后各元素的化合价不变 C、反应后原子的种类增加 D、反应前后物质的总质量不变9. 对反应进行分类有助于认识与研究。下列属于置换反应的是( )A、 B、 C、 D、10. 蜡烛在密闭容器里燃烧至熄灭,容器里 O2和 CO 含量随时间变化的曲线如图所示,下列说法正确的是( ) A、①表示 CO 含量的变化 B、蜡烛发生了不完全燃烧 C、蜡烛熄灭时容器里的氧气已耗尽 D、该石蜡中含碳、氢和氧三种元素11. 煤气中加入少量的乙硫醇(C2H5SH)预防煤气中毒,乙硫醇可以充分燃烧,其化学方程式为:2C2H5SH+9O24CO2+2x+6H2O则x的化学式为( )A、S B、SO2 C、CH4 D、CO12. 酚酞(化学式为 C20H14O4)是一种酸碱指示剂,下列有关酚酞的说法正确的是( )A、向稀硫酸中滴入 1~2 滴酚酞试液,溶液变红 B、酚酞中C,H,O 三种元素的质量比为 10∶7∶2 C、一个酚酞分子中有 2 个氧分子 D、酚酞中碳元素的质量分数约为 75.5%13. 石灰乳可吸收燃煤废气中的SO2 , 并得到建筑材料石膏,发生的反应如下 。下列有关该反应的说法错误的是( )A、采用该方法可减少酸雨的形成 B、反应中有2种元素的化合价发生改变 C、该处理体现了“变废为宝”的绿色化学思想 D、为提高吸收效果,可用澄清的石灰水代替石灰乳14. 根据下列实验操作和现象所得到的结论正确的是( )
A、①表示 CO 含量的变化 B、蜡烛发生了不完全燃烧 C、蜡烛熄灭时容器里的氧气已耗尽 D、该石蜡中含碳、氢和氧三种元素11. 煤气中加入少量的乙硫醇(C2H5SH)预防煤气中毒,乙硫醇可以充分燃烧,其化学方程式为:2C2H5SH+9O24CO2+2x+6H2O则x的化学式为( )A、S B、SO2 C、CH4 D、CO12. 酚酞(化学式为 C20H14O4)是一种酸碱指示剂,下列有关酚酞的说法正确的是( )A、向稀硫酸中滴入 1~2 滴酚酞试液,溶液变红 B、酚酞中C,H,O 三种元素的质量比为 10∶7∶2 C、一个酚酞分子中有 2 个氧分子 D、酚酞中碳元素的质量分数约为 75.5%13. 石灰乳可吸收燃煤废气中的SO2 , 并得到建筑材料石膏,发生的反应如下 。下列有关该反应的说法错误的是( )A、采用该方法可减少酸雨的形成 B、反应中有2种元素的化合价发生改变 C、该处理体现了“变废为宝”的绿色化学思想 D、为提高吸收效果,可用澄清的石灰水代替石灰乳14. 根据下列实验操作和现象所得到的结论正确的是( )选项
实验操作和现象
结论
A
将锌粒放入CuSO4溶液中,表面析出红色物质
金属活动性:Zn > Cu
B
将燃着的木条伸入集气瓶中,木条熄灭
集气瓶中气体为 N2
C
向氢氧化钠溶液中滴加盐酸,无明显现象
该过程中未发生反应
D
将某气体通过灼热的黑色氧化铜固体,固体变红
该气体为氢气
A、A B、B C、C D、D15. 粗略测定含泥沙粗盐中氯化钠含量的部分操作如下图所示,其中对应操作不规范的是( )A、 图甲:称取一定质量的粗盐
B、
图甲:称取一定质量的粗盐
B、 图乙:溶解粗盐
C、
图乙:溶解粗盐
C、 图丙:过滤溶解粗盐所得的悬浊液
D、
图丙:过滤溶解粗盐所得的悬浊液
D、 图丁:蒸干过滤所得的溶液
16. 向某氧化铜与铁粉的混合物 M 中加入一定量的稀硫酸,微热并搅拌,充分反应后冷却,过滤得到滤渣 N。向所得滤液 Q 中放入一枚洁净表面已充分打磨过的铁钉,铁钉表面无明显变化。下列有关说法不正确的是( )A、混合物 M 中加入稀硫酸,可能发生 B、向滤渣 N 中加入适量稀硫酸,可能会有气泡产生 C、混合物 M 和滤渣 N 的质量可能相等 D、滤液 Q 中不可能含有 CuSO417. KNO3与 NaCl 的溶解度曲线如图所示。下列说法正确的是( )
图丁:蒸干过滤所得的溶液
16. 向某氧化铜与铁粉的混合物 M 中加入一定量的稀硫酸,微热并搅拌,充分反应后冷却,过滤得到滤渣 N。向所得滤液 Q 中放入一枚洁净表面已充分打磨过的铁钉,铁钉表面无明显变化。下列有关说法不正确的是( )A、混合物 M 中加入稀硫酸,可能发生 B、向滤渣 N 中加入适量稀硫酸,可能会有气泡产生 C、混合物 M 和滤渣 N 的质量可能相等 D、滤液 Q 中不可能含有 CuSO417. KNO3与 NaCl 的溶解度曲线如图所示。下列说法正确的是( ) A、KCl 的溶解度受温度影响的程度比 KNO3的大 B、15℃时,KNO3的溶解度比 KCl 的大 C、将 T1℃时 KNO3与 KCl 的饱和溶液温度升高到 45℃,两溶液的溶质的质量分数相等(忽略水的蒸发) D、将 KNO3、KCl 的溶液从 45℃降温到 15℃,析出晶体质量是 KNO3 > KCl18. 下列有关物质的性质与用途具有对应关系的是( )A、氮气常温下很稳定,可用作粮食保护气 B、碳酸氢铵受热易分解,可用作氮肥 C、铜具有金属光泽,可用于制造电线 D、盐酸常温下易挥发,可用于去除铁器表面铁锈19. 向饱和碳酸钠溶液中通入二氧化碳会析出碳酸氢钠晶体而使溶液变浑浊,反应原理为:。某化学小组利用如图装置探究影响碳酸氢钠晶体产生快慢的因素,结果如下表。下列说法正确的是( )
A、KCl 的溶解度受温度影响的程度比 KNO3的大 B、15℃时,KNO3的溶解度比 KCl 的大 C、将 T1℃时 KNO3与 KCl 的饱和溶液温度升高到 45℃,两溶液的溶质的质量分数相等(忽略水的蒸发) D、将 KNO3、KCl 的溶液从 45℃降温到 15℃,析出晶体质量是 KNO3 > KCl18. 下列有关物质的性质与用途具有对应关系的是( )A、氮气常温下很稳定,可用作粮食保护气 B、碳酸氢铵受热易分解,可用作氮肥 C、铜具有金属光泽,可用于制造电线 D、盐酸常温下易挥发,可用于去除铁器表面铁锈19. 向饱和碳酸钠溶液中通入二氧化碳会析出碳酸氢钠晶体而使溶液变浑浊,反应原理为:。某化学小组利用如图装置探究影响碳酸氢钠晶体产生快慢的因素,结果如下表。下列说法正确的是( )
序号
温度 / ℃
CO2流速(个气泡 / 秒)
出现浑浊的时间
1
25
2~5
5 分 17 秒
2
25
5~8
5 分 27 秒
3
25
10~13
5 分 02 秒
4
40
5~8
3 分 48 秒
5
50
5~8
1 分 36 秒
A、可用稀盐酸代替稀硫酸进行该实验 B、CO2流速、温度会影响析出碳酸氢钠晶体的析出速率 C、可用块状大理石代替碳酸钠粉末进行该实验 D、该实验可比较同温下碳酸钠与碳酸氢钠的溶解度大小20. 某烟气中含 N2、O2、SO2等气体,以 FeSO4催化处理其中的 SO2 , 部分流程如图-1 所示。开始时需向“脱硫”装置中加入一定量的 FeSO4溶液,并加入适量铁粉。保持其他条件相同,反应过程中吸收液的起始温度对脱硫率和吸收液 pH 的影响如图-2 所示:
已知:“脱硫”时发生的主要反应有。
下列说法错误的是( )
A、为提高脱硫的效率,烟气通入时使用多孔球泡 B、每脱除 128 g SO2的同时生成 196 g H2SO4 C、“脱硫”一段时间后,FeSO4溶液的浓度不变 D、温度大于 60℃时脱硫率下降,可能的原因是 SO2在溶液中的溶解度随温度升高而减小二、填空题
-
21. 精彩生活离不开化学,化学助力精彩生活。(1)、白醋是厨房里常见的无色酸味剂,主要成分是醋酸(HAc)。
①可用(填试剂名称)检测某白醋的酸性。
②水瓶内的水垢主要含 CaCO3、Mg(OH)2 , 可用白醋去除。Mg(OH)2去除时发生反应的化学方程式是。
(2)、氯化钠和蔗糖分别是咸味剂、甜味剂,其溶解度曲线如图所示。
①60℃时(填“能”或“不能”)配得 90%的蔗糖溶液。
②将 20℃时氯化钠的饱和溶液蒸发掉 50 g 水,理论上得到氯化钠的质量是g。
(3)、硬水含较高浓度的 Ca2+和 Mg2+ , 具有苦涩味,将其通过阳离子交换柱后可转化为软水,原理如图所示。其中阴离子未画出,交换后的水仍然呈电中性。
①1 个 Ca2+可以交换出个 Na+。
②结合水瓶内水垢的成分,家庭日常生活中软化硬水常用的方法是。
(4)、新鲜的蔬菜提供丰富的各种营养素。每 100 g 青菜中主要营养成分数据如下表:营养成分
维生素C
蛋白质
脂肪
糖类
钙
铁
水
质量
145 mg
1.3 g
0.3 g
2.3 g
56 mg
1.2 mg
94.5 g
①在青菜所含营养成分钙、铁中,属于人体微量元素得是(填元素符号)。
②经常摄入适量营养素,可预防得坏血病。
(5)、已知:水的密度是 1 g / mL。向 10 g 9%的 NaCl 溶液中加入mL 水,可稀释为0.9%的生理盐水。稀释过程中需用到的玻璃仪器有(填字母)。 22. 运用化学方法可从自然界中获取生活所需的材料。(1)、孔雀石的主要成分是 Cu2(OH)2CO3 , 可作为炼铜的原料。
22. 运用化学方法可从自然界中获取生活所需的材料。(1)、孔雀石的主要成分是 Cu2(OH)2CO3 , 可作为炼铜的原料。①孔雀石属于(填“纯净物”或“混合物”)。可将 Cu2(OH)2CO3表示为 2CuO·xCO2·H2O,其中 x 的数值为。
②将孔雀石粉碎后放入炼炉内,上面覆盖适量木炭,生火后鼓风至火候足够,可得精炼铜液(冷却为初铜)。反应过程中需将木炭适度“架空”,其目的是。
③得到的初铜经提炼、融合(加入金属锡、铅)成青铜。该青铜(填“属于”或“不属于”)合金。
(2)、春秋战国时期铁器已开始使用,可通过下列方法获得。
①将铁矿石与煤炭进行熔炼,流出的铁水冷凝后即为生铁。高温时赤铁矿(主要含 Fe2O3)与 CO 发生反应的化学方程式是。
②将生铁于高温下反复捶打可得到钢。根据下表,从物质组成角度,分析此法炼钢的主要原理是。
生铁
钢
含碳量%
2~4.3
0.03~2
(3)、沿海地区使用天然牡蛎壳等代替石灰石,煅烧成“灰”的同时产生二氧化碳。①煅烧时发生反应的类型是。
②此“灰”淋水后可用作船只和墙缝的填缝剂,该填缝剂的化学式是 , 在空气中最终转化为。
23. 氢能是一种“绿色”能源,其制取与储存是氢能综合利用的关键点。(1)、氢气的制取①电解水可制取氢气,装置如图所示,常温下 a 管内气体的体积是 10 mL,b 管内气体的化学式是。

②经测量,b 管内气体的体积略小于理论值。可能的原因是(填序号)
A.常温下 H2的溶解度小于 O2的溶解度
B.b 管内产生了 O3
C.水槽中 KOH 的浓度偏小,导致溶液导电能力偏弱
③催化剂条件下,可利用太阳能分解水来制取氢气。与电解水制取氢气相比,从能量的角度,分析该方法制取氢气的优点是。
(2)、水热分解可得氢气。高温下水分解体系中微粒含量与温度的关系如图所示。
已知:
①温度低于 2000℃时,体系内 H2O 含量没有改变,其原因是。
②曲线 A、B 对应的微粒是原子,曲线 A 对应的微粒是(填化学式)。
③从元素守恒角度分析,曲线 A、B 所对应原子的个数比是。
(3)、氢气的储存①一种镁铜合金可用于储氢。将镁、铜单质按质量比为 3∶4 的比例在一定温度下熔炼得到镁铜合金。该镁铜合金的化学式是。
②该镁铜合金完全吸氢后所得混合物与过量盐酸充分反应,整个过程中释放出 H2的量应为的之和。
三、综合题
-
24. CO2的资源化利用能有效减少CO2排放,充分利用碳资源。(1)、“碳循环”为生态系统的正常运转提供可靠的资源保障,循环过程中 CO2起着非常重要的作用,其转化关系如图所示:

①光合作用可以实现 CO2的固定,光合作用主要是将光能转化为能
②有机物 A 燃烧的方程式为。A 的化学式为。
③CO2的水溶液能使紫色石蕊试液变红,其原因是过程中生成了(写化学式)。
(2)、CaO可在较高温度下捕集CO2 , 在更高温度下将CO2释放。①CaO 在捕集 CO2时,当 CaO 剩余 40%时,捕集能力明显降低,主要原因是。
②写出 CO2释放时反应的化学方程式:。
(3)、CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化如图所示。已知:CaC2O4·H2O的相对分子质量为146。
①400~600 ℃时释放出气体的化学式为。欲使 CaC2O4·H2O 全部分解生成 CaO,需要控制的条件是。
②相同温度和压强时,分别向含CO2的密闭体系中加入不同方法制备的CaO固体,捕集一定量的CO2所需的时间如下表:
反应所需的时间
10 g CaO(热分解 CaCO3制备)
10 g CaO(热分解 CaC2O4·H2O 制备)
吸收 1 g CO2
15 秒
7 秒
吸收 5 g CO2
45 秒
23 秒
吸收 10 g CO2
132 秒
68 秒
由上表可知:由热分解CaC2O4·H2O制备的CaO具有更好的CO2捕集性能,其可能的原因是。
(4)、石灰厂煅烧石灰石生产 CaO,若要得到 28 t CaO,则至少需要含 CaCO3 90%的石灰石多少吨?(写出计算过程,保留一位小数。)25. 以菱镁矿(主要成分为 MgCO3 , 含少量 FeCO3)为原料制备高纯 MgO,流程如下:
已知:
(1)、“溶解”时,MgCO3与稀硫酸反应的化学方程式为。(2)、“转化”过程中,FeSO4转化率随反应温度的变化关系如图所示。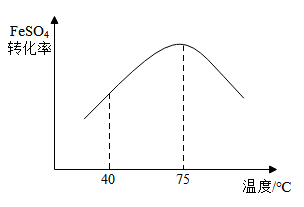
①40~ 75℃范围内,随着温度的升高,FeSO4转化率增大的原因可能是。
②温度大于 75℃,随着温度的升高,FeSO4转化率减小。某同学猜想其主要原因是 H2O2 受热分解,请设计实验证明该同学的猜想:。
(3)、“调 pH”时,溶液 pH 不宜过大。其原因除 pH 过大将增加氨水的使用量,还可能的是。(4)、某兴趣小组探究“煅烧”时 MgSO4与 C 的反应,实验装置如图所示。
①“煅烧”时,装置甲发生了某个反应,该反应生成 3 种氧化物。装置乙中 KMnO4溶液褪色,装置丙中澄清石灰水变浑。装置甲发生反应的化学方程式是。
②经检验,500℃下加热装置甲中反应后的固体,可得到一种只含硫且相对分子质量为 192 的气体。该气体的化学式是。
③反应后,测量装置乙溶液中的含量的测定,请补充完整实验方案:取适量反应后装置乙中的液体, , 过滤、、干燥,得一定质量的 BaSO4沉淀。(须使用的试剂有:BaCl2溶液、蒸馏水)