江苏省无锡市经开区2023年中考一模化学试题
试卷更新日期:2023-05-04 类型:中考模拟
一、单选题
-
1. 无锡正走在生态优先,绿色发展的道路上。下列选项有利于保护环境的是( )A、深埋电池 B、焚烧秸秆 C、禁用农药 D、回收塑料2. 防火胜于救灾,下列标识与消防安全无关的是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列过程涉及化学变化的是( )A、氧气液化 B、冰雪消融 C、干冰升华 D、汽油燃烧4. 下列物质的俗名与化学式对应关系正确的是( )A、熟石灰:CaO B、苏打:Na2CO3 C、烧碱:NaHCO3 D、纯碱:NaOH5. 下列化学用语与含义不相符的是( )A、O2- ——氧离子 B、2H+ ——2个氢离子 C、Cl2 ——2个氯原子 D、2NH3 ——2个氨分子6. 无锡特色美食酱排骨中所含的主要营养素是( )A、蛋白质 B、脂肪 C、维生素 D、矿物质7. 有关如图试剂的描述正确的是( )
3. 下列过程涉及化学变化的是( )A、氧气液化 B、冰雪消融 C、干冰升华 D、汽油燃烧4. 下列物质的俗名与化学式对应关系正确的是( )A、熟石灰:CaO B、苏打:Na2CO3 C、烧碱:NaHCO3 D、纯碱:NaOH5. 下列化学用语与含义不相符的是( )A、O2- ——氧离子 B、2H+ ——2个氢离子 C、Cl2 ——2个氯原子 D、2NH3 ——2个氨分子6. 无锡特色美食酱排骨中所含的主要营养素是( )A、蛋白质 B、脂肪 C、维生素 D、矿物质7. 有关如图试剂的描述正确的是( ) A、该试剂可使纸张炭化 B、该试剂可用作干燥剂 C、溶质与溶剂的质量比是37∶100 D、打开该试剂瓶,瓶口会出现白雾8. 最接近中性的洗涤剂是( )A、洁厕剂:pH =1.0 B、洗发露:pH =7.6 C、洗衣液:pH =10.5 D、漂白液:pH =13.49. 下列有关物质的性质与用途对应关系正确的是( )A、盐酸有挥发性,可用于金属除锈 B、干冰升华吸热,可用于人工降雨 C、氧气有助燃性,可作高能燃料 D、石墨有滑腻感,可用作电池电极10. 实验室量取2mL氢氧化钠溶液倒入试管中,滴加硫酸铜溶液与之充分反应后加热,部分操作如下,其中操作规范的是( )A、读取体积
A、该试剂可使纸张炭化 B、该试剂可用作干燥剂 C、溶质与溶剂的质量比是37∶100 D、打开该试剂瓶,瓶口会出现白雾8. 最接近中性的洗涤剂是( )A、洁厕剂:pH =1.0 B、洗发露:pH =7.6 C、洗衣液:pH =10.5 D、漂白液:pH =13.49. 下列有关物质的性质与用途对应关系正确的是( )A、盐酸有挥发性,可用于金属除锈 B、干冰升华吸热,可用于人工降雨 C、氧气有助燃性,可作高能燃料 D、石墨有滑腻感,可用作电池电极10. 实验室量取2mL氢氧化钠溶液倒入试管中,滴加硫酸铜溶液与之充分反应后加热,部分操作如下,其中操作规范的是( )A、读取体积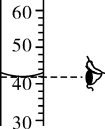 B、滴加硫酸铜溶液
B、滴加硫酸铜溶液 C、振荡试管
C、振荡试管 D、加热
D、加热 11. 分类是化学学习的重要方法,下列物质分类正确的是( )A、Si、C60属于单质 B、CO、CO(NH2)2属于有机物 C、CuO、KClO3属于氧化物 D、NH4NO3、HNO3属于酸12. 锡在元素周期表中的信息如图所示。下列有关锡的说法正确的是( )
11. 分类是化学学习的重要方法,下列物质分类正确的是( )A、Si、C60属于单质 B、CO、CO(NH2)2属于有机物 C、CuO、KClO3属于氧化物 D、NH4NO3、HNO3属于酸12. 锡在元素周期表中的信息如图所示。下列有关锡的说法正确的是( )
 A、x=18 B、锡属于非金属元素 C、锡原子的中子数一定为50 D、锡的相对原子质量是118.7g13. 科学家发现:利用催化剂可有效消除严重危害人体健康的甲醛(CH2O),反应原理的微观示意图如下图所示,据图分析不能得到的结论是( )
A、x=18 B、锡属于非金属元素 C、锡原子的中子数一定为50 D、锡的相对原子质量是118.7g13. 科学家发现:利用催化剂可有效消除严重危害人体健康的甲醛(CH2O),反应原理的微观示意图如下图所示,据图分析不能得到的结论是( ) A、反应生成两种氧化物 B、分子在化学变化中可再分 C、反应前后分子数目发生改变 D、参加反应的甲与乙的质量比为15:1614. 在给定条件下,下列物质间的转化能一步实现的是( )A、FeFeCl3 B、CuOCuSO4 C、KMnO4→O2 D、Na2CO3NaCl15. 水是一切生命生存所必需的物质。下列有关水的说法正确的是( )A、水由氢气和氧气组成 B、正常雨水一般显中性 C、水分子是保持水化学性质的最小粒子 D、硬水经活性炭处理可以转化为软水16. 如图是硫及其化合物的价、类关系图。下列说法错误的是( )
A、反应生成两种氧化物 B、分子在化学变化中可再分 C、反应前后分子数目发生改变 D、参加反应的甲与乙的质量比为15:1614. 在给定条件下,下列物质间的转化能一步实现的是( )A、FeFeCl3 B、CuOCuSO4 C、KMnO4→O2 D、Na2CO3NaCl15. 水是一切生命生存所必需的物质。下列有关水的说法正确的是( )A、水由氢气和氧气组成 B、正常雨水一般显中性 C、水分子是保持水化学性质的最小粒子 D、硬水经活性炭处理可以转化为软水16. 如图是硫及其化合物的价、类关系图。下列说法错误的是( ) A、a点表示的物质所属类别是单质 B、b点表示的物质常温下是无色无味的气体 C、c点表示的物质是H2SO4 D、d点表示的物质中含有的阴离子可能是17. 下列实验方案不能达到实验目的的是( )
A、a点表示的物质所属类别是单质 B、b点表示的物质常温下是无色无味的气体 C、c点表示的物质是H2SO4 D、d点表示的物质中含有的阴离子可能是17. 下列实验方案不能达到实验目的的是( )选项
实验目的
实验方案
A
鉴别木炭粉和铁粉
在氧气中灼烧
B
除去KCl固体中的KClO3
加热加入适量MnO2
C
提纯含有少量NaCl的KNO3
加水溶解,加热浓缩,冷却结晶后过滤
D
证明甲烷中含有氢元素
点燃甲烷,在火焰上方罩一个干冷的烧杯
A、A B、B C、C D、D18. 两种固体物质NaCl和KCl的溶解度曲线如图所示,现有40gNaCl、40gKCl两份固体,分别置于两只烧杯中,各倒入100g50℃蒸馏水充分溶解,实验现象如下图所示,下列推断正确的是( ) A、甲中加入的固体是NaCl B、乙中溶液的质量是140g C、50℃时,甲中溶液恰好达到饱和状态 D、分别将甲、乙中的溶液降温至10℃,乙中溶质的质量分数大于甲中溶质的质量分数19. 利用pH传感器和温度传感器对稀盐酸与氢氧化钠的反应进行探究,获得pH—质量图像和温度—质量图像。下列说法正确的是( )
A、甲中加入的固体是NaCl B、乙中溶液的质量是140g C、50℃时,甲中溶液恰好达到饱和状态 D、分别将甲、乙中的溶液降温至10℃,乙中溶质的质量分数大于甲中溶质的质量分数19. 利用pH传感器和温度传感器对稀盐酸与氢氧化钠的反应进行探究,获得pH—质量图像和温度—质量图像。下列说法正确的是( ) A、X溶液为稀盐酸 B、加入30gX溶液时,两者恰好完全反应 C、从A点到B点温度下降,说明该反应吸热 D、B点对应的溶液中,溶质为NaCl20. 将一定量的锌铁混合物放入足量的硫酸铜溶液中,充分反应后过滤,滤渣质量等于原混合物的质量,那么原混合物中锌与铁的质量比是( )A、65:56 B、56:65. C、7:65 D、65:7
A、X溶液为稀盐酸 B、加入30gX溶液时,两者恰好完全反应 C、从A点到B点温度下降,说明该反应吸热 D、B点对应的溶液中,溶质为NaCl20. 将一定量的锌铁混合物放入足量的硫酸铜溶液中,充分反应后过滤,滤渣质量等于原混合物的质量,那么原混合物中锌与铁的质量比是( )A、65:56 B、56:65. C、7:65 D、65:7二、填空题
-
21. 人类使用材料、能源的历史源远流长。明长城城墙中发现了糯米的成分,古代工匠使用具有超强粘合力的“糯米灰浆”粘合墙体。糯米中含糖类、蛋白质、脂肪、钙、铁、维生素等。(1)、糯米成分中的钙、铁指的是(填序号)。
a. 单质 b. 元素 c. 原子 d. 分子
(2)、下列选项中的物质,不能为人体提供能量的是 (填字母)。a. 糖类 b. 蛋白质 c. 脂肪 d. 维生素
(3)、淀粉占糯米质量的75%-80%,化学式可表示为(C6H10O5)n。淀粉中碳、氢元素质量比为。22. 人类使用材料、能源的历史源远流长。新材料的发展与应用促进了人类社会的进步。碳晶地暖环保、节能、安全,其构造如图所示。 (1)、图中材料属于有机合成材料的是。(2)、铝表面会形成致密的氧化膜,其化学式是。(3)、人类发现并使用金属的时间先后顺序依次是Au、Ag、Cu、Fe,请从金属单质性质的角度分析其原因可能是。23. 人类使用材料、能源的历史源远流长。天然气(主要成分CH4)已走入千家万户,成为家庭主要燃料。如图是家用燃气热水器的工作原理示意图。
(1)、图中材料属于有机合成材料的是。(2)、铝表面会形成致密的氧化膜,其化学式是。(3)、人类发现并使用金属的时间先后顺序依次是Au、Ag、Cu、Fe,请从金属单质性质的角度分析其原因可能是。23. 人类使用材料、能源的历史源远流长。天然气(主要成分CH4)已走入千家万户,成为家庭主要燃料。如图是家用燃气热水器的工作原理示意图。 (1)、充分燃烧的化学方程式是。(2)、家用天然气中加入有恶臭味的乙硫醇气体,目的是。(3)、若“空气进气孔”被部分堵塞,可能产生的有毒气体是。
(1)、充分燃烧的化学方程式是。(2)、家用天然气中加入有恶臭味的乙硫醇气体,目的是。(3)、若“空气进气孔”被部分堵塞,可能产生的有毒气体是。三、综合题
-
24. 利用下列装置完成气体制取的实验。
 (1)、仪器b的名称是。(2)、用石灰石和稀盐酸制取二氧化碳,反应的化学方程式是 , 为能随时控制反应的发生和停止,应选择的发生装置是 , 用C装置收集二氧化碳,气体应从(填“m”或“n”)口进。(3)、便携式制氧机可用于家庭供氧,工作原理如装置D所示。甲剂为白色固体过碳酸钠,乙剂为黑色固体二氧化锰。将甲剂和乙剂加入反应仓,并加入适量水,第一步反应是过碳酸钠分解生成碳酸钠和过氧化氢,第二步反应的化学方程式是。(4)、便携式制氧机在夏天使用时,反应仓内要适当多加入水,原因是。25. 阅读科普短文,回答问题。
(1)、仪器b的名称是。(2)、用石灰石和稀盐酸制取二氧化碳,反应的化学方程式是 , 为能随时控制反应的发生和停止,应选择的发生装置是 , 用C装置收集二氧化碳,气体应从(填“m”或“n”)口进。(3)、便携式制氧机可用于家庭供氧,工作原理如装置D所示。甲剂为白色固体过碳酸钠,乙剂为黑色固体二氧化锰。将甲剂和乙剂加入反应仓,并加入适量水,第一步反应是过碳酸钠分解生成碳酸钠和过氧化氢,第二步反应的化学方程式是。(4)、便携式制氧机在夏天使用时,反应仓内要适当多加入水,原因是。25. 阅读科普短文,回答问题。氮气(N2)是空气中含量丰富的一种组分,与人类生活有何关联呢?
N2与食品行业:N2作为保护气,广泛应用于食品行业。在大型粮仓内充入,既能使仓内噬食粮食的小动物窒息死亡,又能抑制粮食本身的呼吸作用,延长其保存期。在一定程度上,还具有防止发生火灾的作用。
N2与农业生产:氮元素是植物生长所需的营养元素之一、民间俗语“雷雨发庄稼”,是指在雷电环境下空气中的N2能转变为含氮的化学肥料,其主要过程示意图如下图:

N2与光伏新材料:高纯N2被离子化后。通过氮离子束溅射技术,以高纯石墨为靶材可以沉积出光伏材料氮化碳薄膜,氮化碳薄膜中碳、氮元素的质量分数与氮离子束能量的关系如下图:

N2与环境治理:化石燃料中通常含有氮元素,直接燃烧会产生大量氮氧化合物。氮氧化合物不仅能形成酸而从而严重危害人体健康和生态环境,而且能与碳氢化合物在一定条件下反应生成有毒的光化学烟雾。利用N2合成氯可有效吸收氮氧化合物,从而实现无污染排放。
随着科技的进步,N2的用途将更加广泛。
(1)、应用于食品行业作保护气,体现了N2的化学性质是。(2)、雷电环境下N2转变为化学肥料的主要过程中,涉及到氮元素的种化合价。步骤③反应中会生成HNO3 和NO,该反应的化学方程式是。(3)、氮化碳薄膜中氮元素质量分数与氮离子束能量的关系为。(4)、下列说法正确的是 (填序号)。a.是空气中含量最多的气体
b.大型粮仓内也可以充入 作保护气
c.氮氧化合物转变为光化学烟雾的过程属于物理变化
26. 湿法炼锌过程中的净化钴液中含有Zn、Co、Cu和Fe的单质及Zn(OH)2 , 可利用过硫酸钠氧化水解法实现钴的富集,同时分别回收锌、铜和铁元素,工艺流程如下:
资料1.钴的金属活动性与铁相似。
资料2.该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
金属离子
Fe3+
Fe2+
Co2+
开始沉淀的pH
1.9
7.5
7.7
沉淀完全的pH
3.2
9.0
9.2
(1)、工艺流程中“酸浸”“除铁”“沉钴”都需要进行的操作是。(2)、“酸浸”中发生酸碱中和反应的化学方程式是 , 浸渣的主要成分为。(3)、“除铁”过程中会发生分步反应2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2X,X的化学式是 , 该过程需要控制溶液的pH范围是。(4)、上述流程中 (填序号)可返回湿法炼锌系统,提高锌的利用率.a.浸渣 b.滤渣I c.滤液II d.滤渣III
27. 化学兴趣小组同学利用下列装置对氢气的制取和性质进行了实验探究。
资料:无水硫酸铜是白色固体,遇到水会变蓝。
氢气的制取
(1)、连接装置并检查装置气密性后,关闭 K1、K2和K3。在注射器中分别加入锌粒和稀硫酸,打开阀门K1、K2 , 将稀硫酸注入注射器2中,该反应的化学方程式是。(2)、利用装置A制取氢气的优点是。(3)、关闭K1 , 打开K3 , 固定注射器2,通一会氢气目的是。(4)、点燃酒精灯,一段时间后,观察到a处现象是 , 证明氢气具有性。(5)、无水硫酸铜变蓝,证明反应中有水生成。M处加入的试剂是。28. 海洋是生命的摇篮,浩瀚的海洋是一个巨大的宝库,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。(1)、I.海水提取粗盐
氯化钠在海水中的分散微粒是(填微粒符号)。
(2)、从贮水池到蒸发池,氯化钠的质量分数(填“变大”“变小”或“不变”)。(3)、II.粗盐提纯可以采用物理和化学方法除去粗盐中的MgCl2、CaCl2和Na2SO4等可溶性杂质。
物理方法:用NaCl溶液浸洗粗盐,溶解其中的可溶性杂质,则浸洗溶液应选用NaCl的(填“饱和”或“不饱和”)溶液。
(4)、化学方法:操作步骤依次为:加水溶解→加过量NaOH溶液→加过量试剂①→加过量Na2CO3→过滤→加适量盐酸,试剂①是(填化学式)溶液,过滤后滤渣主要成分有Mg(OH)2、CaCO3及(写出全部成分)。(5)、III.侯氏制碱我国科学家侯德榜为我国纯碱和氮肥工业技术的发展做出了杰出的贡献。如图是侯氏联合制碱法和西方索尔维制碱法的工艺流程。(已知.NH4ClNH3↑+HCl↑

利用碳酸氢钠热解生产纯碱反应的基本类型是。
(6)、精盐水中先通入NH3 , 后通入CO2发生“碳酸化”反应的化学方式是。(7)、我国化学家侯德榜创立的联合制碱法的优点有。a.无“索尔维氨碱法”中的废弃物CaCl2生成,有利于保护环境
b.大大提高了食盐的利用率,节约了成本
c.析出的晶体可用作复合肥,提高了原料的利用率
(8)、用“侯氏联合制碱法”制得碳酸钠常含有少量氯化钠。为测定某样品中碳酸钠含量,小明称取该碳酸钠样品11g溶解于水中,加入足量氯化钙溶液,经过滤、洗涤、干燥后得沉淀质量为10g。求:该样品中碳酸钠的质量分数。(写出具体计算过程,结果精确到0.1%)。