吉林省长春市汽开区2023年中考一模化学试题
试卷更新日期:2023-05-04 类型:中考模拟
一、单选题
-
1. 下列四季更替中的变化,属于化学变化的是( )A、春一冰雪融化 B、夏一花香四溢 C、秋一落英缤纷 D、冬一燃煤取暖2. 下列物质属于纯净物的是( )A、五氧化二磷 B、大理石 C、自来水 D、食醋3. 下列物质加入水中,不能形成溶液的是( )A、白糖 B、花生油 C、食盐 D、味精4. 下列实验操作正确的是( )A、
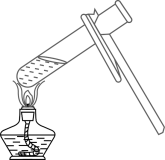 加热液体
B、
加热液体
B、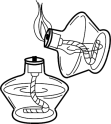 点燃酒精灯
C、
点燃酒精灯
C、 测溶液的pH
D、
测溶液的pH
D、 稀释浓硫酸
5. 扑热息痛是一种家庭常备药物,具有解热镇痛的功效。其主要成分的化学式为C8H9NO2 , 下列有关该物质的说法中错误的是( )A、C8H9NO2表示一个分子 B、由碳、氢、氧、氮四种元素组成 C、四种元素的质量比为8:9:1:2 D、该物质属于有机物6. 下列对物质的归纳、分类正确的一组是( )A、一氧化碳、甲烷是常见的燃料 B、塑料、蚕丝是常见的合成材料 C、纯碱、生石灰是常见的干燥剂 D、蛋白质、纤维素是常见的营养素7. “水循环”、“氧循环”和“碳循环”是自然界存在的三大重要循环。下列说法正确的( )A、变化观:自然界的水循环过程中,水分子一定发生改变 B、守恒观:碳、氧循环过程中各元素守恒,其化合价不变 C、平衡观:碳、氧循环有利于维持大气中O2和CO2含量的相对稳定 D、微粒观:绿色植物的作用是使自然界中的氧原子总数增加8. 科学家在积极寻找洁净的新能源过程中,发现了氨气燃烧能释放出大量的热且产物对环境没有污染,其反应的微观示意图如下,有关该反应的说法错误的是( )
稀释浓硫酸
5. 扑热息痛是一种家庭常备药物,具有解热镇痛的功效。其主要成分的化学式为C8H9NO2 , 下列有关该物质的说法中错误的是( )A、C8H9NO2表示一个分子 B、由碳、氢、氧、氮四种元素组成 C、四种元素的质量比为8:9:1:2 D、该物质属于有机物6. 下列对物质的归纳、分类正确的一组是( )A、一氧化碳、甲烷是常见的燃料 B、塑料、蚕丝是常见的合成材料 C、纯碱、生石灰是常见的干燥剂 D、蛋白质、纤维素是常见的营养素7. “水循环”、“氧循环”和“碳循环”是自然界存在的三大重要循环。下列说法正确的( )A、变化观:自然界的水循环过程中,水分子一定发生改变 B、守恒观:碳、氧循环过程中各元素守恒,其化合价不变 C、平衡观:碳、氧循环有利于维持大气中O2和CO2含量的相对稳定 D、微粒观:绿色植物的作用是使自然界中的氧原子总数增加8. 科学家在积极寻找洁净的新能源过程中,发现了氨气燃烧能释放出大量的热且产物对环境没有污染,其反应的微观示意图如下,有关该反应的说法错误的是( ) A、该反应是置换反应 B、该反应前后分子个数没有变化 C、反应前后原子种类和数目都不变 D、反应物和生成物中只有一种氧化物9. 下列对实验结果分析正确的是( )A、测定空气里氧气含量时,若装置漏气,会导致测定结果偏高 B、除去粗盐中难溶性杂质的过程中,若蒸发时液体溅出,会导致产率偏低 C、验证质量守恒定律时,若不采用密闭装置,一定会导致反应前后质量总和不相等 D、配制一定溶质质量分数的溶液,若装瓶时洒出一部分,会导致溶质质量分数变小10. 下列实验操作不能达到实验目的的是( )
A、该反应是置换反应 B、该反应前后分子个数没有变化 C、反应前后原子种类和数目都不变 D、反应物和生成物中只有一种氧化物9. 下列对实验结果分析正确的是( )A、测定空气里氧气含量时,若装置漏气,会导致测定结果偏高 B、除去粗盐中难溶性杂质的过程中,若蒸发时液体溅出,会导致产率偏低 C、验证质量守恒定律时,若不采用密闭装置,一定会导致反应前后质量总和不相等 D、配制一定溶质质量分数的溶液,若装瓶时洒出一部分,会导致溶质质量分数变小10. 下列实验操作不能达到实验目的的是( )选项
实验目的
实验操作
A
除去N2中混有的少量O2
将混合气体通过灼热的铜网
B
除去铜粉中的铁粉
加入足量的稀盐酸,过滤、洗涤、干燥
C
除去KCl固体中少量MnO2
加入足量的水溶解,过滤、蒸发结晶
D
除去NaOH溶液中的Na2CO3
加入足量的稀盐酸
A、A B、B C、C D、D二、填空题
-
11. 用化学用语回答下列问题:(1)、碳元素的符号为。(2)、2个氮分子表示为。(3)、碳酸根离子可表示为。12. 制作景泰蓝的釉料中常含钴元素。钴元素在元素周期表中的信息如下图。回答下列问题:
 (1)、钴的原子序数是。(2)、钴元素属于(填“金属”或“非金属”)元素。(3)、钴元素的相对原子质量为。13. 伊通河作为长春市的母亲河,孕育了长春数百年的独特文脉和生命给养。某学习小组对河水产生了浓厚的探究欲望。按要求回答问题:(1)、验水:向水样中加入肥皂水,发现产生了大量的浮渣,说明该水为。(2)、净水:过程中可利用(填物质名称)来吸附、过滤水中的杂质。(3)、探水:将净化后的水进行电解,通过观察现象,得出结论:水是由组成的。(4)、节水:写出一项家庭节水的具体措施。14. 某化学兴趣小组每隔几分钟测一次刚降落的雨水的pH,数据如下。回答下列问题:
(1)、钴的原子序数是。(2)、钴元素属于(填“金属”或“非金属”)元素。(3)、钴元素的相对原子质量为。13. 伊通河作为长春市的母亲河,孕育了长春数百年的独特文脉和生命给养。某学习小组对河水产生了浓厚的探究欲望。按要求回答问题:(1)、验水:向水样中加入肥皂水,发现产生了大量的浮渣,说明该水为。(2)、净水:过程中可利用(填物质名称)来吸附、过滤水中的杂质。(3)、探水:将净化后的水进行电解,通过观察现象,得出结论:水是由组成的。(4)、节水:写出一项家庭节水的具体措施。14. 某化学兴趣小组每隔几分钟测一次刚降落的雨水的pH,数据如下。回答下列问题:测定时刻
5:05
5:10
5:15
5:20
pH
4.95
4.94
4.88
4.86
(1)、所降雨水酸雨(填“是”或“不是”)。(2)、在测定的期间内,雨水的酸性(填“增强”或“减弱”)。(3)、经调查,这一地区有一家硫酸厂,导致该地区土壤呈酸性。该小组同学经过讨论认为最好选用以下试剂来改良这种土壤(填序号)。①工业盐酸 ②熟石灰 ③烧碱
三、综合题
-
15. 如图是碳元素的“价类二维图”,横坐标为物质的类别,纵坐标为化合价。图中A、B、D、E、F分别表示不同的物质。回答下列问题:
 (1)、A是天然气的主要成分,A的化学式为。(2)、B对应的单质有多种,写出其中一种的名称。(3)、要实现D转化为E,除了通过化合反应,还可以通过(用化学方程式表示)实现。(4)、“碳中和”主要是指抵消温室气体的排放量,实现正负抵消,达到相对“零排放”。下列说法与上述理念相符的是____(填序号)。A、大力植树造林 B、捕集、利用和封存CO2 C、提倡使用一次性餐具 D、出行尽量选择步行或乘坐公交、地铁16. 下表是氯化钠和氯化钾在不同温度时的溶解度。
(1)、A是天然气的主要成分,A的化学式为。(2)、B对应的单质有多种,写出其中一种的名称。(3)、要实现D转化为E,除了通过化合反应,还可以通过(用化学方程式表示)实现。(4)、“碳中和”主要是指抵消温室气体的排放量,实现正负抵消,达到相对“零排放”。下列说法与上述理念相符的是____(填序号)。A、大力植树造林 B、捕集、利用和封存CO2 C、提倡使用一次性餐具 D、出行尽量选择步行或乘坐公交、地铁16. 下表是氯化钠和氯化钾在不同温度时的溶解度。温度/℃
0
20
40
60
80
溶解度/g
NaCl
35.7
36.0
36.6
37.3
38.4
KCl
27.6
34.0
40.0
45.5
51.1
(1)、20℃时,氯化钠的溶解度为g。(2)、20℃时,将20g氯化钠固体加入到50g水中,充分溶解,所得氯化钠溶液的质量为g。(3)、同学们按下图所示进行实验,得到A、B、C三种溶液,C中析出的氯化钾固体质量为g;A、B、C三种溶液中溶质质量分数由小到大的顺序为(用字母表示)。 17. 某实验小组用质量分数为6%的氯化钠溶液和水(密度约为1g/cm3),配制50g质量分数为3%的氯化钠溶液,回答下列问题:(1)、实验的主要步骤有、量取、混匀、装瓶贴标签。(2)、需要量取水的体积为mL。(3)、实验中用到的玻璃仪器有量筒、胶头滴管、试剂瓶、。(4)、若用量筒量取水时仰视读数,其他操作均正确,则所得溶液的溶质质量分数(填“变大”、“变小”或“不变”)。18. 下图是实验室制取气体的常用装置,回答下列问题:
17. 某实验小组用质量分数为6%的氯化钠溶液和水(密度约为1g/cm3),配制50g质量分数为3%的氯化钠溶液,回答下列问题:(1)、实验的主要步骤有、量取、混匀、装瓶贴标签。(2)、需要量取水的体积为mL。(3)、实验中用到的玻璃仪器有量筒、胶头滴管、试剂瓶、。(4)、若用量筒量取水时仰视读数,其他操作均正确,则所得溶液的溶质质量分数(填“变大”、“变小”或“不变”)。18. 下图是实验室制取气体的常用装置,回答下列问题: (1)、仪器a的名称是。(2)、实验室用氯酸钾和二氧化锰制取氧气,选择装置A作为发生装置,考虑的因素是(填序号)。
(1)、仪器a的名称是。(2)、实验室用氯酸钾和二氧化锰制取氧气,选择装置A作为发生装置,考虑的因素是(填序号)。①反应物的状态 ②气体的性质 ③反应条件
(3)、若用盛满水的装置F收集氧气,气体应从导管(填“b”或“c”)通入。(4)、若用装置B、C组合制取氧气,写出对应的化学反应方程式。19. 小艾同学以稀硫酸为主题,绘制的“多彩酸世界”思维导图如下。结合图示信息回答有关问题: (1)、若想实现①,需要加入的试剂是(填名称)。(2)、若用Cu(OH)2实现②,会得到色溶液。(3)、若想实现③,得到浅绿色溶液,选用的单质是(填物质名称)。(4)、若想实现④,得到黄色溶液,可选用的金属氧化物是(填化学式)。(5)、若选用BaCl2溶液实现⑤,此反应的化学方程式为。20. 纯碱是一种重要的化工原料,广泛用于玻璃、造纸、纺织等工业生产。某化学兴趣小组对纯碱的制备和性质开展项目式学习。(1)、任务一 了解纯碱的制备—“侯氏制碱法”涉及的主要化学反应有:
(1)、若想实现①,需要加入的试剂是(填名称)。(2)、若用Cu(OH)2实现②,会得到色溶液。(3)、若想实现③,得到浅绿色溶液,选用的单质是(填物质名称)。(4)、若想实现④,得到黄色溶液,可选用的金属氧化物是(填化学式)。(5)、若选用BaCl2溶液实现⑤,此反应的化学方程式为。20. 纯碱是一种重要的化工原料,广泛用于玻璃、造纸、纺织等工业生产。某化学兴趣小组对纯碱的制备和性质开展项目式学习。(1)、任务一 了解纯碱的制备—“侯氏制碱法”涉及的主要化学反应有:I.
Ⅱ.
下列有关“侯氏制碱法”的说法中错误的是(填字母代号)。
A.反应I中生成物X的化学式为NH4Cl
B.“侯氏制碱法”中的“碱”指的氢氧化钠
C.NaHCO3受热易分解
D.二氧化碳可以循环使用
(2)、任务二 探究Na2CO3溶液呈碱性的原因【查阅资料】1 溶液呈碱性,是因为溶液中存在较多的OH-。
2 Na2CO3在水中全部解离出Na+和CO32-。
3 CaCl2溶液呈中性,Ca2+、Cl-对溶液的碱性没有影响
【提出猜想】猜想一:H2O单独起作用,产生较多的OH- , 使溶液呈碱性。
猜想二:Na+与H2O作用,产生较多的OH- , 使溶液呈碱性。
猜想三:。
(3)、【实验探究】序号
实验操作
实验现象
实验结论
1
向盛有蒸馏水的试管滴入2滴酚酞溶液
溶液无明显变化
。
2
向盛有NaCl溶液的试管滴入2滴酚酞溶液
。
猜想二不成立
3
向盛有Na2CO3溶液的试管滴入2滴酚酞溶液
溶液由无色变红色
猜想三成立
4
向实验3所得的溶液中逐滴加入CaCl2溶液至过量
。
【解释与结论】经与老师交流得知:Na2CO3溶液中部分和H2O作用,产生较多的OH-和另一种阴离子。
(4)、任务三 验证Na2CO3与酸的反应小组同学取Na2CO3和NaHCO3固体混合物,充分加热至固体质量不再改变,冷却至室温后,向其中加入100g质量分数为7.3%的盐酸恰好完全反应。则原固体混合物中含钠元素的质量为g。