浙江省嘉兴市2022-2023学年高三下学期二模化学试题
试卷更新日期:2023-04-26 类型:高考模拟
一、单选题
-
1. 含有非极性键的共价化合物是A、 B、 C、 D、2. 是一种高效水处理剂,下列说法中错误的是A、溶液属于强电解质 B、有强氧化性 C、该物质中Fe元素被还原后的产物可能发生水解 D、Fe元素位于元素周期表VIII族3. 下列化学用语表示正确的是A、中子数为16的磷原子: B、羟基的电子式:
 C、的VSEPR模型:
C、的VSEPR模型: (平面三角形)
D、基态最高能级的电子云轮廓图:
(平面三角形)
D、基态最高能级的电子云轮廓图: 4. 物质的性质决定用途,下列两者对应关系错误的是A、能与酸反应,可用作抗胃酸药 B、受热易分解,可用作冷敷袋的主要物质 C、Al还原性比Fe强,Al和能发生铝热反应得到Fe D、易结合水变成蓝色晶体,可用来检验水5. 下列关于元素及其化合物的性质说法错误的是A、K和苯酚反应可生成 B、工业上用在中燃烧生产HCl C、生铁降低含碳量生产碳素钢 D、工业上用焦炭还原石英砂制备纯硅6. 关于反应 , 下列说法正确的是A、该反应的氧化剂是硝酸钾 B、生成标准状况下2.24L , 反应共转移1mol电子 C、氧化产物与还原产物的物质的量之比为3∶1 D、电负性:O>N>C>K7. 下列离子方程式正确的是A、向碘化亚铁溶液中滴加少量稀硝酸: B、向中加入: C、用足量溶液吸收氯气: D、由水电离的的溶液中滴加少量溶液:8. 下列说法错误的是A、乙烯是无色、无味的气态烃,能使酸性褪色 B、蚕丝织成的丝绸灼烧时会产生烧焦羽毛气味 C、新鲜土豆片中含有淀粉,遇碘水出现蓝色 D、DNA分子的双螺旋结构中,两条链上的碱基通过氢键作用实现配对9. 乙酸异丁香酚酯是一种食用香料,其结构简式如图所示,下列说法正确的是
4. 物质的性质决定用途,下列两者对应关系错误的是A、能与酸反应,可用作抗胃酸药 B、受热易分解,可用作冷敷袋的主要物质 C、Al还原性比Fe强,Al和能发生铝热反应得到Fe D、易结合水变成蓝色晶体,可用来检验水5. 下列关于元素及其化合物的性质说法错误的是A、K和苯酚反应可生成 B、工业上用在中燃烧生产HCl C、生铁降低含碳量生产碳素钢 D、工业上用焦炭还原石英砂制备纯硅6. 关于反应 , 下列说法正确的是A、该反应的氧化剂是硝酸钾 B、生成标准状况下2.24L , 反应共转移1mol电子 C、氧化产物与还原产物的物质的量之比为3∶1 D、电负性:O>N>C>K7. 下列离子方程式正确的是A、向碘化亚铁溶液中滴加少量稀硝酸: B、向中加入: C、用足量溶液吸收氯气: D、由水电离的的溶液中滴加少量溶液:8. 下列说法错误的是A、乙烯是无色、无味的气态烃,能使酸性褪色 B、蚕丝织成的丝绸灼烧时会产生烧焦羽毛气味 C、新鲜土豆片中含有淀粉,遇碘水出现蓝色 D、DNA分子的双螺旋结构中,两条链上的碱基通过氢键作用实现配对9. 乙酸异丁香酚酯是一种食用香料,其结构简式如图所示,下列说法正确的是 A、该化合物易溶于水 B、该化合物用足量氢气还原后的产物分子中有4个手性C C、该化合物与能发生加成反应、取代反应 D、1mol该化合物与足量NaOH溶液反应,最多可消耗3molNaOH10. X、Y、Z、W、R五种前20号主族元素,原子序数依次增大。基态X原子中有3个未成对电子,Z是元素周期表中电负性最大的元素,Y和W同主族,常温下的最高价氧化物对应的水化物溶液的pH=12。下列说法正确的是A、简单离子半径:r(W)<r(R) B、最高正价:X<Y<Z C、第一电离能: D、简单氢化物的键角:Y>W11. 为实现碳中和,可通过电解法用制备 , 电解装置如图,下列说法错误的是
A、该化合物易溶于水 B、该化合物用足量氢气还原后的产物分子中有4个手性C C、该化合物与能发生加成反应、取代反应 D、1mol该化合物与足量NaOH溶液反应,最多可消耗3molNaOH10. X、Y、Z、W、R五种前20号主族元素,原子序数依次增大。基态X原子中有3个未成对电子,Z是元素周期表中电负性最大的元素,Y和W同主族,常温下的最高价氧化物对应的水化物溶液的pH=12。下列说法正确的是A、简单离子半径:r(W)<r(R) B、最高正价:X<Y<Z C、第一电离能: D、简单氢化物的键角:Y>W11. 为实现碳中和,可通过电解法用制备 , 电解装置如图,下列说法错误的是 A、玻碳电极为阳极,发生氧化反应 B、铂电极的电极反应: C、制得28g时,产生32g D、电解一段时间后,右池中溶液的pH可能不变12. (三氟化硼)熔点-127℃,沸点-100℃,水解生成(硼酸,结构如图)和(氟硼酸),与氨气相遇立即生成白色的(氨合三氟化硼)固体。下列说法错误的是
A、玻碳电极为阳极,发生氧化反应 B、铂电极的电极反应: C、制得28g时,产生32g D、电解一段时间后,右池中溶液的pH可能不变12. (三氟化硼)熔点-127℃,沸点-100℃,水解生成(硼酸,结构如图)和(氟硼酸),与氨气相遇立即生成白色的(氨合三氟化硼)固体。下列说法错误的是 A、和中心硼原子杂化方式不同 B、晶体含有6mol氢键 C、显酸性原因: D、结构式为
A、和中心硼原子杂化方式不同 B、晶体含有6mol氢键 C、显酸性原因: D、结构式为 13. 如图为某实验测得溶液在升温过程中(不考虑水挥发)的pH变化曲线。下列说法错误的是
13. 如图为某实验测得溶液在升温过程中(不考虑水挥发)的pH变化曲线。下列说法错误的是 A、ab段,随温度升高而增大 B、a点溶液和d点溶液的相同 C、a点时, D、bc段可能发生反应:14. 甲基叔丁基醚(MTBE)是一种高辛烷值汽油添加剂,可由甲醇和异丁烯(以IB表示)在催化剂作用下合成,其反应过程中各物质相对能量与反应历程的关系如图所示(其中表示甲醇和异丁烯同时被吸附,表示甲醇先被吸附,表示异丁烯先被吸附),下列说法错误的是
A、ab段,随温度升高而增大 B、a点溶液和d点溶液的相同 C、a点时, D、bc段可能发生反应:14. 甲基叔丁基醚(MTBE)是一种高辛烷值汽油添加剂,可由甲醇和异丁烯(以IB表示)在催化剂作用下合成,其反应过程中各物质相对能量与反应历程的关系如图所示(其中表示甲醇和异丁烯同时被吸附,表示甲醇先被吸附,表示异丁烯先被吸附),下列说法错误的是 A、三种反应历程中,反应速率最快 B、该条件下反应的热化学方程式为: C、甲醇比IB更易被催化剂吸附,所以若甲醇过多会占据催化剂表面从而减慢合成速率 D、同温同压下,只要起始投料相同,相同时间三种途径MTBE的产率一定相同15. 牙齿表面由一层坚硬的、组成为Ca5(PO4)3OH的物质保护着,人进食后,细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,向牙膏中添加NaHCO3、NaF均可增强护齿效果。已知:
A、三种反应历程中,反应速率最快 B、该条件下反应的热化学方程式为: C、甲醇比IB更易被催化剂吸附,所以若甲醇过多会占据催化剂表面从而减慢合成速率 D、同温同压下,只要起始投料相同,相同时间三种途径MTBE的产率一定相同15. 牙齿表面由一层坚硬的、组成为Ca5(PO4)3OH的物质保护着,人进食后,细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,向牙膏中添加NaHCO3、NaF均可增强护齿效果。已知:物质
或
下列说法正确的是
A、溶解的离子方程式为: B、牙膏中经常添加碳酸钙,主要是为了增加Ca2+浓度,抑制牙齿腐蚀 C、当时,可与反应转化为 D、向牙膏中添加NaHCO3、NaF均可增强护齿效果,两者原理相同二、多选题
-
16. 探究含硫化合物的性质,下列方案设计、现象和结论都正确的是
选项
实验方案
现象
结论
A
向紫色石蕊溶液中通入过量二氧化硫
溶液先变红后褪色
为酸性氧化物且具有漂白性
B
向溶液中滴加过量溶液
产生黑色沉淀
静置后的上层清液中有
C
向某溶液中先滴加适量稀硝酸,再滴加少量溶液
开始无明显现象,后出现白色沉淀
原溶液中含有、、中的一种或几种
D
室温下用pH试纸分别测定浓度均为的和两种溶液的pH
pH:
结合能力:
A、A B、B C、C D、D三、非选择题
-
17. 铬(Cr)及其化合物用途广泛。请回答:(1)、基态铬原子的价层电子排布式 , 属于周期表的区。同周期的基态原子中,与Cr最高能层电子数相同的还有(写元素符号)。(2)、的三种结构:①、②、③ , 下列说法正确的是____。A、①②③中Cr的配位数都是6 B、①中配合离子空间结构为
 或
或 (已略去位于正八面体中心的Cr)
C、②中存在的化学键有离子键、共价键、配位键和氢键
D、等物质的量的①②③分别与足量溶液反应,得到AgCl物质的量也相等
(3)、对配合物进行加热时,配体比更容易失去,请解释原因。(4)、铬的一种氮化物晶体的立方晶胞结构如图所示,若该晶体的密度为 , 阿伏加德罗常数为 , 则晶胞中Cr原子之间的最近核间距为pm(写出表达式即可)。
(已略去位于正八面体中心的Cr)
C、②中存在的化学键有离子键、共价键、配位键和氢键
D、等物质的量的①②③分别与足量溶液反应,得到AgCl物质的量也相等
(3)、对配合物进行加热时,配体比更容易失去,请解释原因。(4)、铬的一种氮化物晶体的立方晶胞结构如图所示,若该晶体的密度为 , 阿伏加德罗常数为 , 则晶胞中Cr原子之间的最近核间距为pm(写出表达式即可)。 18. 黄色固体化合物X由三种元素组成,某学习小组按如下流程进行实验(题中各物质状态均为室温条件状态):
18. 黄色固体化合物X由三种元素组成,某学习小组按如下流程进行实验(题中各物质状态均为室温条件状态):
已知:A、B、D、F、G均是纯净物。
请回答:
(1)、X的组成元素是 , X的化学式是。(2)、写出化合物X生成蓝色固体F的化学反应方程式。(3)、固体G能缓慢溶于氨水,写出该反应的离子方程式。(4)、设计实验检验溶液E中的阴离子。19. 甲醇是一种理想的可再生清洁能源,近年来随着环保督查、碳双控等政策的实施,我国甲醇产能利用率不断提升。I.和在一定条件下合成甲醇:
(1)、根据如图相关物质的能量,计算。 (2)、向容积均为0.5L的恒容密闭容器中分别充入0.1mol和0.3mol , 在两种催化剂(I和II)、不同温度下发生上述反应,经过相同时间,测得的转化率与温度的关系曲线如图所示(已知此实验条件下催化剂均未失活)。下列说法正确的是____。
(2)、向容积均为0.5L的恒容密闭容器中分别充入0.1mol和0.3mol , 在两种催化剂(I和II)、不同温度下发生上述反应,经过相同时间,测得的转化率与温度的关系曲线如图所示(已知此实验条件下催化剂均未失活)。下列说法正确的是____。 A、催化效率较高的是催化剂II B、A点一定小于C点的 C、C点的正反应速率: D、温度区,的转化率随温度升高均增大的原因是:反应未达平衡,随温度升高反应速率加快,相同时间内转化率增大(3)、将和分别充入甲、乙两个恒容密闭容器中发生反应,相关数据如下表所示,测得不同温度下甲容器内的平衡转化率曲线甲如图所示。
A、催化效率较高的是催化剂II B、A点一定小于C点的 C、C点的正反应速率: D、温度区,的转化率随温度升高均增大的原因是:反应未达平衡,随温度升高反应速率加快,相同时间内转化率增大(3)、将和分别充入甲、乙两个恒容密闭容器中发生反应,相关数据如下表所示,测得不同温度下甲容器内的平衡转化率曲线甲如图所示。
容积
甲容器
VL
1mol
amol
乙容器
VL
2mol
2amol
①请在图中画出乙容器中的平衡转化率曲线乙。
②当乙容器中的平衡转化率与甲容器M点相同时,该反应的平衡常数之比。
(4)、II.已知反应是目前大规模制取氢气的方法之一。实验发现,其他条件不变时向上述体系中投入一定量的CaO,反应相同时间测得的体积分数增大,其可能的原因是。
20. 三氯乙醛()是无色油状液体,是制取农药的常用原料。某小组探究制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。
已知:①制备原理: , (保持70℃左右)
②有关物质的性质:
相对分子质量
熔点/℃
沸点/℃
溶解性
密度/
乙醇
46
-117
78.5
与水互溶
0.789
三氯乙醛
147.5
-57.5
97.8
溶于水、乙醇
1.51
请回答:
(1)、仪器a的名称为。若发现D中导管口处气泡速率过快,合理的解决方法是。(2)、下列说法错误的是____。 A、本实验较合理的加热方式是水浴加热 B、多孔球泡可以增大反应物接触面积,提高反应速率 C、为证明D中产生HCl,需要在D和E之间增加装置(如图) D、反应后的混合物可采用分液操作进一步分离、提纯三氯乙醛(3)、若撤去装置C会导致产率降低,原因是。(4)、粗产品纯度的测定:称取5.00g粗产品溶于水配成100mL溶液,量取10.00mL于锥形瓶中,加入25.00mL碘标准溶液,再加入适量溶液。反应完全后加适量盐酸调节溶液的pH,立即用溶液滴定至淡黄色,加入淀粉指示剂,继续滴定至终点。重复上述操作3次,平均消耗溶液20.00mL。(测定原理:、、)
A、本实验较合理的加热方式是水浴加热 B、多孔球泡可以增大反应物接触面积,提高反应速率 C、为证明D中产生HCl,需要在D和E之间增加装置(如图) D、反应后的混合物可采用分液操作进一步分离、提纯三氯乙醛(3)、若撤去装置C会导致产率降低,原因是。(4)、粗产品纯度的测定:称取5.00g粗产品溶于水配成100mL溶液,量取10.00mL于锥形瓶中,加入25.00mL碘标准溶液,再加入适量溶液。反应完全后加适量盐酸调节溶液的pH,立即用溶液滴定至淡黄色,加入淀粉指示剂,继续滴定至终点。重复上述操作3次,平均消耗溶液20.00mL。(测定原理:、、)①选出正确的滴定操作并排序:检查是否漏水→蒸馏水洗涤标准溶液润洗滴定管→→到达滴定终点,停止滴定,记录读数。
a.调整管中液面至“0”或“0”刻度以下,记录读数
b.调整管中液面,用胶头滴管滴加标准液恰好到“0”刻度
c.锥形瓶放于滴定管下,边滴边摇动锥形瓶,眼睛注视锥形瓶内颜色变化
d.装入标准液至“0”刻度以上2~3mL,固定好滴定管
e.锥形瓶放于滴定管下,边滴边摇动锥形瓶,眼睛注视滴定管内液面变化
f.如图操作
 , 排出滴定管尖嘴部分的气泡
, 排出滴定管尖嘴部分的气泡g.如图操作
 , 排出滴定管尖嘴部分的气泡
, 排出滴定管尖嘴部分的气泡②产品的纯度是%(计算结果保留2位小数)
21. 某种抗前列腺癌症的药物F的合成路线如下: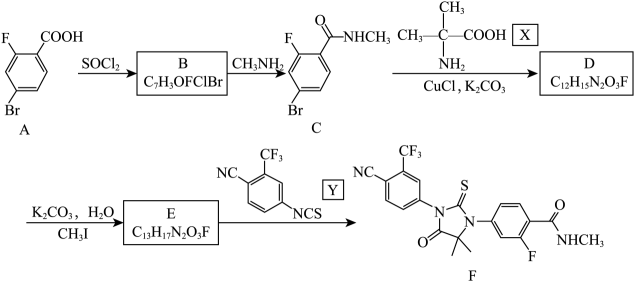
已知:

请回答下列问题:
(1)、写出C中含氧官能团的名称 , E的结构简式为。(2)、下列说法正确的是____。A、化合物A属于卤代烃 B、化合物F的化学式为 C、由A→E过程中涉及的有机反应类型有2种 D、由E+Y→F过程中有生成(3)、写出C→D的化学方程式。(4)、 是制备X的中间体,请设计以丙烯为原料合成
是制备X的中间体,请设计以丙烯为原料合成 的路线(用流程图表示,无机试剂任选)。 (5)、化合物C在一定条件可得到化合物G(
的路线(用流程图表示,无机试剂任选)。 (5)、化合物C在一定条件可得到化合物G( ),写出同时满足下列条件的G的同分异构体的结构简式。
),写出同时满足下列条件的G的同分异构体的结构简式。①分子中除苯环外还有1个环,苯环上只有1个取代基;
②谱和IR谱检测表明:分子中共有6种不同化学环境的氢原子,有N—O结构
-